趋化因子CXCL16在肝衰竭患者血清中的表达及意义
封丽琴 赵彩彦
·论著·
趋化因子CXCL16在肝衰竭患者血清中的表达及意义
封丽琴 赵彩彦
目的探讨趋化因子CXCL16在肝衰竭患者血清中的表达及临床意义。方法采用双抗体夹心酶联免疫吸附法(ELISA)检测肝衰竭患者(n=19)及健康对照组(n=16)血清CXCL16的浓度。结果肝衰竭组和健康对照组血清CXCL16浓度比较,差异有统计学意义(t=3.446,P<0.01)。结论趋化因子CXCLl6可能参与了肝衰竭(LF)患者肝脏炎症损伤,可能是导致肝衰竭发病的发病机制之一。
趋化因子;CXCLl6;肝衰竭(LF);酶联免疫吸附法
随着社会的发展,感染性疾病及肿瘤是威胁世界人类生命健康最常见的两种疾病,而乙型肝炎病毒(hepatitis B virus,HBV)感染是常见感染性疾病之一,该疾病常可导致急性病毒性肝炎、慢性病毒性肝炎、肝硬化、肝衰竭及肝癌甚至死亡。据世界卫生组织(WHO)统计乙型肝炎病毒感染是世界上造成人类死亡的第9大原因,严重的危害人们的生命。而我国更是乙型肝炎病毒感染的高发地区之一,据不完全统计我国成年人乙肝病毒感染率约60%,大约25%呈现急性病毒性肝炎,其中大多数感染者能清除乙肝病毒,有大约10%乙肝病毒感染者可发展成慢性肝炎,并可反复发作,可发展成肝硬化甚至癌变[1]。有少数病毒感染者可发展成重型肝炎即肝衰竭,病死率极高。近些年来,医学科学有了很大的进步,并在儿童期进行了乙型病毒的计划免疫,但仍有许多急性肝炎感染患者转为慢性乙型肝炎、慢性迁延性肝炎甚至肝衰竭导致死亡。国内外有许多研究机构对其有深入研究,但其发病机制仍尚未完全明了。近年来国内外研究发现趋化因子在肝衰竭中发挥了重要作用。其中趋化因子CXCL16在患者血清中的表达变化规律与肝衰竭的关系国内研究尚少报道。本实验通过收集肝衰竭患者血清检测患者CXCL16的变化,研究CXCL16参与肝衰竭发病的可能机制。
1 资料与方法
1.1 一般资料 2013年1月至2014年1月石家庄市第五医院肝病科住院的19例肝衰竭患者。其中,男16例,女3例;年龄31~70岁。患者均有乙型肝炎病史,有Ⅱ度以上肝性脑病,乏力、皮肤巩膜黄染,胆红素明显升高。16例正常健康者(对照组),来自门诊部体检中心的健康体检者。其中男12例,女4例;年龄36~65岁。2组间一般资料有可比性。
1.2 入选与排除标准
1.2.1 入选标准:①肝衰竭患者符合中华医学会感染病学分会肝衰竭与人工肝学组中华医学会肝病学分会重型肝病共同制定的《肝学组肝衰竭诊治指南(2012年版)》。②年龄31~71岁。
1.2.2 排除标准:通过病史采集、腹部B超或腹部CT排除酒精肝、脂肪肝及自身免疫性肝炎等。排除甲、丙、丁、戊、庚型病毒及酒精肝、脂肪肝、自身免疫性肝炎、先天性代谢疾病等引起的肝炎;并排除患有艾滋病、结核等其他感染性疾病;并排除类风湿性关节炎、系统性红斑狼疮等免疫性疾病。研究经医院伦理委员会批准,患者外周血留取均征得患者同意,并签署书面知情同意书。
1.3 主要仪器、试剂及实验过程 美国全自动酶标分析仪检测趋化因子CXCL16,趋化因子CXCLl6 ELISA检测试剂盒。盒购自武汉优尔生科技股份有限公司,生产商为美国Cloud-Clone 公司,操作过程按试剂盒说明进行。(1)在波长为450 nm的全自动酶标仪上读出每孔标准品、待测血清的OD值,因标准品是双孔,计算每种标准品的平均OD值。(2)采用深圳晶美生物技术有限公司提供的Curve Exper 1.3软件,以标准品平均OD值为纵坐标,以标准品浓度为横坐标绘制标准品曲线,然后根据各样品孔的OD值计算相应的浓度范围。(3) 按照下列公式计算出CXCL16的浓度:Quadratic Fit:y=a+bx+cx^2,Coefficient Data:a=-0.023 b=2.636 c=0.127。
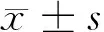
2 结果
2.1 肝衰竭组和对照组的血清CXCL16浓度分别为(3.71±2.23)ng/ml,(1.21±0.59)ng/ml,差异有统计学意义(t=3.446,P<0.01)。
2.2 趋化因子CXCL16的标准曲线 见图1。

图1 1趋化因子CXCLl6的标准曲线
3 讨论
我国是乙型肝炎的高发地区,随着乙型肝炎疫苗的广泛使用及生活水平的提高,乙型病毒性肝炎的发病报告率持续下降,在一般人群乙肝表面抗原阳性流行率已有9.75%下降为7.18%。但在法定传染病报告中,病毒性肝炎的发病率与病死率仍均占首位。2010年全国报告乙肝发病人数为106万。据全国统计调查,我国一般人群中估计约9 300万国人为慢性乙肝病毒感染,占世界该病感染者的1/3左右。其中目前我国现有慢性病毒性肝炎患者约2 700万人,仍然严重的危害人们的健康。
在临床上乙型肝炎病毒感染包括隐形感染到急性病毒性肝炎,有时甚至发生急性重症肝炎即肝衰竭。乙型病毒性肝炎的发病机制非常的复杂,到目前为止其发病机制仍未完全明了,有待继续研究。目前大多认为免疫病理损伤机制在其中起着重要作用,肝细胞病变主要取决于患者机体的免疫应答,尤其是细胞免疫应答。各种原因导致的乙型肝炎病毒复制增加均可启动患者机体对病毒的免疫应答反应。患者机体的免疫应答不同,可导致临床表现各异。当人的机体处于免疫耐受时,不发生免疫应答,成为无症状的携带者,而当人的机体免疫功能正常时,则多可能表现为急性病毒性肝炎的发生,当机体免疫功能低下、不完全免疫耐受、自身免疫反应产生、乙型肝炎病毒基因突变逃逸免疫清除等情况下,均可导致慢性肝炎的发生;当患者机体处于超敏反应,大量的抗原-抗体复合物产生并激活补体系统并在肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素-1,6(inter-leukin-1,6)、内毒素等参与下,可导致大片肝细胞坏死,发生重型肝炎即肝衰竭的出现。
有学者研究认为,炎性细胞表面趋化因子(CK)与炎性细胞表面相应趋化因子受体相互作用在其中共同发挥了关键作用[2,3]。趋化因子也称趋化激素、趋化素或化学激素,是一类可刺激白细胞趋化性的小分子的细胞因子,由白细胞分泌,对中性粒细胞、单核细胞、淋巴细胞和嗜酸性粒细胞等等具有很强大的趋化作用和激活作用。在机体的抗感染中发挥重要作用。该因子能吸引免疫细胞到免疫应答部位,共同参与机体免疫调节和免疫病理反应。它们共同机构特征包括分子量小,多为小于100个氨基酸的小分子糖蛋白,有4个位置保守的半胱氨酸残基以保证其三级结构,根据其氨基末端2个半胱氨酸残基是直接相连还是被氨基酸分开,分为4群,分别为CXC亚族(α亚族)、CC亚族(β亚族)、C亚族(γ亚族)和CX3C亚族(δ亚族)4个亚家族 。趋化因子CXCL16属于CXC趋化因子家族,是由国外学者发现的一个趋化因子[4,5]。他们根据该类趋化因子氨基端含CXC模序的特点,将其划归为CXC亚家族,命名它为CXCL16。趋化因子CXCL16与乙型病毒性肝炎的关系的基础研究与临床研究近几年国内外研究较多。Dong等[6]早在2002年分析鼠暴发性肝炎模型肝组织中细胞因子、趋化因子变化时就发现趋化因子CXCL16的表达异常。学者Xu等[7]在2005年在细菌内毒素引起大鼠暴发性肝炎模型的发病过程中也发现CXCL16在将T淋巴细胞迁移到肝脏过程中发挥了重要作用。同时发现在对实验大鼠模型应用抗-CXCL16单克隆抗体后可明显降低实验大鼠模型转氨酶、并下调血清肿瘤坏死因子-α、细胞凋亡因子FasL的表达,应用单克隆抗体有效的减轻肝坏死,明显降低了发生暴发性肝炎大鼠动物模型的死亡率。国内学者徐焕宾等[8]研究发现,趋化因子CXCL16在肝损伤组织与肝脏病理损伤程度有关。在小鼠免疫性肝损伤动物模型中,将趋化因子CXCL16抗体用于体内阻断CXCL16生物活性,肝脏的损伤得到了很明显的改善,且降低了丙氨酸氨基转移酶的水平,明显延长了小鼠的存活率,提示CXCL16在小鼠免疫性肝损伤中起到了重要作用。该研究者在应用特异抗CXCL16抗体阻断可以明显降低相应的肿瘤坏死-α和凋亡因子Fas-FasL的表达,从而改善肝组织的病理损伤的发生[9]。国内杨勇等[10]2008年研究发现,急性乙型肝炎病例组及慢性乙型肝炎病例组血清CXCL16浓度水平均高于正常健康对照组,血清CXCL16浓度与乙型肝炎的病情相关,随着乙型肝炎病情加重而加重。
我们的试验研究通过采用酶联免疫法(ELISA法)检测了肝衰竭病例组及正常健康对照组外周血清CXCL16浓度发现,肝衰竭组和对照组的血清CXCL16浓度差异有统计学意义(t=3.446,P<0.01),提示趋化因子CXCL16或许参与了将免疫细胞募集到发生炎症的肝脏,这与国内外学者对趋化因子CXCL16的研究结果符合。在肝衰竭即重症肝炎患者发病过程中,CXCL16同样也可能发挥了重要作用。
综上所述,在肝衰竭发病过程中,趋化因子CXCL16可能参与了肝衰竭的炎症损伤过程,可能是肝衰竭发病机制之一,但其详细发病机制有待进一步研究探索。
1 黄文林主编.分子病毒学.第1版.北京:人民卫生出版社,2002.178-180.
2 李玉林主编.病理学.第6版,北京:人民卫生出版社,2003.112-113.
3 Paul WE.Fundamental Immunology.Fourth Edition,Philadel-phia:Lippincott Williams&Wikkins Inc,2003,1160-1161.
4 Matloubin M,David A,Engel S,et al.A transmembrane CXC Chemokine is a ligand for HⅣ-coreceptor BONZ0.Nat Immunol,2000,1:298-304.
5 Wilbanks A,Zondlo S,Murphy K,et al.Expression cLoning of the STRL33/BONZ0/TYMSTR ligand reve-als elements of CC.CXC and CX3C chemokines.J Immunol,2001,166:5145-5154.
6 Dong H,Toyoda N,Yoneyama H,et al.Gene expression profile analysis of the mouse liver during bacteria-induced fulminant hepatitis by a cDNA microarray system .Biochem Biophys Res Commun,2006,298:675-686.
7 Xu H,Xu W,Chu Y,et al.Involvement of Up—Regulsted CXC Chemokine Ligand 16/Scavenger Receptor That Binds Phospha-tidylserine and Oxidized lipoprotein in Endotoxin-Induced Lethal Liver Injury via Regulation of T-Cell Recruitment and Adhesion.Infect Immun,2005,73:4007-4016.
8 徐焕宾,龚燕萍,储以微,等.CXCLl6抗体可阻断BCG和LPS诱导的小鼠免疫性肝损伤.中华微生物学和免疫学杂志,2005,25:114-115.
9 徐焕宾,龚燕萍,储以微,等.CXCLl6趋化因子在小鼠免疫性肝损伤中的作用.中国免疫学杂志,2004,20:369-373.
10 杨勇,刘佩芝,詹爱琴.乙型肝炎患者血清趋化因子CXCL16的检测及其意义.临床肝胆病杂志,2008,24:114-116.
10.3969/j.issn.1002-7386.2014.12.010
050021 河北省石家庄市第五医院ICU(封丽琴);河北医科大学第三医院感染科(赵彩彦)
赵彩彦,050051 河北医科大学第三医院感染科;
E-mail:zhaocy2005@163.com
R 575.3
A
1002-7386(2014)12-1788-03
2014-01-03)

