快速高效从石蜡包埋肿瘤组织中提取micro-RNA方法的研究
李江超,杨 扬,郝卓芳,周晓明,章倩倩,王丽京*(.广东药学院血管生物研究所,广东 广州 50006;.广州医科大学第二附属医院病理科,广东 广州 5060;.广东药学院基础医学院,广东 广州 50006)
·论著·
快速高效从石蜡包埋肿瘤组织中提取micro-RNA方法的研究
李江超1,杨 扬1,郝卓芳2,周晓明3,章倩倩1,王丽京1*
(1.广东药学院血管生物研究所,广东 广州 510006;2.广州医科大学第二附属医院病理科,广东 广州 510260;3.广东药学院基础医学院,广东 广州 510006)
目的探索一种从石蜡包埋组织标本中快速、便捷、低成本的提取miRNAs的方法。方法收集2年内石蜡包埋的人乳腺癌组织和保存6个月的MMTV基因工程小鼠乳腺癌组织石蜡样本,同时选用进口A公司生产的提取石蜡组织miRNAs试剂盒作为对照;通过2种方法提取人和鼠的石蜡切片中miRNAs做对比分析,包括采用凝胶电泳验证,检测miRNA纯度、浓度分析。为了进一步验证其提取效果,采用定量PCR对所提取的总miRNAs进行miRNA-375和miR-218检测。结果①采用本实验方法从石蜡包埋乳腺癌组织中提取的miRNAs其纯度在1.86~2.21OD之间,其浓度可以满足常规实验要求(最低38.50mg/L);②荧光定量PCR能够检测到miRNA-375和miRNA-218,其拷贝数与对照组比较,2种方法差异无统计学意义(P>0.05)。③该方法提取时间短、成本低,成本是试剂盒法的1/10,提取时间至少节省1/3。结论从石蜡包埋组织标本中提取miRNAs方法切实可行,为从石蜡组织样本提取miRNA进行分子诊断和肿瘤相关的研究提供了便利,对采用回顾性石蜡标本研究miRNAs提供了有力的帮助。
石蜡包埋组织;microRNAs;microRNA提取;乳腺癌
微小RNAs(miRNAs)是18~20bp的非编码RNA,在转录水平靶向3′端UTR(非翻译区)干扰特定基因的表达。miRNAs不同于mRNA的一个特性是不易被降解,石蜡包埋组织中miRNAs被用来做回顾性研究成为热点,另外,miRNA在分子诊断中被关注。石蜡包埋组织是医院最常用的保存标本方法,能够保存多年。近年来,越来越多的研究需要从石蜡组织中提取miRNA进行研究。关于提取miRNAs的产品已经商品化,但其方法和步骤仍旧繁琐冗长,且成本昂贵。鉴于上述问题,本研究基于miRNAs不降解特性和核酸提取原理,总结出快速、简单提取所需石蜡组织组织中的miRNAs方法,优化了实验步骤,加快了提取速度,降低了其成本,在临床或科研上有着实际应用价值,现报告如下。
1 材料与方法
1.1 标本来源:2010年12月—2012年12月广州医学院附属第二医院病理科收集的20例乳腺癌手术患者的石蜡标本,患者全部为女性,年龄42~53岁,平均(48.0±3.2)岁。MMTV小鼠乳腺癌石蜡标本是广东医学院血管生物研究所2012年9月包埋的石蜡组织。提取时,将石蜡组织进行8μm切片备用。采购的试剂盒提取作为对照,本研究所用的miRNA提取方法作为实验组。
1.2 主要试剂和仪器:NaCl、RNA核酸收集柱购自北京天根生物技术公司,高速小型离心机、核酸蛋白浓度测量仪、miRNA石蜡组织提取试剂盒(A公司,美国)、RNA逆转录试剂购自广州复能生物科技有限公司,荧光定量SYBRgreenMix试剂购自Takara公司,miRNA375和miRNA218引物以及逆转录购自广州锐博生物技术有限公司。
1.3miRNA提取
1.3.1A公司试剂盒:石蜡包埋组织切取8μm切片,按照试剂盒说明书提取(本研究中简称方法A),具体步骤与A公司的石蜡组织miRNA提取试剂盒相一致。
1.3.2miRNA提取新方法(本研究中简称方法B):①脱蜡,将待处理的石蜡包埋组织切成厚度为8μm的组织片,取4片组织片置于无菌的1.5mL离心管内,加入1mL二甲苯或石蜡透明剂(上海宏兹生物公司),漩涡振荡混匀,55℃水浴10min,室温条件下,12 000r/min离心3min,弃上清;加1mL无水乙醇,混匀,室温条件下,12 000r/min离心3min,弃上清,重复操作1次,所得样品37℃空气干燥20min。②蛋白消化,向步骤①所得样品中加入150μL消化缓冲液(含DNaseI酶)和10μL20mg/mL蛋白酶K,56℃水浴20min;85℃水浴10min。消化液配制,ProteinaseKbuffer250mL(1molTris-ClpH=8.0)2.5mL;0.5MEDTA(pH8.0)2.5mL;加水H2O定容至250mL)。③miRNA提取,冷却后,继续添加4mol的NaCl320μL,混合均匀,静止2min。然后加入1 120μL无水乙醇,吹打均匀,RNA离心柱过滤,12 000r/min离心1min,弃上清,加80%酒精吹均匀,12 000r/min离心10min。丢上清,室温干燥30min,20μL无核酶水溶解。④纯化、收集,加40μL的90℃预热的无核酸酶水,室温静置30min,12 000r/min离心1min,反复收集1次,可以提高获得率。
1.3.3SYBRgreenqPCR:将上述2种方法提取的miRNA,按照锐博公司提供的逆转录引物说明书进行逆转录,得到的cDNA用于荧光实时定量PCR检测。荧光定量实验操作按照TakaraqPCRMix说明书进行。PCR扩增反应条件为94℃预变性2min,94℃40s,62℃40s,72℃30s,40个循环。使用伯乐公司的荧光定量PCR仪检测。内参miRNA采用U6作对照。

2 结 果
2.1 琼脂糖电泳检测RNA的提取:使用电泳检测方法B和方法A提取的microRNAs(miRNAs)显示,形成彗星扫尾状亮区条带(图1)。初步说明采用本方法所述可以提取到总miRNAs。对照组第1~3泳道为A方法提取、第4~6泳道为B方法提取。样品RNA成彗星尾状条带,表明采用我们的方法提取到总miRNAs是可以用电泳检测到的。

图1 2种方法提取miRNAs凝胶电泳图对比
M.表示相对分子质量的大小(100、250、500、750、1 000、2 000bp);1~3.A方法提取的结果;4~6.B方法提取的结果;1~6均呈现出慧星样电泳,表明用2%琼脂糖电泳检测,2种方法提取的效果无明显差别
Figure1TheanalysisoftotalmiRNAsextractedwithtwomethodsby2%agarosegelelectrophoresis
M.indicatingM2000marker(100,250,500,750,1 000,2 000bp);andline1-3withAmethod;whileline4-6withBmethod;Line1-6ofthemiRNAsareshowntheaboutsamesmear.TheresultsshowedthemethodBwaseffectiveandmiRNAscouldbedetectednodifferencecomparingtomethodAby2%agarosegelelectrophoresis
2.2 提取的miRNAs的质量分析:为了验证方法B提取的miRNAs的质量,我们通过微量核酸测定仪检测其OD值,该方法提取的microRNA,无论是MMTV基因工程鼠乳腺癌石蜡组织还是人的乳腺癌石蜡组织,通过紫外分光光度计检测OD值以及计算260/280比值,结果提示其浓度完全可以满足PCR逆转录的需要(10ng~1μg)260/280比值>1.8,说明所提取的miRNAs在正常范围(OD值在1.8~2.2之间属于正常范围)。其石蜡标本的时间从2个月或2年的标本均可以满足需要,见表1。
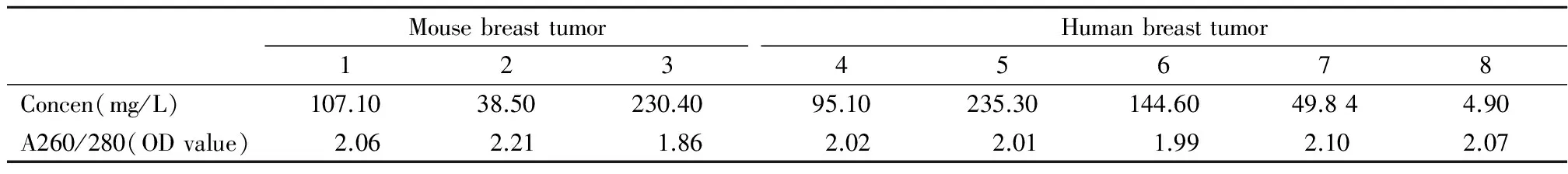
表1 核酸检测仪检测的miRNA的纯度和浓度Table 1 The quality test of miRNAs extracted from MMTV mice paraffin samples and human breast cancer tissue by nucleic acid detector
2.3 提取的miRNAs可以用于特异性引物的检测:上述已经对该方法提取的miRNA质量进行检测,为了进一步检测该方法提取的miRNA是否可以特异性的应用于荧光定量PCR,对8个患者乳腺癌组织中的U6和miRNA-218进行验证,通过定量PCR分析,可以从图2中发现,其溶解曲线比较整齐,说明是引物特异性扩增,用方法B提取的miRNAs进行荧光定量PCR,所得miRNA均可以检测到内参U6和miR218的表达,其RT-PCR的融解曲线特异性好并且CT值接近。说明本方法能够取得miRNA可以应用于特异性引物的定量PCR检测。
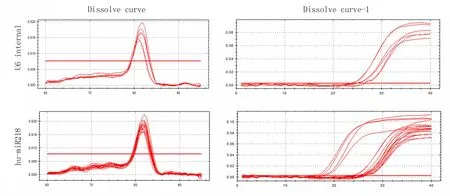
图2 采用方法B从石蜡组织标本中提取的miRNA可以满足miRNA荧光定量的检测
采用方法B所获得的miRNA通过RT-PCR实验,可以检测到U6和miRN218,并且溶解曲线显示出引物的特异性
Figure 2 miRNAs extracted from paraffin tissue samples met the requirement of detection of miRNA by quantitative RT-PCR
miRNA obtained from B method could be detected the expression of U6,and miRNA-218 expression level also could be detected with RT-PCR and solubility curve illustrated the primers were specific
2.4 提取的microRNA阈值的检测:上述实验证明特异性引物从所提取的miRNAs可以扩增出目的基因,为了验证采用方法B所提取的miRNA和国外进口试剂盒提取的miRNA效率的差异,检测了相同的8个标本的miRNA-218和miRNA-375表达量的变化,U6作为内参,分别对其逆转录后进行荧光定量PCR检测。结果显示,2种方法提取的miR218和miR375差异无统计学意义,见表2。
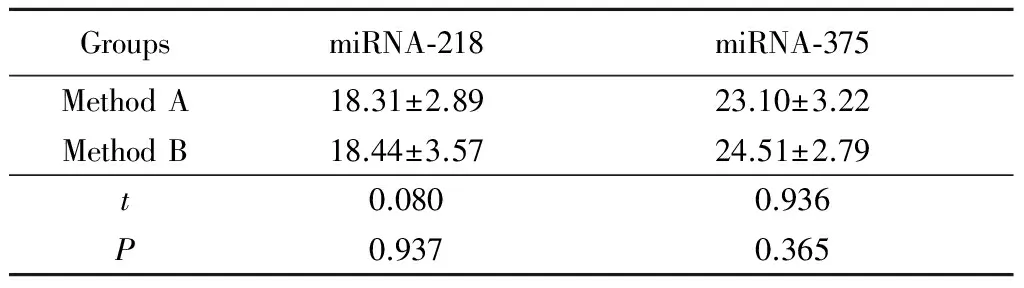
GroupsmiRNA⁃218miRNA⁃375MethodA18.31±2.8923.10±3.22MethodB18.44±3.5724.51±2.79t0.0800.936P0.9370.365
2.5 2种miRNA提取方法的经济和效率的对比:方法B经济,成本大约每样品7.0元,而进口试剂盒每个样品是70元;提取周期B方法是2~2.5h,而进口试剂盒的A方法时间大约是5~6h。B方法费用是进口试剂盒的1/10,而时间也大约节省了2/3。
3 讨 论
在肿瘤研究中,回顾性实验研究必不可少,最丰富而又最容易获得的是石蜡包埋保存的肿瘤组织。而优化和简化从石蜡标本中提取miRNA的方法,对有效利用这些宝贵的临床资源进行深入研究有着重要意义[1-3]。
目前,提取miRNA多依赖进口试剂盒。国内也有部分厂家在生产miRNA提取试剂盒,本研究正是在实践的基础上,总结得出一种实用、节约时间、低成本的miRNA提取方法,主要针对石蜡组织的miRNA提取。本研究实验所需的各种试剂都是常规实验室的试剂,可以随时配制,成本低,取材方便。同时,本研究在提取MMTV小鼠[4]和人的标本中,差异无统计学意义,表明该方法提取的miRNA可以用于后续实验研究。也说明该方法小鼠和人的种属差异影响不大,通过同进口试剂盒作对比可见,本法提取的miRNA质量在正常范围之内,且定量PCR检测其溶解曲线,提示用其扩增miRNA具有一定特异性。为了验证实验的可用性和提取效率,又经逆转录聚合酶链反应(reverse transcripatse polymerase chain reaction,RT-PCR)验证其拷贝数变化,结果显示2种方法提取的miRNA中miRNA-218和microRNA-375的表达差异均无统计学意义[5-7]。该方法提取的石蜡样本中miRNA能够用于后续的RT-PCR实验。
石蜡标本在病理科是最重要的材料和患者档案,在回顾性或总结性研究中有着极其重要的作用,很多医院都建立了大量的存档福尔马林固定石蜡包埋样本库,为科研提供了有力的研究工具。然而,石蜡包埋样本RNA的提取存在一定难度,主要与甲醛固定、保存时间与条件等因素相关,导致RNA部分降解。目前已有众多学者针对样本的固定时间、不同固定剂、保存方法等方面研究对RNA分子的影响[8-11]。miRNA不易降解,对充分应用这些材料提供了依据。目前,提取miRNA的步骤多且成本高,对可行前瞻性或回顾性研究产生不利的影响。所以,新的提取技术能够补充原有的技术,加快提取速度,节约成本,为有效利用并预测预后的miRNA表达提供帮助。同时,miRNA的鉴别与临床特征、预后及筛选出相关靶向分子或调控异常路径等都有重要关系[12-14]。
综上所述,本研究所述新方法为今后开展大量FFPE样本提取miRNA进行分子生物学研究提供了实验依据。诚然,本方法尚需要进一步完善,以便更好地为临床和肿瘤研究提供帮助。
[1] 孙冰,郭晓红,江泽飞,等.乳腺癌冰冻和石蜡包埋样本的RNA以及基因表达情况的比较研究[J].临床肿瘤学杂志,2010,15(7):588-592.
[2] 戴丹,徐燕丽.MicroRNA与恶性淋巴瘤相关性研究进展[J].河北医科大学学报,2009,30(10):1106-1108.
[3] LIU A,XU X.MicroRNA isolation from formalin-fixed,paraffin-embedded tissues[J].Methods Mol Biol,2011,724:259-267.
[4] FRANCI C,ZHOU J,JIANG Z,et al.Biomarkers of residual disease,disseminated tumor cells,and metastases in the MMTV-PyMT breast cancer model[J].PLoS One,2013,8(3):e58183.
[5] APPAIAH HN,GOSWAMI CP,MINA LA,et al.Persistent upregulation of U6:SNORD44 small RNA ratio in the serum of breast cancer patients[J].Breast Cancer Res,2011,13(5):R86.
[6] PRUDNIKOVA TY,MOSTOVICH LA,KASHUBA VI,et al.miRNA-218 contributes to the regulation of D-glucuronyl C5-epimerase expression in normal and tumor breast tissues[J].Epigenetics,2012,7(10):1109-1114.
[7] WARD A,BALWIERZ A,ZHANG JD,et al.Re-expression of microRNA-375 reverses both tamoxifen resistance and accompanying EMT-like properties in breast cancer[J].Oncogene,2013,32(9):1173-1182.
[8] GODFREY TE,KIM SH,CHAVIRA M,et al.Quantitative mRNA expression analysis from formalin-fixed,paraffin-embeddod tissues using 5'nuclease quantitative reverse transcription-polymerase chain reaction[J].J Mol Diagn,2000,2(2):84-91.
[9] VON AHLFEN S,MISSEL A,BENDRAT K,et al.Determinants of RNA quality from FFPE samples[J].PLoS One,2007,2(12):e1261.
[10] MASUDA N,OHNISHI T,KAWAMOTO S,et al.Analysis of chemical modification of RNA from formalin-fixed samples and optimization of molecular biology applications for such samples[J].Nucleic Acids Res,1999,27(22):4436-4443.
[11] GLOGHINI A,CANAL B,KLEIN U,et al.RT-PCR analysis of RNA extracted from Bouin--fixed and paraffin-embedded lymphoid tissues[J].J Mol Diagn,2004,6(4):290-296.
[12] 唐海林,武明花.miRNA失调控与肿瘤的发生发展[J].中南医学科学杂志,2013,41(1):1-6.
[13] 徐皓,张玉华,吴文溪.微RNA与肿瘤[J].国际肿瘤学杂志,2006,33(10):731-733.
[14] 吴晨鹏.MicroRNA在结直肠肿瘤中的研究进展[J].河北医科大学学报,2013,34(3):370-372.
(本文编辑:许卓文)
ANEFFICIENTANDRAPIDMETHODFORMICRORNAFROMPARAFFIN-EMBEDDEDTUMORTISSUE
LIJiangchao1,YANGYang1,HAOZhuofang2,ZHOUXiaoming3,ZHANGQianqian1,WANGLijing1*
(1.VascularBiologyResearchInstitute,GuangdongPharmaceuticalUniversity,Guangzhou510006,China;2.DepartmentofPathology,theSecondAffiliatedHospitalofGuangzhouMedicalUniversity,Guangzhou
510260,China;3.BasicMedicalCollegeofGuangdongPharmacyCollege,Guangzhou510006,China)
ObjectiveTolookforbetterandlowcostmethodforextractingmicroRNAs(miRNAs)fromparaffin-embeddedtissueformiRNAdiagnosisorothermiRNAsassay.MethodsThesampleswerecollectedfromparaffin-embeddedhumanbreastcancertissuestoredovertwoyearsandMMTVtransgenicmouseparaffin-embeddedbreasttissueoversixmonths.ThemiRNAsextractparaffintissuekitservedascontrol.TodetectthequalityofmiRNAsobtainedbythesetwomethods,used2%gelelectrophoresisandtheODvaluetoconfirmthequalityandconcentration.Furthermore,verifiedmiRNAsbytestingmiRNA-375andmiRNA-218withquantitativePCR.Results①miRNAsextractedbyourmethodmettheexperimentalrequirements(A260/280=1.86-2.21OD),andthelowestconcentrationwas38.50mg/L.②ThequantitativePCRcandetectmiRNAsanditscopiesnumbercomparedwiththecontrol,thedifferencewasnosignificant(P>0.05).③Thismethodhasrelativelylowercost,about1/10costofkitmethod,whiletheextractionprocessdecreasedabout1/3time.ConclusionThemethodweoptimizedforextractedmiRNAsfromparaffin-embeddedtissueisfeasible,itprovidesaconvenientexperimentalmethod,andabetterapproachtodetectmoreretrospectivespecimensofparaffin-embeddedtissuesamples.
paraffin-embeddedtissue;microRNA;extraction;breastcancer
2013-08-01;
2013-09-10
国家自然科学基金项目(31271455);广东省自然科学
基金项目(S2012040007658);广东省医学科研基金项目(A2013312)
李江超(1976-),男,河北晋州人,广东药学院血管生物研究所助理研究员,理学博士,从事肿瘤学基础研究。
R737.9
A
1007-3205(2014)05-0541-05
10.3969/j.issn.1007-3205.2014.05.015
*通讯作者

