卡介苗对支气管哮喘大鼠气道炎症的预防治疗作用及机制研究
刘晨涛 薄建萍 加 慧 董艳婷 田新瑞
支气管哮喘(bronchial asthma,简称哮喘),是由多种细胞及细胞组分参与的气道慢性炎症性疾病,以气道的高反应性(airway hyperreactivity, AHR)和气道炎症为重要特征。在气道炎症发生机制中,上皮细胞损伤、间质增生发挥主要作用。本研究通过复制哮喘大鼠气道炎症模型,给予地塞米松、接种卡介苗(Bacillus Calmette-Guérin, BCG)及BCG治疗干预,观察肺泡灌洗液(bronehoalveolar lavage fluid, BALF)细胞及嗜酸性粒细胞总数、上皮间质标志物变化,探讨气道上皮细胞的损伤和间质改变在哮喘气道炎症发病机制中的作用及BCG对支气管哮喘气道炎症的预防治疗作用及机制。
材料与方法
一、实验材料
选择SPF级Wistar雄性大鼠40只,2~3个月龄,体质量160~180 g(由山西医科大学实验动物中心提供),随机分为5组,每组8只动物。卵白蛋白(ovalbumin, OVA)(由美国sigma公司生产);氢氧化铝(aluminumhydroxide, Al(OH)3)(由天津化学试剂三厂生产),彩云JWC-201D型雾化器(由鞍山市同信医用仪器厂生产);地塞米松磷酸钠注射液5 mg/1 ml/支(山东新华制药股份有限公司);BCG 0.5 mg/支(成都生物制品研究所有限责任公司);TGF-β1 ELISA试剂盒(武汉博士德生物公司);E-cadherin 、Fibronectin、α-SMA小鼠抗大鼠一抗(SantaCruz公司),FITC标志的羊抗小鼠IgG(武汉博士德生物工程有限公司),SABC抗鼠试剂盒及DAB显色剂(武汉博士德生物公司)。
二、实验方法
1. 实验分组: 取40只SPF级Wistar雄性大鼠随机分为对照组、哮喘组、BCG治疗组、地塞米松治疗组、BCG接种组;哮喘组、BCG治疗组、地塞米松治疗组均于实验第1、8天对大鼠腹腔注射OVA 100 mg和氢氧化铝100 mg混悬液1 ml进行致敏,第15天开始每日激发前30 min分别给予腹腔注射蒸馏水0.16 ml、皮内注射BCG 0.025 mg、腹腔注射地塞米松0.25 mg/kg,并将大鼠置于自制的密闭雾化吸入箱内,予1% OVA蒸馏水30 ml雾化吸入30 min,1次/d,共2周。BCG接种组在OVA致敏前7、3、1 d,每只大鼠分别皮内注射BCG 0.025 mg,余处理同哮喘组,对照组均给予蒸馏水替代处理。
2. 标本制备: 每只大鼠在末次雾化后的24 h内用25%乌拉坦0.4 ml/100 g腹腔注射麻醉,打开胸腔,暴露心脏,心脏穿刺取血约5 ml,4 ℃,以离心半径8 cm,2000 r/min离心10 min,留取血清,置-80 ℃冰箱中保存待测;暴露气管,放留置针,用NS行左全肺灌洗,每次1 ml,充分回收,反复3次,共回收约2 ml,20 ℃,以离心半径8 cm,2000 r/min离心10 min,留取上清,置-80 ℃冰箱中保存,行ELISA检测,留取沉淀行细胞总数及嗜酸性粒细胞计数。取大鼠右肺,置0.1 mol/L的多聚甲醛中固定,用于组织病理学分析。HE染色观察支气管、小血管管壁、肺泡及肺间隔内细胞浸润情况、水肿和上皮损伤程度,支气管平滑肌改变情况等,免疫组织化学染色(SABC法)检测大鼠肺组织E-cadherin、α-SMA、Fibronectin的表达。
3. 图像分析: HE染色切片上100倍光镜下选择完整支气管横断面测量支气管基底膜周径(Pbm)。支气管总面积(At)、管腔面积(Ac)、平滑肌外缘内气管面积(AMe),平滑肌内缘内气管面积(AMi)。计算公式:支气管壁厚度=(At-Ac)/Pbra,平滑肌厚度=(AMe-AMi)/Pbm;衡量气道改变情况[1]。
三、统计学方法
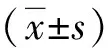
结 果
一、症状观察
哮喘组大鼠致敏激发后出现烦躁不安、抓耳挠腮、易惊、尖叫、然后伏俯不动、口唇紫绀、呼吸急促、大小便失禁、部分腹部肌痉挛等过敏反应[2-3];治疗组、接种组和对照组相对安静,过敏反应随治疗时间的延长症状渐减轻。
二、肺组织病理学检查
对照组肺组织及支气管均无炎症改变,见图1。哮喘组外观上见肺体积增大,表面肿胀,有不规则暗红色充血区;支气管及肺泡内黏液分泌增多,大量炎性细胞浸润:淋巴细胞、嗜酸性粒细胞、单核细胞等;支气管管壁变厚、气道变窄,气道上皮受损肿胀,部分可见脱落,见图2。BCG组、地米组、BCG接种组与哮喘组相比上述改变明显减轻,但变化仍明显于对照组,见图3。各组大鼠支气管肺泡灌洗液细胞总数及嗜酸性粒细胞计数,见表1。各组大鼠支气管管壁厚度,见表2。各组大鼠肺泡灌洗液、血清中TGF-β含量比较,见表3。各组大鼠肺组织中E-cadherin、β-catenin、α-SMA、Fibronectin表达的比较,见表4。

表1 各组大鼠支气管肺泡灌洗液(BALF)中细胞总数及嗜酸性粒细胞计数(EOS)

(对照组)
表2 各组大鼠支气管壁及平滑肌的厚度

注:与对照组相比:aP<0.01;与哮喘组相比:bP<0.01;与BCG组比较:cP<0.01

(哮喘组)
表3 各组大鼠肺泡灌洗液、血清TGF-β含量

注:与对照组相比:aP<0.01;与哮喘组相比:bP<0.01;与BCG组相比:cP<0.01;与地米组相比:dP<0.01
讨 论
支气管哮喘是一种以嗜酸性粒细胞、肥大细胞、T淋巴细胞等多种炎性细胞参与的以气道变应性炎症、AHR及可逆性气道阻塞为特征的疾病。气道的慢性炎症被认为是哮喘的本质[4-5],从哮喘的主要诱发因素以及对哮喘患者病理研究发现,免疫反应是哮喘患者产生气道慢性炎症的主要原因[6]。嗜酸性粒细胞是支气管哮喘发病机制中的主要效应细胞[7],与哮喘气道炎症、气道重塑、肺中痰聚集及气道高反应性及哮喘病情的严重程度有关[8-11]。支气管哮喘早期病理改变主要是支气管黏膜的肿胀、充血、分泌物增多、气道内炎性细胞浸润、气道平滑肌痉挛等一些可逆性的病理改变。
哮喘的经典发病机制是辅助性T淋巴细胞Th1/Th2 亚群比例失衡和功能紊乱,正常情况下,两者处于相对平衡状态,维持机体正常的细胞和体液免疫功能[12-13]。调节性T细胞是维持人体外周免疫耐受的重要因子[14-15],调节性T细胞根据来源不同,主要分为天然型和诱导型Tr细胞。诱导性调节性T细胞(iTregs)是多种环境因素在幼稚T细胞中诱导产生的具有调节活性的T细胞,主要包括Trl 和Th3细胞两种类型[16]。Tr1主要通过分泌IL-10来抑制T细胞的增殖,具有旁观者抑制效应和免疫记忆力;Th3主要分泌TGF-β来实现对Th1和Th2的抑制作用[17]。
本研究中观察到哮喘大鼠BALF中细胞总数、EOS计数及BALF及血清中TGF-β1含量增加,气道壁及气道平滑肌明显增厚,气道变窄,气道上皮受损肿胀,部分可见脱落,间质细胞增多,基底膜增厚,支气管及肺泡内黏液分泌增多,大量炎性细胞浸润,多为淋巴细胞、嗜酸性粒细胞、单核细胞等。SABC法测得间质标志物Fibronectin、α-SMA表达增加,平滑肌细胞增生,上皮标志物E-cadherin表达降低,表明哮喘性慢性炎症致TGF-β1含量增加、上皮细胞损伤间质细胞增多是哮喘气道炎症形成的重要机制之一。

(BCG组) (地米组) (BCG接种组)
表4 各组大鼠肺组织中E-cadherin、α-SMA、Fibronectin平均光密度值

注:与对照组相比:aP<0.01,bP<0.05;与哮喘组相比:cP<0.05;与BCG组相比:dP<0.01;与地米组相比:eP<0.01
BCG是经热酚法提取的多糖酸类物质,并具有活化巨噬细胞、增强T细胞、B细胞介导的细胞免疫和体液免疫功能,目前已广泛应用于临床治疗哮喘等自身免疫性疾病[18]。研究证实BCG可以减少OVA激发的气道炎症及重塑,其中气道周围α-SMA水平、气道纤维化及气道上皮黏液堆积也减少,BCG还可减少TGF-β1的表达[19],这可能与其能诱导机体的Th1免疫功能有关。地塞米松是经典的抗炎、治疗哮喘的药物,众多实验结果表明,地塞米松能干预气道炎症中嗜酸性粒细胞及气道重塑中平滑肌的增殖过程,延缓气道炎症及重塑的进程。本研究显示地塞米松治疗组大鼠,气道炎症及气道阻塞不明显,BALF中细胞总数及EOS计数明显减少,BALF及血清TGF-β1含量较哮喘组明显下降,上皮细胞损伤间质转化显著减轻,SABC法测得E-cadherin表达明显升高,Fibronectin、α-SMA的表达明显下降,与哮喘组差异有统计学意义(P<0.01)。与地塞米松治疗哮喘相比,BCG具有调节免疫、副作用小、应用方便的优势,但其对支气管哮喘气道炎症及气道阻塞的预防及治疗作用的机制,目前研究及报道甚少。本研究中BCG接种组及BCG治疗组与哮喘组相比,大鼠BALF中细胞总数及EOS计数明显减少,气道炎症明显减轻,BALF及血清中的TGF-β1含量下降,气道壁及平滑肌无明显增厚,气道阻塞程度、上皮细胞损伤间质转化明显减轻,α-SMA、Fibronectin表达下降,E-cadherin表达增加,其差异具有统计学意义(P<0.01),表明接种BCG和BCG治疗对哮喘大鼠气道炎症及气道阻塞具有预防和治疗作用。其机制可能是通过免疫调节抑制TGF-β1表达,阻断了TGF-β1所致的上皮细胞损伤间质转化。提示预防接种BCG可以达到与地塞米松治疗相同的减轻气道炎症的作用。缓解期哮喘采用BCG及类似物进行免疫调节,有可能减少或控制哮喘发作。
综上所述,支气管哮喘发生时,TGF-β1含量增加介导的上皮细胞损伤间质转化是其重要机制之一。接种BCG及采用BCG治疗可减轻哮喘大鼠气道炎症及气道阻塞程度,这可能是通过BCG对Th1的免疫调节作用,使得TGF-β1含量下降,上皮细胞间质转化减少实现的。本研究结果为临床应用BCG治疗哮喘提供了实验依据。
参 考 文 献
1 王传夏, 李昌崇, 罗运春, 等. 支气管哮喘大鼠气道重塑中肺泡巨噬细胞的作用[J]. 中华结核和呼吸杂志, 2006, 29(11): 740-743.
2 Salmon M, Walsh DA, Koto H, et al. Repeated allergen exposure of sensitized Brown Norway rats induces airway cel DNA synthesis and remodeling[J]. Eur Respir J, 1999, 14(3): 633-641.
3 Palmans E, Kips JC, Pauwels RA, Prolonged Allergen Exposure Induces Structural Airway Changes in Sensitized rats[J]. Am J Respir Crit Care Med, 2000, 161(2):627-635.
4 沈晓明, 王卫平. 儿科学[M]. 北京: 人民卫生出版社, 2010: 266-267.
5 王长征. 改善支气管哮喘控制现状, 需要重视患者的长期管理[J/CD]. 中华肺部疾病杂志: 电子版, 2013, 6(4): 296-298.
6 刘 斐, 虞坚尔. 支气管哮喘发病机制的研究[J]. 河南中医, 2013, 33(3): 326-328.
7 Hemelaers L, Louis R. Eotax in: an important chemokinein sthma[J]. Rev Med Liege, 2006, 61 ( 4): 223- 226.
8 Humbles AA, Lloyd CM, McM illan SJ, et al. A critical role for eosinophils in llergic irways remodeling[J]. Science, 2004, 305(5691): 1776- 1779.
9 Lee JJ, Dimin D, Mcias MP, et al. Defining alink with sthma in mice congenitally deficient in eosinophils[J]. Science, 2004, 305(5691): 1773-1776.
10 Sexton DW, Walsh GM. Eosinophil- epithelical cell interactions:an importnt facet of asthmatic inflammation[J]. Clinical Experimental Allergy, 2002, 32(6): 811- 813.
11 Duncan CJ, Lawrie A, Blaylock HG, et al. Reduced eo-sinophil apoptosis in induced sputum correlates with sthmas everity[J]. Eur Respir J, 2003, 22(3): 484-490.
12 Liu LY, Mathur SK, Sedgwick JB, et al. Human airway and pe-ripheral blood eosinophils enhance Th1 and Th2 cytokine secretion[J]. Allergy, 2006, 61(5): 589-597.
13 Tanja Aarvak, Martine Chabaud, Pierre Miossec. Th1/Th0 Cells but not by Th2 cells IL-17 is produced by some pro-inflammatory[J]. The Journal of Immunology, 1999, 162(3): 1246-1251.
14 Xystrakis E, Urry Z, Hawrylowicz CM. Regulatory T cell therapyas individualized medicine for asthma and allergy[J]. Immuno-therapy, 2007, 7(6): 535-541.
15 黄 可, 沈 瑛, 刘 翱. 调节性T细胞在慢性阻塞性肺疾病与支气管哮喘中的作用机制研究[J/CD]. 中华肺部疾病杂志: 电子版, 2013, 6(4): 368-371.
16 胡斯明. 调节性T细胞与Th17细胞在支气管哮喘中失衡表达的实验研究[D]. 广州:南方医科大学, 2009.
17 何 维. 医学免疫学[M]. 北京: 人民卫生出版社, 2011: 246.
18 石 涛, 冯学斌, 赵志旭, 等. 卡介苗多糖核酸对哮喘大鼠淋巴液和血液CD4+CD25+Foxp3+调节性T细胞的影响[J]. 中国免疫学杂志, 2010, 26: 932-936.
19 Wang PL, Zhang GSH, Qin XJ, et al. Inhibition of allergen-induced airway remodeling by neonatal bacillus Calmette-Guerin vaccination is associated with interferon-gamma-producing T cells but not regulatory T cells in mice[J]. Annals of Allergy, Asthma & Immunology, 2011, 107(2): 163-170.

