复方姜黄素脂质立方液晶制备工艺研究*
★ 黄丹娥 崔景朝 付建武 张建军 曾晓会 黄雪君 姚楠
(广东省中医研究所 广东 广州 510095)
姜黄素具有广泛的药理作用,如抗肿瘤、改善心血管功能、抗炎、抗病毒、保肝、增强免疫力等,具有良好的药理活性和应用前景[1],但是姜黄素存在疏水性强、口服吸收少、稳定性差以及体内生物利用度低等缺陷,很大程度上影响了其在临床上的使用[2]。
研究表明胡椒碱可提高动物和人血清姜黄素含量和生物利用度,主要是因为胡椒碱为体内葡萄糖醛酸酶抑制剂,可降低姜黄素的代谢[3]。
脂质立方液晶的处方比例不仅能够影响立方液晶本身的物理化学性质,而且对自身的结构、晶型以及药物的包封率和载药量也具有重要的意义。针对姜黄素在水中溶解度低、稳定性较差、生物利用度低等问题,将姜黄素与胡椒碱进行配伍,制备姜黄素脂质体立方液晶制剂。为了保证脂质立方相晶体结构以及提高药物的包封率和载药量,本论文对复方姜黄素脂质立方液晶处方工艺进行了摸索。
1 仪器与试药
1.1 实验仪器 Agilent1200高效液相色谱仪(G1312A型二元泵,G1329A型自动进样器,G1316A型柱温箱,G1314B型VWD检测器,美国);Kromasil-C18柱(4.6mm×250 mm,5μm,瑞典EKA Chemicals公司);XS205DU型1/10万电子分析天平(METTLER TOLEDO);5424型小型高速离心机(德国 Eppendorf公司);恒温数控超声波清洗器(昆山市超声仪器有限公司);20~200μL移液枪(BIOHIT);36MM透析袋(BIOSHARP,USA);milli-Q advantage超纯水器(密理博中国有限公司);kel-2000b实验室高精度显微加热台(南京凯尔仪器有限公司);BX41-P偏光显微镜(奥林巴斯有限公司);Q500超声波破碎仪(美国Misonix公司);LXJ-ⅡB低速大容量多管离心机(上海安亭科学仪器厂);HJ-4A型数显恒温多头强力磁力搅拌器(金坛市顺华仪器有限公司)。
1.2 试药与试剂 姜黄素(四川金郁金科技开发有限公司,纯度98%);胡椒碱(海南尊鳌科技开发有限公司,纯度95%);姜黄素标准品(中国药品生物制品检定所,批号:110823-201004,纯度98.8%);胡椒碱标准品(中国药品生物制品检定所,批号:110775-201104,纯度99.2%);植烷三醇(东京化成工业株式会社,纯度>98%);甘油单油酸酯(美国Amresco有限公司,纯度99%);维他命E乙酸酯(购自于美国sigma公司,纯度99%);Lutrol F127(巴斯夫中国有限公司);葡聚糖凝胶G-50(AR,上海雅吉生物科技有限公司);36 mm透析袋(美国Biosharp公司);乙腈为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 单因素考察
2.1.1 植烷三醇用量考察 准确称取0.1g,0.2g和0.3g Phytantriol脂质材料于西林瓶中,加入一定量的姜黄素和胡椒碱无水乙醇溶液超声30min,使其充分溶解,作为A相;称取0.04g F127于100mL烧杯中,加入20mL的蒸馏水,于水浴60℃上加热使溶解,混合均匀,作为B相。将A相缓慢滴加至B相中,搅拌3h,再于细胞超声仪上超声5min(超声功率为300W,5s/次,间隔5s),即得大小均一的复方姜黄素立方液晶混悬液。将上述混悬液分别定容至25mL,精密吸取0.1mL至5mL的量瓶中,加入甲醇适量,超声15min,冷却至室温,加入甲醇稀释并定容至刻度;精密量取上述溶液100μL,加入微型凝胶柱(径高比1∶6)上表面,离心。采用相同体积的蒸馏水重复洗脱6次,收集合并洗脱液,加入甲醇适量超声15min,冷却至室温,加入甲醇稀释并定容至5mL,0.45μm微孔滤膜滤过,测定液晶样品中姜黄素和胡椒碱的包封率。同时精密量取复方姜黄素脂质立方液晶混悬液10mL于已恒重的蒸发皿中,减压冷冻干燥至恒重,称定重量,计算姜黄素和胡椒碱的载药量,结果见下表1。
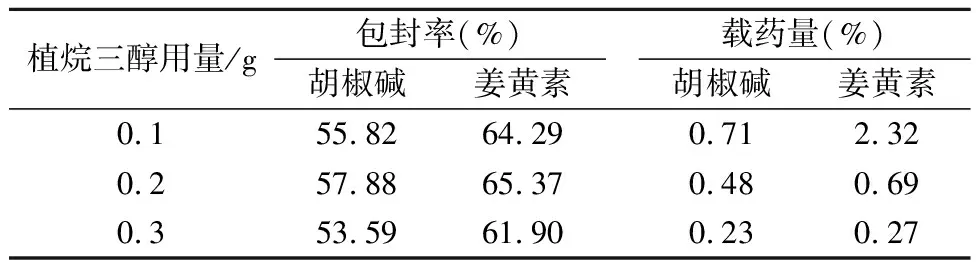
表1 植烷三醇不同用量考察
由上表结果可知,不同的植烷三醇用量对姜黄素和胡椒碱的包封率无明显影响,同时载药量随着植烷三醇用量的增加而逐渐减小,说明植烷三醇已充分参与了脂质立方液晶结构的组装。随着植烷三醇用量的增加,并没有显著提高药物的包封率,相反降低了立方液晶载药量,故确定植烷三醇用量为0.1g。
2.1.2 稳定剂种类考察 依据文献,选择F127[4]和Vitamin E Acetate[5]作为植烷三醇/水体系脂质立方液晶稳定剂。通过对比F127和Vitamin E Acetate两种稳定剂,考察其对姜黄素和胡椒碱包封率和载药量的影响。
Phytantriol/F127/water体系的制备:称取0.1g Phytantriol脂质材料于西林瓶中,加入一定量的姜黄素和胡椒碱无水乙醇溶液超声30min,使其充分溶解,作为A相;称取0.02g F127于100mL烧杯中,加入20mL的蒸馏水,于水浴60℃上加热使溶解,混合均匀,作为B相。将A相缓慢滴加至B相中,搅拌3h,再于细胞超声仪上超声5min(超声功率为300W,5s/次,间隔5s),即得大小均一的复方姜黄素立方液晶混悬液,按照上述测定方法计算姜黄素和胡椒碱的包封率和载药量。
Phytantriol/Vitamin E Acetate/water体系的制备:称取0.1g Phytantriol脂质材料于西林瓶中,加入一定量的姜黄素和胡椒碱无水乙醇溶液超声30min,使其充分溶解,作为A相;称取0.02g Vitamin E Acetate于100mL烧杯中,加入20mL的蒸馏水,于水浴60℃上加热使溶解,混合均匀,作为B相。将A相缓慢滴加至B相中,搅拌3h,再于细胞超声仪上超声5min(超声功率为300W,5s/次,间隔5s),即得大小均一的复方姜黄素立方液晶混悬液,按照上述测定方法计算姜黄素和胡椒碱的包封率和载药量,结果见表2。

表2 不同稳定剂种类的考察
由结果可知,不同的稳定剂种类对胡椒碱包封率无显著性差异,对姜黄素具有较强的选择性,这可能与药物和稳定剂之间的相互作用有关,本试验选择F127作为复方姜黄素脂质立方液晶稳定剂。
2.1.3 F127用量考察 称取0.1g Phytantriol脂质材料于西林瓶中,加入一定量的姜黄素和胡椒碱无水乙醇溶液超声30min,使其充分溶解,作为A相;分别称取相当于植烷三醇质量5%、10%、20%、30%和40%的F127于100mL的烧杯中,加入20mL的蒸馏水,于水浴60℃上加热使溶解,混合均匀,作为B相。将A相缓慢滴加至B相中,搅拌3h,再于细胞超声仪上超声5min(超声功率为300W,5s/次,间隔5s),即得大小均一的复方姜黄素立方液晶混悬液。按照上述测定方法计算姜黄素和胡椒碱的包封率和载药量。结果见表3。

表3 F127不同用量的考察
由上表结果可以看出,随着F127用量的增加,姜黄素和胡椒碱包封率和载药量呈现先增加后下降趋势。说明F127在一定范围内可以参与脂质立方液晶结构的组装并能支撑整个骨架,但是当用量超过30%,其又可能会导致结构的破坏或者晶型结构的转变,导致包封率和载药量的下降。
2.1.4 分散相用量考察 称取0.1g Phytantriol脂质材料于西林瓶中,加入一定量的姜黄素和胡椒碱无水乙醇溶液超声30min,使其充分溶解,作为A相;称取0.02g F127于100mL烧杯中,分别加入5mL,10mL,20mL和30mL的蒸馏水,于水浴60℃上加热使溶解,混合均匀,作为B相。将A相缓慢滴加至B相中,搅拌3h,再于细胞超声仪上超声5 min(超声功率为300W,5s/次,间隔5 s),即得大小均一的复方姜黄素立方液晶混悬液。按照上述测定方法计算姜黄素和胡椒碱的包封率和载药量,结果见下表4。
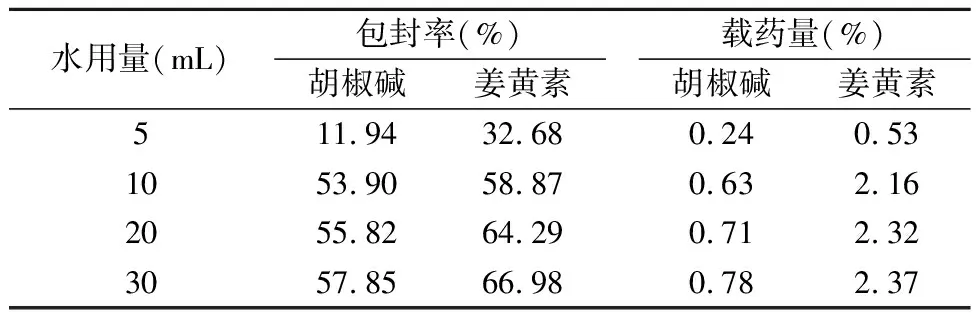
表4 不同分散相量的考察
由结果可知,分散相用量在一定范围内对复方姜黄素脂质立方液晶具有显著性影响。分散相用量较少,脂质立方液晶纳米粒浓度较高,样品易于聚集,稳定性下降。当分散相用量超过10mL,胡椒碱和姜黄素包封率和载药量均趋于稳定。
2.1.5 药物用量 称取0.1g Phytantriol脂质材料于西林瓶中,加入相当于植烷三醇质量的3%,5%,7%和10%的姜黄素和胡椒碱(质量比为3∶1)无水乙醇溶液,超声30min,使其充分溶解,作为A相;称取0.02g F127于100mL烧杯中,分别加入20mL的蒸馏水,于水浴60℃上加热使溶解,混合均匀,作为B相。将A相缓慢滴加至B相中,搅拌3h,再于细胞超声仪上超
声5min(超声功率:300W,5s/次,间隔5s),即得大小均一的复方姜黄素立方液晶混悬液。按照上述测定方法计算姜黄素和胡椒碱的包封率和载药量。结果见表5。
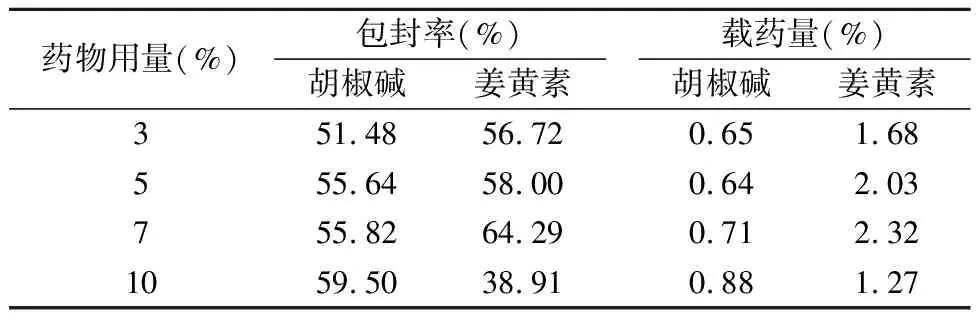
表5 不同药物用量的考察
随着药物用量的增加,胡椒碱和姜黄素包封率、载药量均有一定的提高,但当投药量达到10%,姜黄素包封率和载药量显著下降,说明药物用量过高会对脂质立方液晶的脂质双分子层造成影响,同时过高的药物浓度也可能使得纳米粒的晶型结构发生改变。
2.2 均匀设计优化处方工艺
根据单因素实验结果,选择影响姜黄素和胡椒碱包封率较大的三个因素:药量、F127用量以及分散相用量。固定植烷三醇用量为0.1g,选取药量、F127用量以及分散相用量三个因素三个水平,采用U8(83)均匀设计表,以复方姜黄素的包封率和载药量为评价指标进行综合加权评分,优化复方姜黄素脂质立方液晶最佳处方工艺。因素水平表见表6。

表6 因素水平表
根据U8(83)均匀设计表,将前面各因素的水平数进行合并{1,2}=1,{3,4}=2,{5,6}=3,{7,8}=4;将第4列的水平合并为四水平,试验安排与结果见表7。
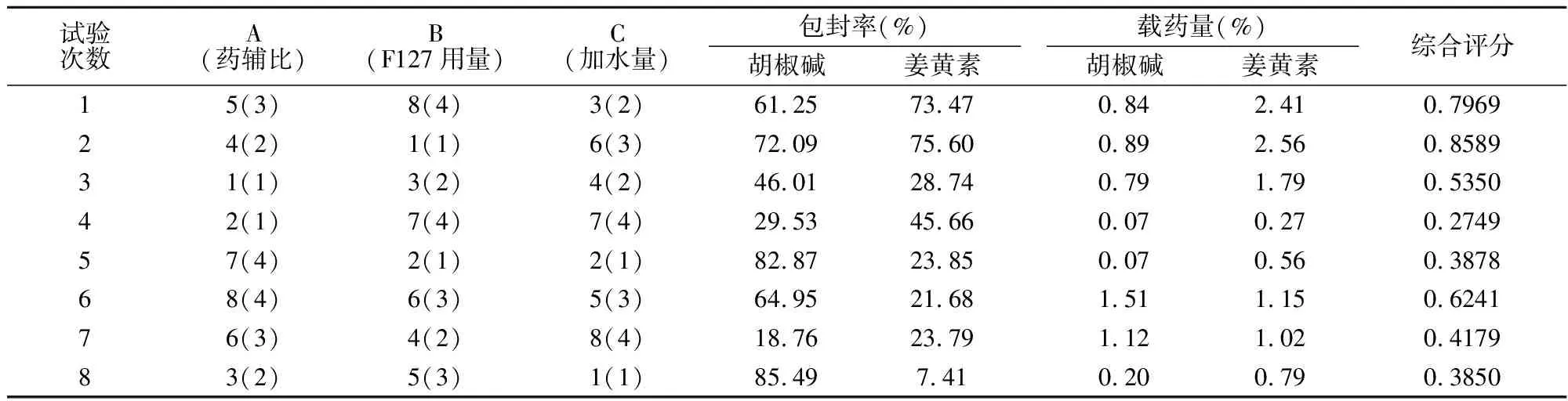
表7 均匀设计实验安排表
综合评分=胡椒碱包封率/胡椒碱包封率max×0.25+姜黄素包封率/姜黄素包封率max×0.25+胡椒碱载药量/胡椒碱载药量max×0.25+姜黄素载药量/姜黄素载药量max×0.25。
2.2.1 回归模型及检验 应用DPS 6.55软件对实验数据进行二次多项式逐步回归分析,剔除影响较小的因素,结果显示,二次项模型所拟合方程意义显著(结果见表8),所得回归方程分别为:
Y=3.4452-27.9301X1-26.6210X2+166.785 9X1X2+51.182 0X22
其中X1为药量(%),X2为F127用量(%),X3为分散相用量(g),Y为复方姜黄素包封率和载药量的综合评分。

表8 回归模型方差分析表
通过分析各自变量与因变量之间的关系(如图1),可以看出X1(药量)与综合评分呈现正相关,X2(F127用量)与综合评分呈现曲线相关,X3(加水量)与综合评分无相关关系。说明F127和药物用量(药辅比)是影响复方姜黄素包封率和载药量的主要因素;分散相用量对复方姜黄素包封率和载药量影响不显著,只改变药物的分散浓度。
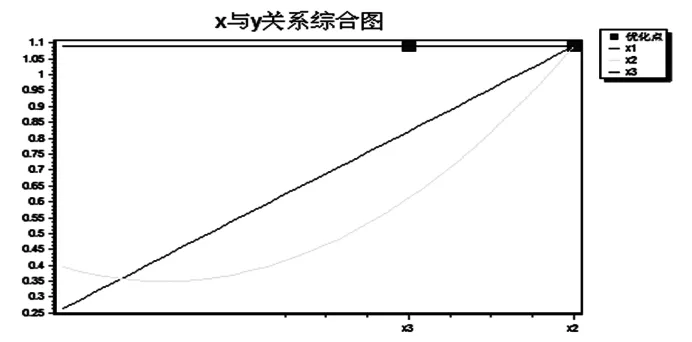
X1:药量;X2:F127用量;X3:分散相用量
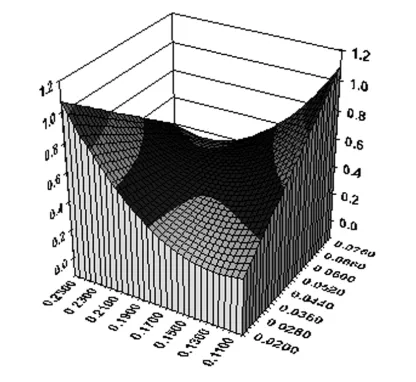
图2 药量与F127用量与综合评分的三维效应面图

图3 药量与分散相用量对综合评分的三维效应面图
2.2.2 效应面分析 根据回归方程,选择两个不同的自变量和因变量做三维效应面图(如图2~4),由图可知,随着药量的增加,复方姜黄素包封率和载药量呈现明显增加趋势,说明在一定的范围内,随着药量的增加,脂质立方液晶的包封率和载药量随之增加;而分散相用量对综合评分影响不显著,说明分散相用量只是影响药物的浓度,不影响药物的包封率和载药量;F127用量对复方姜黄素包封率和载药量影响较为显著,呈现二次项关系,这主要是因为F127参与脂质立方液晶结构的组装和支撑,在一定的范围内增加F127用量,有利于脂质立方液晶结构的形成和骨架的支撑,但当用量过高,反而不利于纳米结构的形成和药物的包封。

图4 分散相用量与F127对综合评分的三维效应面图
2.2.3 效应值优化及验证 结合二次回归模型的数学分析结果,软件系统给出最高评分时各个因素组合:植烷三醇0.1g,药量为8mg,F127用量为25mg,分散相用量20g。按优选的最佳处方工艺,进行3批验证试验,计算综合评分。结果见表9。由表结果可知,验证三批试验结果相差较小,胡椒碱和姜黄素的包封率均在70%以上,胡椒碱和姜黄素载药量分别在0.5%和2%以上。
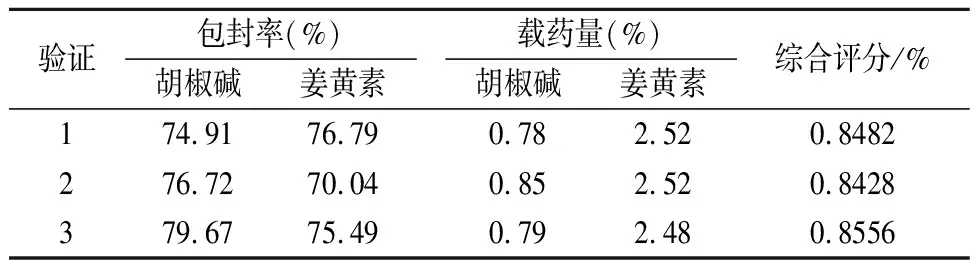
表9 处方工艺验证试验
3 讨论
筛选了辅料的用量、稳定剂的种类和用量、分散体系用量以及药物用量对姜黄素和胡椒碱包封率和载药量的影响,并采用均匀设计优化处方工艺,得到复方姜黄素脂质立方液晶最佳制备处方,即:植烷三醇0.1g,药量为8mg,F127用量为25mg,加水量20g。制得的复方姜黄素脂质立方液晶纳米粒姜黄素包封率达到了70%以上,载药量达到了2.5%;胡椒碱包封率达到了75%以上,载药量达到了0.8%以上,满足了实验要求。
[1]崔晶,翟光喜,娄红祥.姜黄素的研究进展[J].中南药学,2005,3(2):108-111.
[2]Ireson CR, Jones DJ, Orr S, et al. Metabolism of the cancer chemopreventive agent curcumin in human and rat intestine[J]. Cancer epidemiology, biomarkers & prevention 2002,11(1):105-111.
[3]Shoba G, Joy D, Joseph T, et al. Influence of piperine on the pharmacokinetics of curcumin in animals and human volunteers[J].Planta medica, 1998, 64(4):353-356.
[4]Dong YD, Larson I, Hanley T, et al. Bulk and dispersed aqueous phase behavior of phytantriol: effect of vitamin E acetate and F127 polymer on liquid crystal nanostructure[J]. Langmuir : the ACS journal of surfaces and colloids ,2006,22(23):9 512-9 518.
[5]Fong WK, Hanley T, Boyd BJ. Stimuli responsive liquid crystals provide 'on-demand' drug delivery in vitro and in vivo[J]. Journal of controlled release: official journal of the Controlled Release Society,2009,135(3):218-226.

