芝麻酚与3-羟基氧化吲哚拼接衍生物的合成及其抗肿瘤活性*
朱 铭,杨 超,余章彪,郭丰敏,林 冰,周 英,刘雄利
(贵州大学 药学院 贵州省中药民族药创制工程中心,贵州 贵阳 550025)
·研究论文·
芝麻酚与3-羟基氧化吲哚拼接衍生物的合成及其抗肿瘤活性*
朱 铭,杨 超,余章彪,郭丰敏,林 冰,周 英,刘雄利
(贵州大学 药学院 贵州省中药民族药创制工程中心,贵州 贵阳 550025)
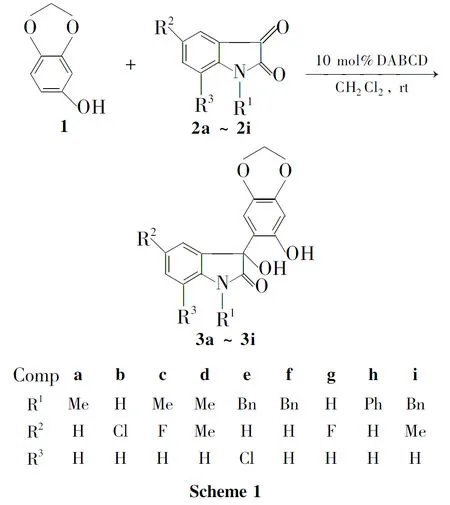
以芝麻酚和取代吲哚醌(2a~2i)为原料,二氯甲烷为溶剂,在1,4-二氮杂二环[2,2,2]辛烷催化下经缩合反应合成了9个新型的芝麻酚与3-羟基氧化吲哚的拼接衍生物(3a~3i),其结构经1H NMR,13C NMR和HR-ESI-MS表征。采用MTT法和SRB法研究了3a~3i体外对人白血病细胞(K562)和人肺癌细胞(K549)的抑制活性。结果表明:5-氟-3-羟基-3-{6-羟基苯并[1,3]二氧亚甲基-5-基}-1-甲基氧化吲哚(3c)和5-氟-3-羟基-3-{6-羟基苯并[1,3]二氧亚甲基-5-基}-氧化吲哚(3g)具有较好的抗K562和K549活性。
芝麻酚;吲哚醌;拼接衍生物;合成;抗肿瘤活性
芝麻酚(1)[1-4]是一种用途广泛的医药中间体,可用于合成抗忧郁症药物帕罗西汀,抗肿瘤药物VP-16和VM-26以及抗心血管病药物ACEI等。3-羟基季碳氧化吲哚广泛存在于复杂的生物活性分子中。例如,Convolutamydines A-E[5-8]是一类从海洋生物中提取出来的生物碱,其主体结构是含有一个季碳的3-羟基氧化吲哚,个体不同体现在C3-位上的不同取代。研究表明,3-羟基氧化吲哚衍生物对不同的细胞具有很好的响应性。鉴于1和3-羟基氧化吲哚骨架具有潜在的生物活性,将两者适当拼接得到的杂合衍生物可能会产生一系列结构和活性上有意义的新化合物,从而为生物活性筛选提供化合物源。
本文根据药物设计药效团的拼接原理,以1和取代吲哚醌(2a~2i)为原料,二氯甲烷为溶剂,在1,4-二氮杂二环[2.2.2]辛烷(DABCO)催化下经缩合反应合成了9个新型的1与3-羟基氧化吲哚拼接衍生物(3a~3i,Scheme 1),其结构经1H NMR,13C NMR和HR-ESI-MS表征。采用MTT法和SRB法研究了3a~3i体外对人白血病细胞(K562)和人肺癌细胞(K549)的抑制活性。
1 实验部分
1.1 仪器与试剂
Bruker-400MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Bruker BIO TOF III Q型质谱仪。
所用试剂均为分析纯;无水溶剂均按标准方法纯化。
1.2 合成
(1)3a~3i的合成(以3a为例)
在反应瓶中依次加入1152mg(1.0mmol),N-甲基靛红(2a)161mg(1.0mmol),DABCO 11.2mg(0.1mmol,10mmol%)和二氯甲烷10mL,搅拌下于室温反应24h(TLC检测)。反应液直接经硅胶柱层析[洗脱剂:V(乙酸乙酯)∶V(石油醚)=1∶3]纯化得3a。
分别用2b~2i替代2a,用类似的方法合成3b~3i。
3-羟基-3-{6-羟基苯并[d][1,3]二氧亚甲基-5-基}-1-甲基氧化吲哚(3a):白色固体,收率84%,m.p.159.3℃~162.5℃;1H NMRδ:3.12(s,3H),5.91(d,J=0.8Hz,1H),5.93(d,J=0.8Hz,1H),6.21(s,1H),6.89~6.91(m,2H),6.95(d,J=6.3Hz,1H),7.07~7.10(m,1H),7.22(s,1H),7.23~7.25(m,1H),9.23(s,1H);13C NMR(100MHz,下同)δ:26.0,50.7,74.7,97.4,100.7,106.7,120.1,121.8,123.3,128.7,132.4,139.4,144.4,146.6,148.2,176.8;HR-ESI-MSm/z:Calcd for C16H13NO5Na{[M+Na]+}322.0691,found 322.0692。
5-氯-3-羟基-3-{6-羟基苯并[d][1,3]二氧亚甲基-5-基}氧化吲哚(3b):灰白色固体,收率72%,m.p.167.0℃~170.2℃;1H NMRδ:3.41(s,3H),5.93(d,J=6.0Hz,2H),6.25(s,1H),6.79~6.82(m,2H),7.18~7.22(m,2H);13C NMRδ:74.9,97.4,100.8,106.8,110.5,119.5,123.6,125.0,128.3,135.4,139.5,142.0,146.8,148.3,178.1;HR-ESI-MSm/z:Calcd for C15H10NO5ClNa{[M+Na]+}342.0145,found 342.0146。
5-氟-3-羟基-3-(6-羟基苯并[d][1,3]二氧亚甲基-5-基)-1-甲基氧化吲哚(3c):淡粉红色固体,收率93%,m.p.151.0℃~153.5℃;1H NMRδ:3.13(s,3H),5.93(d,J=6.2Hz,2H),6.24(s,1H),6.61(s,1H),6.74~6.76(m,1H),6.95~6.98(m,1H),7.07~7.10(m,1H),7.23(m,1H),9.16(m,1H);13C NMRδ:26.2,74.7,97.4,100.8,106.8,108.6,111.1,114.6,119.5,134.2,140.1,146.8,148.2,157.4,159.3,176.6;HR-ESI-MSm/z:Calcd for C16H12NO5FNa{[M+Na]+}340.0597,found 340.0599。
3-羟基-3-{6-羟基苯并[d][1,3]二氧亚甲基-5-基}-1,5-二甲基氧化吲哚(3d):白色固体,收率75%,m.p.101.5℃~103.8℃;1H NMRδ:3.40(s,5H),5.93(d,J=9.6Hz,2H),6.21(s,1H),6.68(s,1H),6.74~6.76(m,1H),6.85~6.92(m,2H),7.23(m,1H),7.25(s,1H),9.23(s,1H);13C NMRδ:29.3,50.7,74.0,97.4,100.8,106.6,113.7,119.7,122.5,123.3,130.6,135.7,139.5,140.0,146.9,148.0,177.3;HR-ESI-MSm/z:Calcd for C17H15NO5Na{[M+Na]+}336.0848,found 336.0849。
1-苄基-7-氯-3-羟基-3-{6-羟基苯并[d][1,3]二氧亚甲基-5-基}氧化吲哚(3e):灰白色固体,收率86%,m.p.106.0℃~109.5℃;1H NMRδ:5.94(d,J=7.3Hz,2H),6.27(s,1H),6.70(m,2H),6.94~6.97(m,1H),7.16~7.19(m,1H),7.32(s,1H),7.43~7.47(m,3H),7.58~7.61(m,2H),9.36(s,1H);13C NMRδ:20.5,50.7,74.7,97.5,100.8,106.6,108.3,119.1,120.5,122,5124.0,126.5,127.7,128.7,129.5,132.2,135.1,139.6,144.1,146.8,148.1,176.4;HR-ESI-MSm/z:Calcd for C22H16NO5Cl Na{[M+Na]+}432.0615,found 432.0615。
1-苄基-3-羟基-3-{6-羟基苯并[d][1,3]二氧亚甲基-5-基}氧化吲哚(3f):黄棕色固体,收率76%,m.p.70.1℃~73.5℃;1H NMRδ:3.37(s,4H),5.94(d,J=7.0Hz,2H),6.27(s,1H),6.71(d,J=6.2Hz,1H),6.86~6.88(m,1H),6.91~6.93(m,1H),7.11~7.14(m,1H),7.26~7.29(m,1H),7.32~7.35(m,2H),9.20(s,1H);13C NMRδ:20.8,59.8,74.7,97.4,100.7,106.9,108.5,119.8,121.9,123.4,124.1,127.2,127.3,128.5,128.6,132.5,136.6,139.5,143.5,146.7,148.2,176.9;HR-ESI-MSm/z:Calcd for C22H17NO5Na{[M+Na]+}398.1004,found 398.1007。
5-氟-3-羟基-3-{6-羟基苯并[d][1,3]二氧亚甲基-5-基}氧化吲哚(3g):白色固体,收率84%,m.p.188.0℃~191.1℃;1H NMRδ:3.39(s,2H),5.93(d,J=5.1Hz,2H),6.24(s,1H),6.66~6.68(m,1H),6.75~6.77(m,1H),6.95~6.99(m,1H),7.20(s,1H),9.12(s,1H);13C NMRδ:75.2,97.4,100.7,106.9,109.6,111.2,114.6,119.6,135.0,139.3,146.8,148.4,156.9,158.8,178.3;HR-ESI-MSm/z:Calcd for C15H10NO5FNa{[M+Na]+}326.0441,found 326.0440。
3-羟基-3-{6-羟基苯并[d][1,3]二氧亚甲基-5-基}-1-苯基氧化吲哚(3h):白色固体,收率83%,m.p.164.5℃~167.2℃;1H NMRδ:3.38(s,2H),5.95(d,J=6.6Hz,2H),6.29(s,1H),6.77(s,1H),6.91~6.92(m,2H),7.16~7.18(m,1H),7.25~7.27(m,1H),7.31~7.31(m,2H),9.38(s,1H);13C NMRδ:25.8,58.3,74.0,97.3,100.8,106.9,113.5,119.3,122.7,123.5,126.1,126.7,128.4,130.8,135.9,138.4,139.4,139.6,147.0,148.1,177.6;HR-ESI-MSm/z:Calcd for C21H15NO5Na{[M+Na]+}384.0848,found 384.0848。
1-苄基-3-羟基-3-{6-羟基苯并[d][1,3]二氧亚甲基-5-基}-5-甲基氧化吲哚(3i):白色固体,收率80%,m.p.98.0℃~101.5℃;1H NMRδ:3.37(s,4H),5.94(d,J=6.2Hz,2H),6.27(s,1H),6.53(s,1H),6.59(d,J=6.3Hz,1H),6.74(s,1H),6.91~6.93(m,1H),7.28(s,1H),7.31~7.34(m,2H),7.42~7.43(m,2H),9.18(s,1H);13C NMRδ:20.5,42.8,74.8,97.4,100.7,106.9,108.4,119.9,122.7,124.1,127.1,127.3,128.3,128.7,130.8,132.6,135.3,136.7,139.5,141.2,146.7,148.2,176.8;HR-ESI-MSm/z:Calcd for C23H19NO5Na{[M+Na]+}412.1161,found 412.1165。
1.3 抗肿瘤活性测定
以阿霉素为阳性对照药,采用SRB法测试3a~3i对人肺癌细胞株(A549)的体外抗肿瘤活性,采用MTT法测试3a~3i对人白血病细胞株(K562)的体外抑制活性[9]。
2 结果与讨论
2.1 抗肿瘤活性
3a~3i的抗肿瘤活性见表1。由表1可见,3a~3i均有一定的抑制活性,其中3c和3g对K562和A549的抑制活性均较好,说明吲哚环上带氟原子取代基有利于提高抗肿瘤活性,可以作为先导化合物进一步研究,其它相关药理活性的研究正在进行中。
2.2 合成
2苯环上的取代基对反应速度和收率有一定影响,2的苯环上带吸电子取代基反应速率和收率均高于带供电子取代基。例如,2c反应24h收率达93%,而2d反应30h收率也仅为75%,这可能是5-位的氟使2苯环电子云密度降低,亲电性增强,从而提高了反应速率。此外,氮原子上的取代基为苄基、苯基或甲基的2比不取代的2反应速度要快,收率也高。其可能原因是氮原子取代后,在二氯甲烷中溶解性更好。
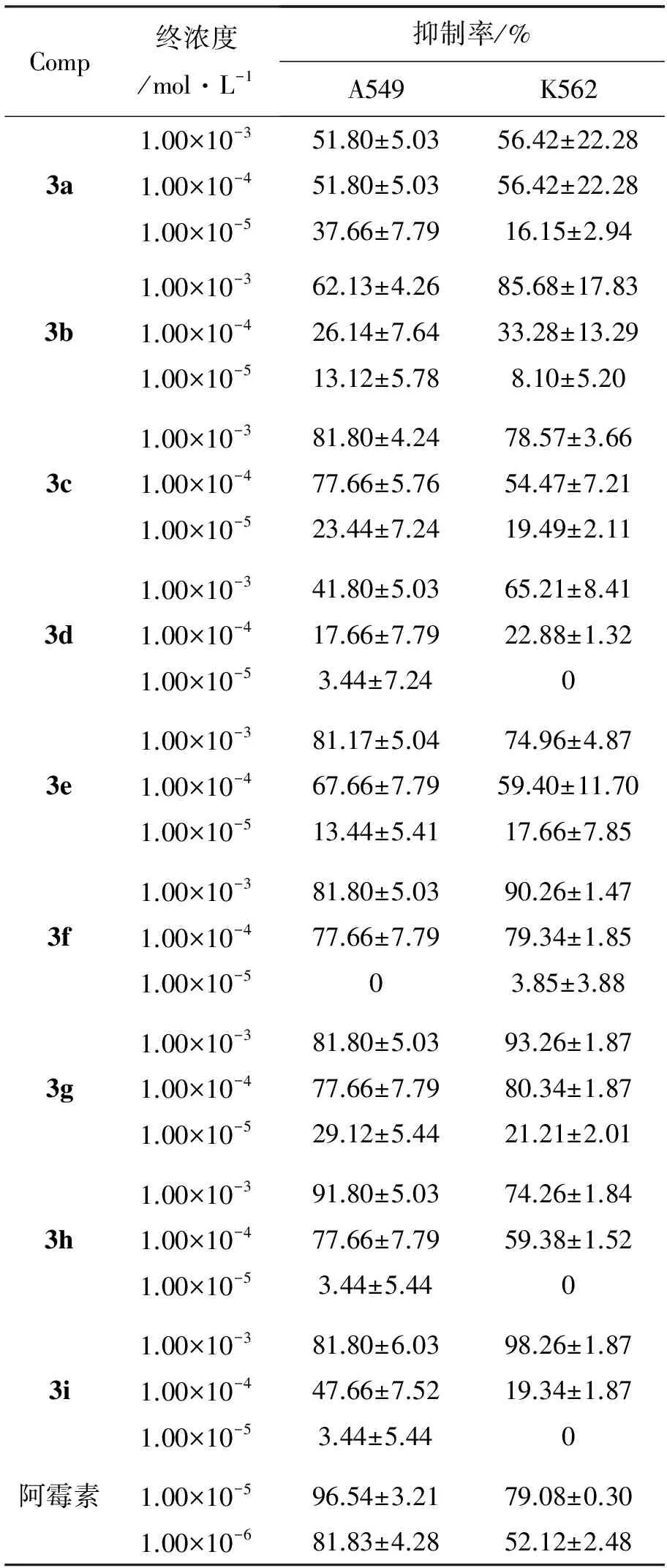
表1 体外抗肿瘤活性*Table1 In vito antitumor activities
*A549:人肺癌细胞株;K562:人白血病细胞株
3 结论
合成了9个新型的芝麻酚与3-羟基氧化吲哚的拼接衍生物(3a~3i)。讨论了2上的取代基对反应速度和产率的影响。初步的体外抗肿瘤活性测试结果表明:5-氟-3-羟基-3-{6-羟基苯并[1,3]二氧亚甲基-5-基}-1-甲基氧化吲哚(3c)和5-氟-3-羟基-3-{6-羟基苯并[1,3]二氧亚甲基-5-基}-氧化吲哚(3g)对K562和A549具有较好的抑制活性。
[1] Zheng S,Chan C,Furuuchi T,etal.Stereospecific formal total synthesis of ecteinascidin 743[J].Angew Chem Int Ed,2006,45:1754-1759.
[2] Chen J,Chen X,Willot M,etal.Asymmetric total syntheses of ecteinascidin 597and ecteinascidin 583[J].Angew Chem Int Ed,2006,45:8028-8037.
[3] Paolis M D,Chiaroni A,Zhu J.Synthetic studies on ecteinascidin 743:Rapid access to the fully functionalized tetrahydroisoquinoline with a bridged 10-membered sulfur containing macrocycle[J].Chem Commun,2003,23:2896-2897.
[4] Hitotsuyanagi Y,Ichihara Y,Takeya K,etal.Synthesis of 4-oxa-2-azapodophyllotoxin,a novel analog of the antitumor lignan podophyllotoxin[J].Tetrahedron Lett,1994,35:9401-9403.
[5] Zhang H P,Shigemori H,Ishibashi M,etal.Convolutamides A~F,novelγ-lactam alkaloids from the marine bryozoan amathia convolute[J].Tetrahedron Lett,1994,50:10201-10210.
[6] Kamano Y,Zhang H P,Ichihara Y,etal.Convolutamydine A,a novel bioactive hydroxyoxindole alkaloid from marine bryozoan Amathia convolute[J].Tetrahedron Lett,1995,36:2783-2784.
[7] Zhang H P,Kamano Y,Ichihara Y,etal.Isolation and structure of convolutamydines B~D from marine bryozoan amathia convolute[J].Tetrahedron Lett,1995,51:5523-5526.
[8] Kamano Y,Kotake A,Hashima H,etal.Three new alkaloids,convolutamines F and G,and convolutamydine E,from the floridian marine bryozoan amathia convolute[J].Collect Czech Chem Commun,1999,64:1147-1153.
[9] 陈斌,刘雄伟,陈诗尧,等.新型苯并吡喃黄酮的合成及其抗肿瘤活性[J].合成化学,2014,22(1):30-33.
SynthesisandAntitumorActivitiesofSesamolRing-fused3-Hydroxyoxindoles
ZHU Ming, YANG Chao, YU Zhang-biao,GUO Feng-min, LIN Bin, ZHOU Ying, LIU Xiong-li
(Guizhou Province Chinese Medicine and Ethnic Medicine Creation Engineering Center,College of Pharmacy,Guizhou University,Guiyang 550025,China)
Nine novel sesamol ring-fused 3-hydroxyoxindoles(3a~3i)were synthesized by condensation reaction of sesamol with substituted isatins(2a~2i)using DABCO as the catalyst and CH2Cl2as the solvent.The structures were characterized by1H NMR,13C NMR and HR-ESI-MS.Theinvitroanti-tumor activites of3a~3iagainst K562and K549were investigated by MTT method and SRB method.The results showed that 5-fluoro-3-hydroxy-3-{6-hydroxybenzo[d][1,3]dioxol-5-yl}-1-methylindolin-2-one(3c)and 5-fluoro-3-hydroxy-3-{6-hydroxybenzo[d][1,3]dioxol-5-yl}indolin-2-one(3g)exhibited better antitumor activities.
sesamol;isatin;fusing derivatives;synthesis;antitumor activity
2014-01-13;
2014-02-20
国家自然科学基金青年基金资助项目(21302024);教育部“新世纪人才支持计划”[教技函(2011)95号];贵州省优秀青年科技人才培养对象专项[黔科合人字2011(34)号];贵州省中药现代化科技产业研究开发专项[黔科合ZY字2013(3010)号]
朱铭(1989-),男,汉族,湖北武汉人,硕士研究生,主要从事天然活性物质的全合成及结构修饰的研究。E-mail:253259908@qq.com
刘雄利,副教授,E-mail:liuxiongli8302@163.com
O626;O625.31
A
1005-1511(2014)04-0444-04

