非小细胞肺癌组织中P-ACC与COX-2的表达及相关性研究
钱 洪, 沈双双, 吕 杨, 杨金凤
(解放军海军安庆医院, 1. 肿瘤内科; 2. 病理科, 安徽 安庆, 246003)
肺癌是一种严重威胁人类健康的疾病,其发病率和死亡率的逐年升高,引起了世界越来越多研究者的关注。非小细胞肺癌(NSCLC)是最常见的肺癌类型,约占肺癌总数的70%~80%。约70%的NSCLC患者在确诊时已无法手术摘除,或完全切除术后辅助化疗出现耐药性,是NSCLC整体治疗效果不佳的重要原因[1-2]。近年来研究[3]表明,体内失控的炎症反应可能是导致NSCLC发生发展潜在机制。环氧合酶-2(COX-2)是炎症反应重要参与因子,在NSCLC的发展过程中发挥诸多作用[4],而国内外COX-2与磷酸化乙酰辅酶A羧化酶(P-ACC)相关性的研究鲜见报道。本研究通过免疫组化法,比较P-ACC和COX-2蛋白在NSCLC患者肺组织及正常肺组织中的表达情况,并探讨二者的相关性。
1 资料与方法
1.1 一般资料
选取2011年10月—2014年3月收治住院的病理检查确诊为NSCLC且具有完整临床病理资料的52例患者肺组织标本作为NSCLC组,16例因炎性假瘤或其他结核瘤行肺叶切除患者的肺组织标本作为对照组,所有肿瘤患者术前均未行放化疗治疗。NSCLC组,男38例,女14例;年龄22~72岁,平均(58.56±10.21)岁;其中鳞癌26例,腺癌12例,腺鳞癌9例,大细胞癌5例; TNM分期: Ⅰ~Ⅱ期20例,Ⅲ~Ⅳ期32例。2组患者的性别、年龄、病程等一般资料无显著差异(P>0.05), 具有可比性。本实验经本院伦理委员会批准,受试者均签署知情同意书。
1.2 方法
所有标本经中性甲醛固定,石蜡包埋切片,厚度约4 μm。采用免疫组织化学二步法检测蛋白着色程度。根据所应用的P-ACC一抗(购自美国Cell Signaling Technology公司)及COX-2一抗(购自美国Santa Cruz公司)的说明书要求预处理组织切片; 3%过氧化氢去离子水孵育5 min,PBS冲洗3 min 3次;滴加一抗, 37 ℃孵育1 h, PBS冲洗3 min 3次;滴加二抗, 37 ℃孵育15 min,PBS冲洗3 min 3次;应用DAB溶液显色,水洗、苏木素复染2 min、盐酸酒精分化、100%乙醇脱水、氨水返蓝5 min; 二甲苯透明、中性树胶封片、镜检。
1.3 结果判定
结果由2名不知情病理医师进行评判。在400倍视野下每例标本随机选取不重复5个视野。阳性率即视野中阳性细胞占全部细胞的百分比:阳性率0~10%,即为表达阴性(-); 10%~25%,为表达弱阳性(+); 25%~50%, 为表达中度阳性(2+); 阳性率>50%,为表达强阳性(3+)。
2 结 果
2.1 2组肺组织中P-ACC和COX-2蛋白表达情况
对照组肺组织P-ACC蛋白染色主要为阳性(13/16,81.25%), 而NSCLC组仅15例呈阳性染色(15/52,28.85%), 2组比较有显著差异(P<0.01); COX-2在对照组肺组织中阳性表达较低(3/16, 18.75%), 而在NSCLC组织中阳性率较高(33/52,63.46%), 2组比较有显著差异 (P<0.01)。
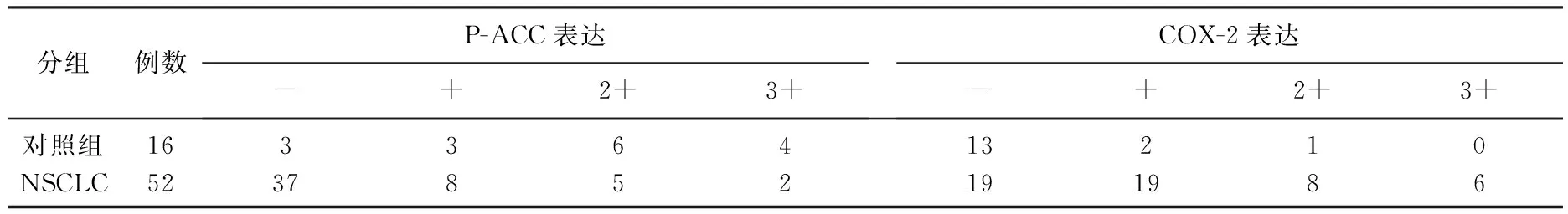
表1 P-ACC与COX-2蛋白表达情况 n
2.2 P-ACC和COX-2蛋白表达与NSCLC临床病理参数的关系
NSCLC组织中P-ACC蛋白的阳性率与患者性别、年龄、肿瘤部位、淋巴结转移及临床病理类型均无相关性,而与肿瘤大小和TNM分期密切相关(P<0.05)。
COX-2的阳性率与患者性别、年龄、肿瘤部位、肿瘤大小及病理类型不相关,与淋巴结转移、TNM分期则密切相关(P<0.05)。见表2。
2.3 P-ACC和COX-2蛋白表达的相关性
52例NSCLC组织中, P-ACC表达阴性的NSCLC组织COX-2阳性表达率为86.67%, P-ACC表达阳性的NSCLC组织COX-2阳性表达率为59.09%, 差异有统计学意义(P<0.05)。P-ACC表达与COX-2表达呈显著负相关(P<0.05)。见表3。

表2 P-ACC和COX-2蛋白表达与NSCLC临床病理参数的关系
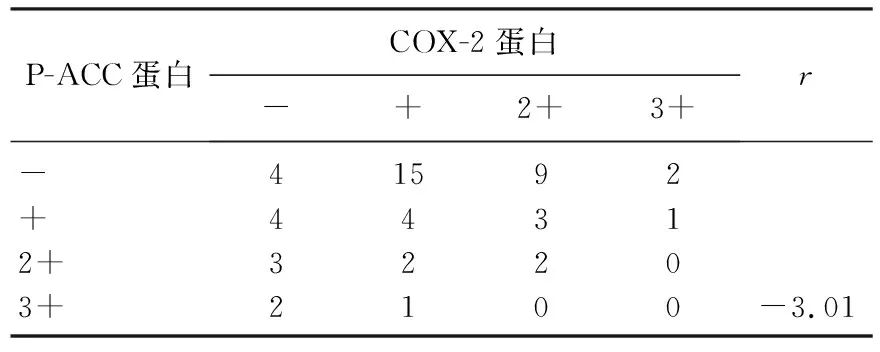
表3 NSCLC组织中P-ACC和COX-2蛋白表达的相关性
3 讨 论
NSCLC早期诊断困难[5], 发现肿瘤时已有超过40%的患者出现远处转移,且治疗生存率低,5年生存率仅为15%左右[6]。肿瘤的组织学类型检查和传统临床表现分期对于判断预后和指导治疗的效力有限。近年来,随着基因、表观遗传学的发展,从分子生物学角度深入研究NSCLC等,有利于从本质上认识肿瘤的发病机制,实现早期诊断和个体化治疗[7]。
P-ACC是乙酰辅酶A羧化酶(ACC)的磷酸化形式,炎症反应中AMP活化蛋白激酶(AMPK)被激活,磷酸化其下游直接靶蛋白ACC使其失活,因此P-ACC可作为AMPK被激活的直接指标[8]。AMPK的活性与炎症分子的表达水平存在密切关系,其激活后可显著减轻机体炎症介质的表达,减少组织的炎症损伤[9]。COX-2作为炎症反应重要节点,在肿瘤发生发展过程中,诱导肿瘤部位血管生成,抑制细胞凋亡与免疫功能,促进肿瘤浸润与侵袭等[10-11]。有学者[12]研究证实了在发生淋巴结转移的肺癌组织中, COX-2蛋白染色程度强于未发生淋巴结转移的肺癌组织。有报告研究COX-2在Ⅰ期NSCLC患者的表达情况,结果显示早期NSCLC中COX-2过表达则患者预后较差,提示过表达的COX-2可作为判断NSCLC患者预后独立不良因素[13]。本研究表明COX-2蛋白在正常肺组织中低表达,而在NSCLC组织中高表达,并且在晚期NSCLC中表达强烈,与上述研究结果一致,进一步表明COX-2在NSCLC的发生、发展过程中发挥重要作用。
本研究重点研究了P-ACC与COX-2的关系,结果显示P-ACC及COX-2几乎与临床病理参数无关,可能与病例选择有关,因为病例选择上没有特意选择发病率最高的腺癌[14]。但本研究证实P-ACC阴性组的COX-2蛋白表达阳性率与P-ACC阳性组差异显著, P-ACC表达与COX-2表达呈显著负相关。说明在NSCLC组织中, P-ACC蛋白表达下调可能激活COX-2的阳性表达,促进NSCLC的发生、发展及侵袭转移。
综上所述,联合检测NSCLC组织的P-ACC与COX-2蛋白表达水平,对临床评估NSCLC病理分期、恶性程度及预后有显著意义,为NSCLC的临床治疗提供了新的思路。
[1] Chen L K, Liang Y, Yang Q Y, et al. Triplet platinum-based combination sequential chemotherapy improves survival outcome and quality of life of advanced non-small cell lung cancer patients[J]. Asian Pac J Cancer Prev, 2012, 13(5): 1863.
[2] Margaritora S, Cesario A, Cusumano G, et al. Pneumonectomy with and without induction chemo-radiotherapy for non-small cell lung cancer: short and long-term results from a single centre[J]. Eur Rev Med Pharmacol Sci, 2013, 17(1): 29.
[3] Dong L X, Sun L L, Zhang X, et al. Negative regulation of mTOR activity by LKB1-AMPK signaling in non-small cell lung cancer cells[J]. Acta Pharmacol Sin, 2013, 34(2): 314.
[4] Meares G P, Qin H, Liu Y, et al. AMP-activated protein kinase restricts IFN-γ signaling[J]. J Immunol, 2013, 190(1): 372.
[5] Yao Y, Fan Y, Wu J, et al. Potential application of non-small cell lung cancer-associated autoantibodies to early cancer diagnosis[J]. Biochem Biophys Res Commun, 2012, 423(3): 613.
[6] Jemal A, Siegel R, Ward E, et al. Cancer statistics[J]. CA Cancer J Clin, 2008, 58(2): 71.
[7] 周南, 翁珊珊. 非小细胞肺癌分子生物学研究进展[J]. 癌症进展, 2011, 9(1): 33.
[8] Liu L, Cash T P, Jones R G, et al. Hypoxia-induced energy stress regulates mRNA translation and cell growth[J]. Mol Cell, 2006, 21(4): 521.
[9] Jeon S M, Chandel N S, Hay N. AMPK regulates NADPH homeostasis to promote tumour cell survival during energy stress[J]. Nature, 2012, 485(7400): 661.
[10] Lin C C, Hsieh H L, Shih R H, et al. Up-regulation of COX-2/PGE2by endothelin-1 via MAPK-dependent NF-kappaB pathway in mouse brain microvascular endothelial cells[J]. Cell Commun Signal, 2013, 11(1): 8.
[11] Huang W C, Chai C Y, Chen W C, et al. Histamine regulates cyclooxygenase 2 gene activation through Orai1-mediated NFκB activation in lung cancer cells[J]. Cell Calcium, 2011, 50(1): 27.
[12] Hida T, Yatabe Y, Achiwa H, et al. Increased expression of cyclooxygenase 2 occurs frequently in human lung cancers, specifically in adenocarcinomas[J]. Cancer Res, 1998, 58(17): 3761.
[13] Kim H S, Kim M J, Kim E J, et al. Berberine-induced AMPK activation inhibits the metastatic potential of melanoma cells via reduction of ERK activity and COX-2 protein expression[J]. Biochem Pharmacol, 2012, 83(3): 385.
[14] 李韶今, 张相民, 李荣, 等. 非小细胞肺癌组织中P-ACC及COX-2的相关性研究[J]. 中国肿瘤临床, 2014, 41(1): 68.

