毛细管电泳-光纤光谱联用技术检测结晶紫
韩 韵,魏国芬,张 霞,连盼盼,王金丽,吕鉴泉
(湖北师范学院 污染物分析与资源化技术湖北省重点实验室, 湖北 黄石 435002)
毛细管电泳-光纤光谱联用技术检测结晶紫
韩 韵,魏国芬,张 霞,连盼盼,王金丽,吕鉴泉
(湖北师范学院 污染物分析与资源化技术湖北省重点实验室, 湖北 黄石 435002)
开发新型毛细管电泳-光纤光谱联用技术并应用于结晶紫的快速检测。以结晶紫为对象,考察了电泳和溶液条件对结晶紫的分离分析信号的影响。结果表明,检测结晶紫的最佳条件为:流动相是0.1 mol/L磷酸缓冲溶液(pH 4.0),检测波长590 nm,分离电压3 kV,进样时间60 s.在最佳条件下,吸光度与0.8~10 μg/mL结晶紫呈现良好的线性关系,相关系数为0.9954,检出限为0.8 μg/mL.方法成功地应用于水体中结晶紫的快速检测。
检测;结晶紫;毛细管电泳;光纤光谱
毛细管电泳(CE)是一种新型高效分离技术,以其柱效高、分析速度快、选择性高、试样消耗少等优点,现已被广泛用于医药卫生、生化、环境等领域[1]。近年来,毛细管电泳与多种检测器联用使得其应用范围更加宽广。Smith等将CE与改进电喷雾口连接,实现了CE-MS联用[2~5],Cheng等将激光荧光检测器与CE联用[6],电化学检测器的联用使得单个神经细胞内液样品分析成为可能[7]。Morris发展了激光拉曼光谱检测法[8],Huang等将电导检测器与CE联用,用于碱金属离子等样品的检测[9]。Kuhr等利用间接荧光法与CE联用,用于多种天然氨基酸的分离检测[10]。
光纤光谱仪是近年发展起来的一种新型光谱仪,其光谱响应范围宽,响应时间短,信噪比高,具有优秀的光学分辨率,高度集成化、模块化可自由搭配,实现了一机多模检测[11],具有广阔的应用前景。加州大学伯克利分校Benhabib课题组利用多通道毛细管电泳为分离设备与光纤光谱仪的荧光检测模式联用证实了火星中有机物大分子和生物标记物的存在[12]。亚利桑那大学Hayes等在联用基础上利用紫外检测器开发出电泳排阻法,成功用于部分碱性染料的分离富集,随后将其应用于带异种电荷蛋白质的同时分离富集[13~15]。该方法主要建立在物理学角度,重现性差,分离能力有限,并不具有广泛的应用前景。
结晶紫或称龙胆紫,属碱性三苯甲烷类染料,具有高效的抗菌性,曾被广泛应用于鱼类疾病的抗菌药。然而近年来,国内外研究者发现结晶紫通过生物体内转化富集,具有“三致”效应,被列为水产养殖禁用药物行列[16,17]。本文将毛细管电泳与光纤光谱仪器连接起来,构建一种新的联用技术,采用紫外可见检测构建毛细管电泳-光纤光谱仪联用系统,并以结晶紫为模型化合物考察了联用系统的条件。
1 实验部分
1.1试剂
乙腈(色谱纯),结晶紫标准品、磷酸、磷酸二氢钠、乙酸、乙酸铵等分析纯试剂均产于天津科密欧公司,用水均为双重蒸馏水。结晶紫标准储备液(0.1 mg/mL):准确称取0.0100 g结晶紫标准品,用乙腈溶解并定溶至100mL.
1.2仪器与实验条件
HR4000光纤光谱仪、DH2000 UV-VIS-NIR光源、CUV-CCE毛细管电泳通道均由美国Ocean Optic公司产,GY-6型高压电源(东北大学分析科学研究中心),石英毛细管柱19 cm×75 μm(河北永年光导纤维厂)。
1.3实验方法
所有溶液使用前均用0.45 μm滤膜过滤,每次实验前分别用0.1 mol/L NaOH,0.1 mol/L HCl,二次水,缓冲溶液冲洗毛细管各5 min,以0.1 mol/L,pH 4.0的磷酸缓冲溶液为缓冲介质,采用高度差进样,进样高度15 cm,进样时间60 s,分离电压3 kV,检测波长590 nm,实验温度为室温。
2 结果与讨论
2.1仪器构造
自组装毛细管电泳-光纤光谱联用装置如图1所示。CUV-CCE接口固定于水平可移动板上,与Foret等人研制出的接口[18]相比,配套光纤通过特有的套管可保证光路准确通过毛细管光窗,消除电泳系统中的压力限制,轻巧的设计方便拆卸和携带,具有更强的便携性和仪器稳定性。
2.2缓冲溶液pH的优化
选用常见的毛细管区带电泳缓冲溶液磷酸-磷酸二氢钠做为缓冲介质,分别考察不同pH下样品分离情况,分离电压3 kV,进样高度15 cm,进样时间60 s,样品浓度0.1 mg/mL,检测波长590 nm.不同pH下电泳谱图如图2所示。
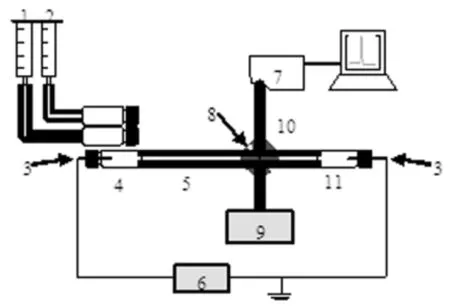
图1 毛细管电泳-光纤光谱联用装置示意图
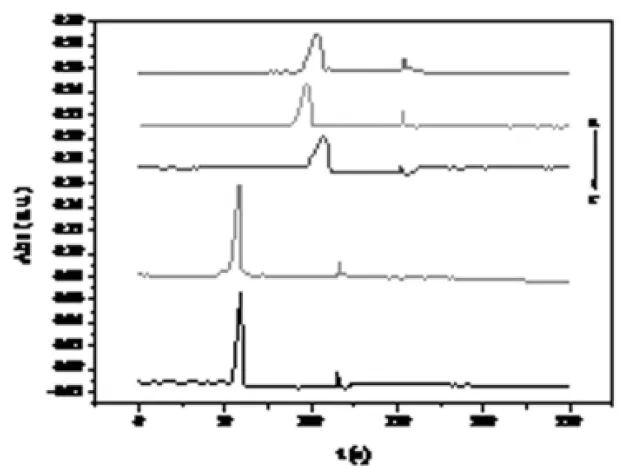
图2 pH优化电泳谱图
结果表明,pH小于4.0时,柱效较差,而pH为4.5时,电流噪声较大,信噪比较小,故选择pH 4.0为最优缓冲pH.
2.3分离电压的优化
考察了不同分离电压时对分离效率的影响,样品在pH为4.0的缓冲介质中,检测波长为590 nm不同分离电压的电泳谱图如图3所示。
由图可知,当分离电压为3 kV时,柱效高,出峰时间短,故选择3 kV为最优分离电压。
2.4缓冲介质的优化
考虑毛细管区带电泳中常用缓冲试剂:磷酸盐、硼酸或硼砂、醋酸盐,由于硼酸盐缓冲溶液pH范围为碱性,不符合结晶紫分离需求。本实验只对磷酸体系和醋酸体系进行考察。分别配制pH 4.0,1 mmol/L磷酸-磷酸二氢钠和醋酸-醋酸铵为缓冲介质,对同一标准溶液进行电泳分离,分离电压3 kV,检测波长为590 nm,电泳谱图如图4所示。
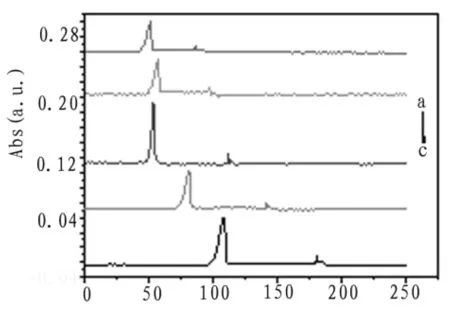
图3 电压优化电泳谱图
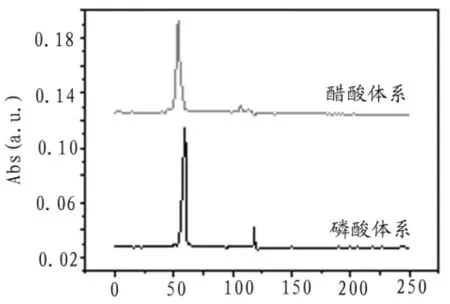
图4 缓冲介质优化电泳谱图
从图中可以看出,当缓冲体系为醋酸-醋酸铵时,半峰宽较大,信噪比较小,故选择磷酸-磷酸二氢钠为缓冲体系。
2.5缓冲溶液浓度优化
考察了不同浓度的磷酸-磷酸二氢钠缓冲溶液对分离效率的影响,选择浓度分别为0.02、0.04、0.06、0.08、0.1 mol/L,pH为4.0的磷酸-磷酸二氢钠缓冲溶液进行实验,分离电压3 kV,检测波长590 nm。电泳谱图如图5所示。
图中可见,当浓度为0.1 mol/L时,分离效率最高,浓度大于0.1 mol/L时,电流焦耳热较大,管内易产生空泡,故选择0.1 mol/L的磷酸-磷酸二氢钠缓冲溶液为最佳浓度。
2.6进样时间优化
由于自组装毛细管电泳系统手动进样误差较大,选择相对低的进样高度和相对长的进样时间可以减小系统误差,考察了40、50、60、70、80 s五个不同进样时间对分离效率的影响。所用缓冲体系pH=4.0,浓度为0.1 mol/L磷酸-磷酸二氢钠缓冲,分离电压3 kV,检测波长为590 nm.电泳谱图如图6所示。
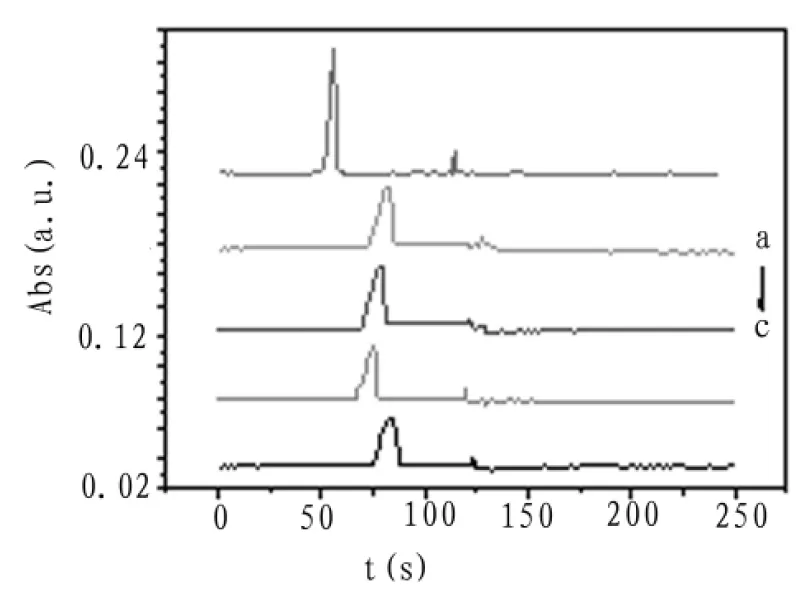
图5 缓冲溶液浓度优化电泳谱图
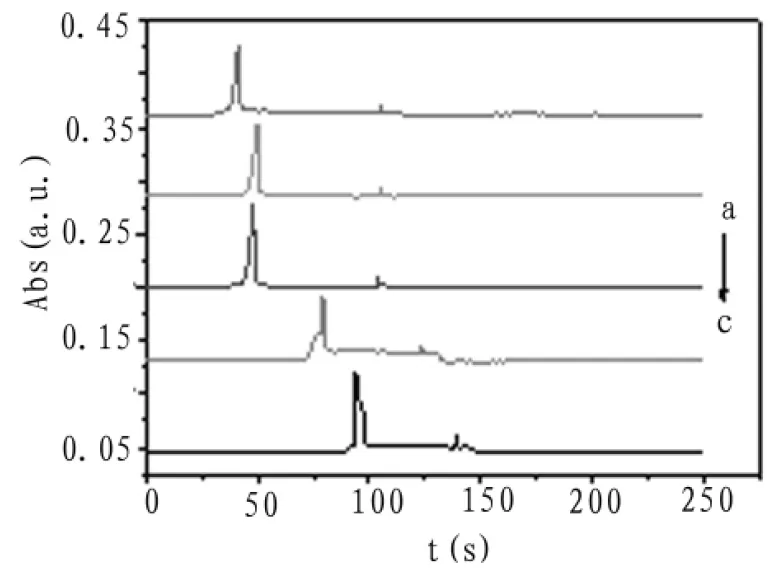
图6 进样时间优化电泳谱图
图7为不同进样时间的峰高变化。由图中可见,进样时间为60 s时,峰高峰型均为最优,故选择60 s为最佳进样时间。
2.7标准曲线的绘制
取结晶紫母液分别稀释至0.8、3、5、8、10 μg/mL,按照上述最优条件进行实验,绘制出峰高Abs
与浓度c标准曲线和线性关系如图9所示。计算得回归方程为y=5.47X+0.0097,相关系数R2=
0.9954检出限(S/N=3)为0.8 μg/mL,对5 μg/mL结晶紫平行测定5次,相对标准偏差为0.62%.
2.8样品分析
本实验条件下,未知水样经0.45 μm滤膜过滤后,未检测出结晶紫。在水样中加入标准结晶紫溶液,回收率为95.23%~103.15%.实验结果表明,该联用体系稳定性良好,可用于实际样品分析。
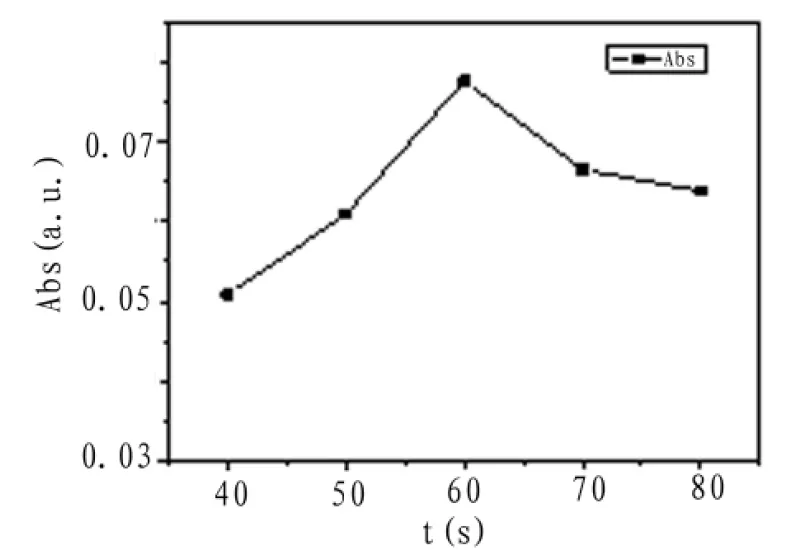
图7 进样时间对峰高的影响
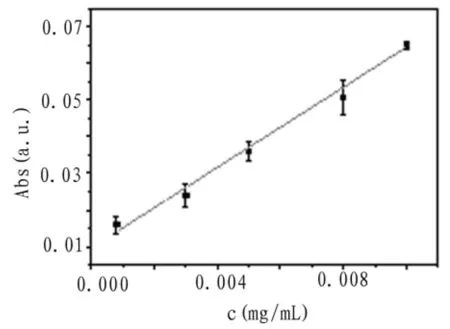
图8 浓度c与峰高Abs关系
3 结论
本文首次成功构建了毛细管区带电泳-光纤光谱联用快速检测新方法,并以结晶紫为模型化合物对该方法进行考察,与文献比照实验检出限相近(见表1),该方法可对待测物进行快速准确的分析检测。

表1 不同方法线性范围和检出限比较
[1]肖虎勇.毛细管电泳联用技术在食用油分析中的应用[D].湖北师范学院,2013.
[2]Olivares J A, Nguyen N T, Yonker C R, et al.On-line mass spectrometric detection for capillary zone electrophoresis [J]. Anal Chem, 1987, 59(8):1230~1232.
[3]Smith R D, Olivares J A, Nguyen N T, et al.Capillary zone electrophoresis-mass spectrometry using an electrospray ionization interface [J]. Anal Chem, 1988, 60 (5):436~441.
[4]Smith R D, Udseth H R. Capillary zone electrophoresis-MS [J]. Nature (London), 1988, 331: 639~640.
[5]Smith R D, Barinaga C J, Udseth H R. Improved electrospray ionization interface for capillary zone electrophoresis-mass spectrometry [J]. Anal Chem, 1988, 60 (18): 1948~1952.
[6]Cheng Y F, Dovichi N J. Subattomole amino acid analysis by capillary zone electrophoresis and laser-induced fluorescence [J]. Science, 1988, 242(4878): 562~564.
[7]Wallingford R A, Ewing A G. Capillary zone electrophoresis with electrochemical detection in 12.7 .mu.m diameter columns [J]. Anal Chem, 1988, 60 (18): 1972~1975.
[8]Chen C Y, Morris M D. Raman Spectroscopic Detection System for Capillary Zone Electrophoresis [J]. Appl Spectrosc, 1988, 42(3): 513~515.
[9]Huang X H, Teng K, Pang J, et al.On-column conductivity detector for capillary zone electrophoresis [J]. Anal Chem, 1987,59 (23): 2747~2749.
[10]Kuhr W G, Yeung E S. Indirect fluorescence detection of native amino acids in capillary zone electrophoresis [J]. Anal. Chem., 1988, 60 (17): 1832~1834.
[11]魏国芬,寇文杰,叶 泰,等.光纤光谱方法快速检测尿液中的有机磷农药生物标志物[J].湖北师范学院学报(自然科学版), 2011, 3(31): 60~64.
[12]Benhabib M, Chiesl T N, Stockton A M.et al. Multichannel Capillary Electrophoresis Microdevice and Instrumentation for in Situ Planetary Analysis of Organic Molecules and Biomarkers [J]. Anal. Chem., 2010, 82 (6): 2372~2379.
[13]Meighan M M, Keebaugh M W, Quihuis A M, et al.Electrophoretic exclusion for the selective transport of small molecules [J]. Electrophoresis, 2009, 30(21): 3786~3792.
[14]Meighan M M,Vasquez J, Dziubcynski L,et al. Investigation of Electrophoretic Exclusion Method for the Concentration and Differentiation of Proteins [J]. Anal. Chem., 2011, 83(1): 368~373.
[15]Kenyon S M, Weiss N G, Hayes M A. Using electrophoretic exclusion to manipulate small molecules and particles on a microdevice [J]. Electrophoresis, 2012, 33(8): 1227~1235.
[16]Munns R K, Holland D C, Roybal J E, et al. Liquid chromatographic determination of methylene blue and its metabolites in milk [J]. Journal of AOAC International, 1992, 75(5):796~800.
[17]Bhasikuttan A C, Sapre A V, Shastri L V. Oxidation of crystal violet and malachite green in aqueous solutions-a kinetic spectrophotometric study[J]. Journal of Photochemistry and photobiology A: Chemistry, 1995, 90(2): 177~182.
[18]Foret F,Deml M, Kahle V, et al.On-line fiber optic UV detection cell and conductivity cell for capillary zone electrophoresis [J], Electrophoresis, 1986, 7(9): 430~432.
[19]肖虎鹏,周小理,韩 生,等.CE-UV-Vis法测定鲫鱼中结晶紫[J].化学世界, 2012, (1): 19~23.
Detectionofcrystalvioletbycapillaryelectrophoresis-fiberopticspectrometer
HAN Yun, WEI Guo-fen, ZHANG Xia,LIAN Pan-pan, WANG Jin-li, LV Jian-quan
(Hubei Key Laboratory of Pollutant Analysis & Reuse Technology,Hubei Normal University, Huangshi 435002, China)
A novel method for the determination of crystal violet (CV) has been developed based the capillary electrophoresis - fiber optic spectrometer system. The conditions for the system and analysis of CV are experimentally investigated. The optimum conditions are as follow: mobile phase, 0.1 mol/L H3PO4-NaH2PO4buffer solution (pH 4.0), detection wavelength at 590nm in the visible region, separation voltage 3000V, and injection time 60s. Under the optimum conditions, the absorbance is proportional linearly to CV concentration in the range of 3 and 10 μg/mL, the correlation coefficient is 0.9954, and the detection limit was 0.8 μg/mL. This method has been successfully applied in rapid detection of CV.
detection; crystal violet; capillary electrophoresis; fiber optic spectrometer
2014—01—27
韩韵(1988— ),男,湖北省丹江口市人,硕士生,研究方向为基础研究.
O657.8
A
1009-2714(2014)02- 0088- 05
10.3969/j.issn.1009-2714.2014.02.020

