17α -己酸羟孕酮对人外周血单个核细胞抵抗地塞米松的逆转作用研究
汪 耀,王养正,Changqing Lee,肖湘华,杨 华,刘先宁,安 娜,朱娟莉,朱秀萍 (.陕西省眼科研究所,西安市第一医院,陕西省眼科学重点实验室,西安 7000;.美国Prairie制药公司,马里兰州贝塞斯达 080)
糖皮质激素(glucocorticoid, GC)以其强大的抗炎和免疫抑制作用成为治疗各种炎症和变态性疾病的一线药物。但部分患者对其治疗反应较差,临床上称之为糖皮质激素抵抗(glucocorticoid resistant, GR)。目前提出或者研究多种方法来逆转糖皮质激素抵抗,比如P38 MAPK抑制剂、JNK抑制剂、组蛋白脱乙酰-2活化剂、茶碱、抗氧化剂、iNOS抑制剂和P-糖蛋白抑制剂[1-2]。孕激素类药17α-己酸羟孕酮(17α-hydroxyprogesterone caproate, 17HPC)单用时可用于治疗习惯性流产、月经不调、子宫内膜异位症、功能性子宫出血等,用于逆转糖皮质激素抵抗的可能是一种新的用途。本研究旨在经不同浓度IL-2/4刺激,建立人外周血单个核细胞(peripheral blood mononuclear cells, PBMC)对地塞米松(dexamethasone, DEX)抵抗的细胞实验模型,探讨孕激素逆转外周血单个核细胞对糖皮质激素抵抗的作用。
1 仪器、材料和方法
1.1 仪器 二氧化碳培养箱(NU-4950,美国NuAire公司);离心机(5810 R,德国Eppendorf公司);全自动酶标仪(Thermo Scientific Multiskan MK3,美国热电公司)。
1.2 材料 17HPC、DEX、植物血凝素(phytohemagglutinin, PHA)、二甲亚砜(DMSO)购于Sigma 公司(美国);重组IL-2和IL-4购于PeproTech(美国),PRMI 1640培养基购于HyClone(北京)。PBMC分离系统:Accuspin系统-Histopaque,购于GE Healthare Bio-Science AB(美国);人的IL-2免疫吸附(Enzyme linked immunosorbent assay, ELISA)测定试剂盒为上海Excell Biology公司产品。
1.3 方法
1.3.1 PBMC的分离与培养 抽取空腹男性健康志愿者外周血15 mL,置于含有肝素钠的离心管中,使用Accuspin系统-Histopaque分离获得PBMC。方法:将外周血缓慢加入等体积的淋巴细胞分离液中,在20 ℃下,以2 500 r·min-1离心30 min;吸取中间白膜层即为PBMC。重新悬浮于4 倍体积的RPMI 1640,在20℃下,以1 000 r·min-1离心10 min,洗涤3次。沉淀的细胞用1640完全培养基悬浮后计数。调整细胞浓度为2×106/mL,加入96孔板培养。
1.3.2 测定DEX对PHA诱导PBMC产生IL-2的抑制作用 将PBMC(106/mL)铺板在96孔板中,在37 ℃、体积分数5%CO2下培养,设空白组和不同浓度DEX(10-12~10-5mol·L-1)组刺激1 h,接着用植物血凝素(phytohemagglutinin, PHA) 15 μg·mL-1刺激24 h。收集细胞培养液,以2 000r·min-1离心10 min后,收集上清,用ELISA双抗体夹心法检测IL-2含量,每组检测2个复孔。酶标仪在450 nm处检测、550 nm校正来测定A值。IL-2水平用标准曲线定量。IL-2检出限为4.0 pg·mL-1。
1.3.3 IL2和IL-4刺激细胞诱导其对地塞米松抵抗的实验模型构建[3-5]将PBMC(106/mL)铺板在96孔板中,在37 ℃、体积分数5%CO2下培养,设空白组和实验组,实验组用IL-2(13ng·mL-1)和IL-4(6.5 ng·mL-1)共同刺激,培养48 h,接着实验组加入不同浓度的DEX(10-10, 10-8和10-6mol·L-1)继续培养1 h,然后所有组别再用PHA(15 μg·mL-1)刺激24 h,ELISA测定IL-2浓度,计算地塞米松对PHA诱导生成的IL-2的抑制率。抑制率(%)=1-(有地塞米松时PBMC产生的IL-2/无地塞米松时PBMC产生的IL-2)×100%
1.3.4 17HPC对IL2和IL-4刺激细胞诱导DEX抵抗的逆转作用 将PBMC(106/mL)铺板在96孔板中,用17HPC(10-11~10-5mol·L-1)刺激12 h,在37 ℃、体积分数5%CO2培养下,其中阴性对照组不用IL-2和IL-4刺激,其余实验组用IL-2(13 ng·mL-1)和IL-4(6.5 ng·mL-1)共同刺激,培养48 h;接着实验组加入不同浓度的DEX(10-12~10-6mol·L-1)1 h,所有组别用PHA(15 μg·mL-1)刺激24 h,ELISA测定IL-2的质量浓度,计算17HPC单独以及17HPC与DEX合用时,对PHA刺激产生的IL-2的抑制率(%)。将来自阴性对照(细胞+PHA,无任何药物处理)的值设定为0%,所有其他的抑制率以公式计算:抑制率(%)=1-(药物处理的PBMC产生的IL-2/阴性对照组PBMC产生的IL-2) ×100%。IC50(半数抑制浓度)的值采用GraphPad Prism 5.0应用软件处理计算。
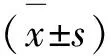
2 结果
2.1 DEX对PHA诱导PBMC产生IL-2的抑制作用 DEX对PHA诱导PBMC产生IL-2的抑制作用,呈现显著的浓度依赖性,见图1。PBMC分泌的IL-2水平,不用PHA刺激时为19±25 pg·mL-1(n=11);PHA(15 μg·mL-1)刺激后,为677±447 pg·mL-1(n=20);PHA(15 μg·mL-1)刺激后,再分别加入DEX 10-12,10-10,10-8和10-6mol·L-1,PBMC分泌的IL-2分别为371±447 pg·mL-1(n=11)、287±313 pg·mL-1(n=14)、293±338 pg·mL-1(n=17)和144±157 pg·mL-1(n=17)。
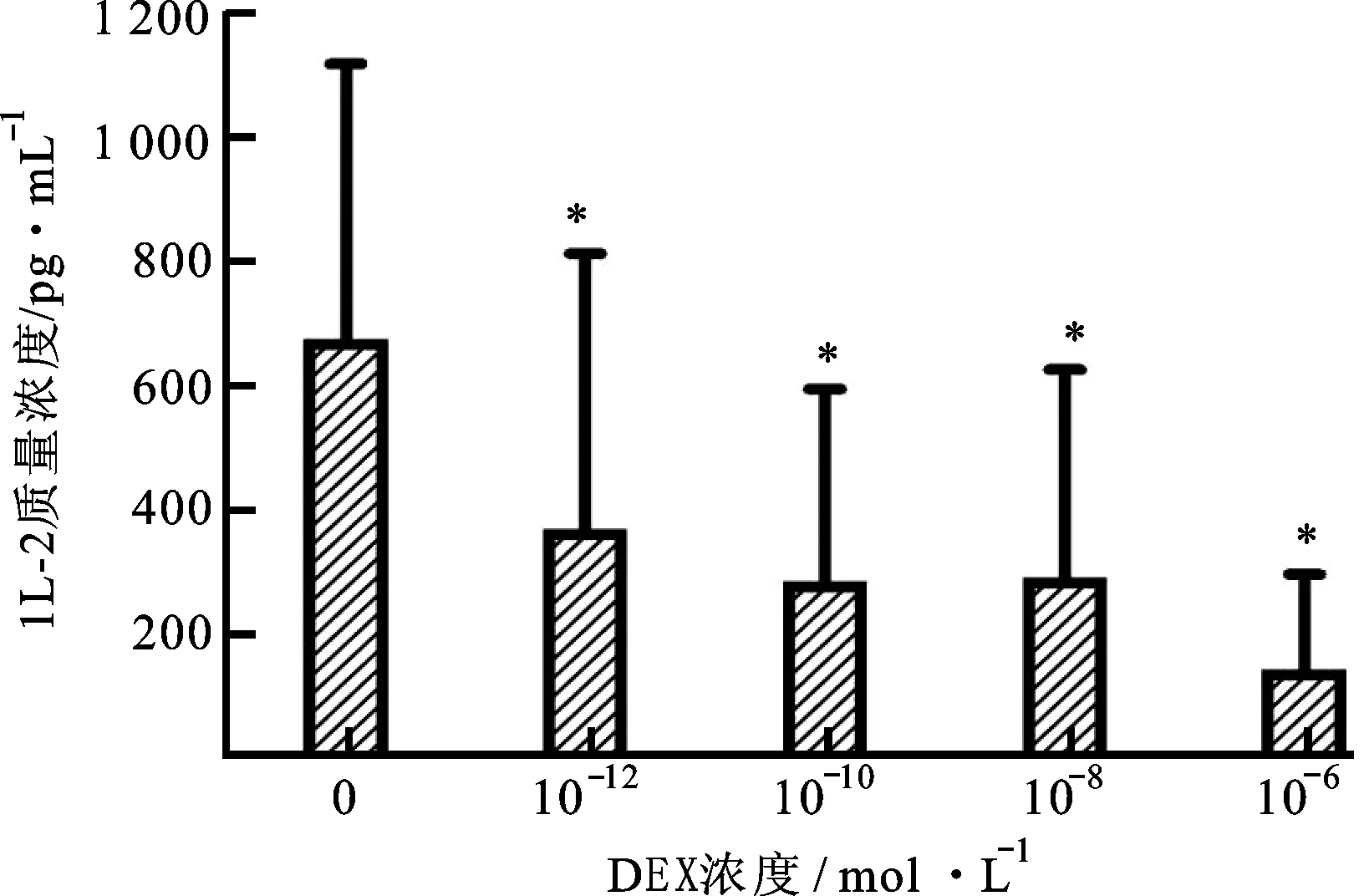
图1 DEX对PHA诱导PBMC产生IL-2的抑制作用
2.2 IL-2和IL-4刺激诱导DEX抵抗的细胞实验模型的构建 见图2。结果表明,加入IL-2和IL-4显著地降低了DEX对PHA诱导的IL-2生成的抑制能力(n=11)。未加入和联合加入IL-2和IL-4对比,低剂量的DEX 10-10mol·L-1,抑制率为52%对比0%;剂量为DEX 10-10mol·L-1时,抑制率为66%对比26%;较高剂量的DEX 10-6mol·L-1,抑制率为87%对比21%,对比显著。说明IL2和IL-4显著降低了志愿者对于DEX敏感性,也即诱导DEX发生了抵抗性,IL-2(13 ng·mL-1)和IL-4(6.5ng·mL-1)共同刺激PBMC可以作为诱导DEX抵抗的细胞实验模型。由图2可知,加入IL-2和IL-4刺激,DEX对PHA诱导的PBMC生成的IL-2的抑制率(%)显著降低。

图2 IL-2和IL-4诱导的DEX抵抗
2.3 17HPC逆转DEX抵抗 利用IL-2和IL-4刺激诱导DEX抵抗的细胞实验模型,即不同浓度DEX单独或者与17HPC联合,PHA刺激24 h后检测PBMC上清中的IL-2的产生。以阴性对照(细胞+PHA,IL-2和IL-4刺激,但不加17HPC和DEX) 对单个核细胞分泌IL-2的抑制率为0%来计算,单用DEX(0, 10-12, 10-10, 10-8和10-6mol·L-1)对IL-2的抑制率分别为0%, 49%, 57%, 46%和78%;17HPC 10-11mol·L-1与以上浓度DEX联合应用时,抑制率分别为39%, 63%, 78%, 77%和99%;17HPC 10-10mol·L-1与以上浓度DEX联合应用时,抑制率分别为43%, 82%, 76%, 76%和96%;17HPC 10-7mol·L-1与以上浓度DEX联合应用时,抑制率分别为37%, 85%, 86%, 69%和99%;17HPC 10-5mol·L-1与以上浓度DEX联合应用时,抑制率分别为69%, 76%, 81%, 81%和97%。由此可知,较高剂量的10-6mol·L-1的DEX抑制IL-2释放的抑制率为78%,而低剂量DEX(10-10mol·L-1或者10-12mol·L-1,加入17HPC(10-11mol·L-1或者10-10mol·L-1),将获得大约相同的抑制率(与DEX相比,IL-2抑制率约为78%)。即仅仅使用万分之一或者十万分之一的剂量,就可获得类似的抗炎效应。
在17HPC的浓度为0, 10-11, 10-10, 10-7和10-5mol·L-1时,通过以上抑制率计算DEX的IC50,分别为7.06×10-11, 6.13×10-13, 2.26×10-13, 1.81×10-13和3.22×10-13mol·L-1。可知加入17HPC后,可以至少降低DEX的IC50的值100倍以上。
3 讨论
糖皮质激素对人PBMC在IL-2和IL-4诱导下敏感性降低的研究模型,可用于评价和筛选糖皮质激素抵抗性和敏感性的可能调节剂[3-6]。PBMC是终末分化细胞,是糖皮质激素作用的主要靶细胞之一,它对激素的反应性低下与临床肾病综合征、支气管哮喘、类风湿关节炎等激素抵抗现象相关[7]。PHA是植物血凝素类多克隆刺激剂,通过细胞表面的CD3-TCR复合体作用于人的T细胞刺激其增殖。IL-2又名T细胞生长因子(T cell growth factor,TCGF),主要由活化的T细胞合成分泌,是参与炎症反应的重要因子。本实验通过IL-2、IL-4和PHA分别刺激PBMC分泌IL-2,建立诱导PBMCs 产生糖皮质激素抵抗的模型,进行药物逆转糖皮质激素抵抗的实验。
实验结果显示,IL-2和IL-4作用于外周血单个核细胞,可明显降低地塞米松对其抑制作用的反应性,可作为评价糖皮质激素耐受性的细胞研究模型。在健康男性中,加入17HPC,仅仅使用万分之一或者十万分之一的最初DEX的剂量,就可获得类似的抗炎效应;降低DEX的IC50至少100倍以上。因此,17HPC可改善DEX使用的安全性,减轻不良反应的发生。
本实验直接采用人外周血进行实验,具有一定的临床意义;采用单个核细胞建立实验模型,可作为糖皮质激素增敏剂的筛选平台,具有方便、灵敏、快捷的特点。不足之处是所选样本量少,需加大样本量继续研究。
实验初步证实,孕激素17α-己酸羟孕酮具有逆转糖皮质激素抵抗性和提高糖皮质激素敏感性的作用,为糖皮质激素抵抗患者提供了新的思路和药物治疗手段。
参考文献:
[1] 孙云, 陈亚红. 气道慢性炎症疾病激素抵抗机制的研究进展[J].国际呼吸杂志, 2011, 31(13):1021-1024.
[2] 王雪萍, 姜傥. 糖皮质激素受体与糖皮质激素抵抗[J]. 国际检验医学杂志, 2012, 33(8):940-941.
[3] Creed T J, Lee R W, Newcomb P V, et al. The effects of cytokines on suppression of lymphocyte proliferation by dexamethasone [J]. J Immunol, 2009, 183(1):164-171.
[4] KamJ C, Szefler S J, Surs W, et al. Combination IL-2 and IL-4 reduces glucocorticoid receptor-binding affinity and T cell response to glucocorticoids [J]. J Immunol, 1993, 151(7):3460-3466.
[5] Bessler H, Straussberg R, Gurary N, et al. Effect of dexamethasone on IL-2 and IL-3 production by mononuclear cells in neonates and adults[J]. Arch Dis Child Fetal Neonatal Ed, 1996, 75(3) :F197-201
[6] Irusen E, Matthews J G, Takahashi A, et al. p38 Mitogen-activated protein kinase-induced glucocorticoid receptor phosphorylation reduces its activity:role in steroid-insensitive asthma [J]. J Allergy Clin Immunol, 2002, 109(4) :649-657.
[7] Hirano T, Akashi T, Keira T, et al. Clinical impact of cyclosporine cellular pharmacodynamics in minimal change nephrotic syndrome [J]. Clin Pharmacol Ther, 2000, 68(5):532-540.

