活血定痛合剂中丹参素和原儿茶醛的含量测定
李全斌,张昌文,吴建萍,钱洪波,李纪元
0 引言
活血定痛合剂(HXDTM)为医院协定处方制备的中药复方医院制剂,由丹参、赤芍、当归、川芎、红花、生地、桃仁、苏木、陈皮、枳壳、瓜蒌等十多味中药制成,前期药理学实验初步证实了HXDTM具有良好的抗炎、镇痛及改善微循环作用[1-5]。该制剂中诸药合用,可主治因气滞血瘀之痛症、跌打损伤、骨折肿痛等,具有活血化瘀、消肿止痛之功效,疗效确切。丹参作为我国传统的中药材之一,其有效成分复杂,组方中丹参的水溶性酚酸类化合物(均具有邻二酚羟基苯甲醛的结构),如丹参素、原儿茶醛和丹酚酸B等,以及脂溶性的二萜醌类化合物,如丹参酮Ⅰ、二氢丹参酮Ⅰ、丹参酮ⅡA、隐丹参酮等,在丹参的生物学活性方面占有重要的地位,因此,可用于丹参制剂的质量控制与评价[6]。
活血定痛合剂采用水提工艺制备,用薄层色谱对HXDTM中的当归、川芎、红花、赤芍、丹参等进行定性鉴别,通过在室温下留样试验考察该制剂的外观、性状、鉴别以及微生物限度等项目,表明该制剂质量稳定[7]。但该制剂中脂溶性成分丹参酮ⅡA含量很低,难以检测,为了进一步有效地控制活血定痛合剂的质量,确保临床用药安全、有效,本实验以丹参中的水溶性活性成分丹参素钠和原儿茶醛作为含量测定的考察指标,用高效液相色谱法测定活血定痛合剂中二者含量,方法简便准确,结果满意,为控制活血定痛合剂的质量提供了可靠实验依据,现将结果报道如下。
1 仪器与试药
1.1 仪器 Agilentl100高效液相色谱仪(美国安捷伦),Agilent紫外检测器,Agilent色谱化学工作站,Agilent Eclipse XDB-C18柱(4.6 mm×250 mm,5 μm),XS-104微量分析天平(瑞士梅特勒公司),摩尔纯水机,UV-2201(日本岛津),Sartorius CP225D分析天平(德国Sartorius公司)。
1.2 试药 丹参素钠和原儿茶醛对照品(中国药品生物制品检定所,含量测定用,批号:110855-200507、l10810-200506),HXDTM及阴性对照品(自制,由华中科技大学同济医学院附属荆州医院制剂室提供处方,规格:500 mL/瓶,批号:20120628、20120816和20121012),甲醇(色谱纯,天津市科密欧化学试剂有限公司),冰醋酸(分析纯,北京化工厂),水为超纯水,其余试剂均为分析纯。
2 方法与结果
2.1 色谱条件 色谱柱:Eclipse XDB-C18(4.6 mm×250 mm,5 μm),Agilent公司;流动相:乙腈-0.5%冰醋酸(25∶75);柱温:35 ℃;检测波长:280 nm流速:1.0 mL/min;进样量:10 μL。
2.2 溶液的制备
2.2.1 对照品储备液的制备 精密称取丹参素钠(经五氧化二磷减压干燥24 h)对照品8.4 mg,置于25 mL量瓶中,用0.5%冰醋酸水溶液溶解并定容至刻度,制成质量浓度为0.336 g/L的丹参素钠对照品储备溶液。
精密称取原儿茶醛(经五氧化二磷减压干燥24 h)对照品3.2 mg,置于25 mL量瓶中,用0.5%冰醋酸水溶液溶解并定容至刻度,制成质量浓度为0.128 g/L的原儿茶醛对照品储备溶液。
2.2.2 供试品溶液的制备 精密量取HXDTM 1 mL,置于10 mL量瓶中,用0.5%冰醋酸水溶液稀释至刻度,用0.45 μm微孔滤膜过滤,取续滤液作为供试品溶液。
2.2.3 阴性对照溶液的制备 按HXDTM的处方及制备工艺制备不含丹参药材的阴性样品,按“2.2.1”项下方法制备,即得阴性对照溶液。
2.3 线性关系考察 分别精密吸取“2.2.1”项下质量浓度为0.336 g/L丹参素钠对照品储备溶液5 mL和质量浓度为0.128 g/L的原儿茶醛对照品储备溶液5 mL,置于10 mL的棕色量瓶中,制得含丹参素钠168.00 μg/mL和原儿茶醛的质量浓度为64.00 μg/mL的混合溶液,取上述混合溶液5、2.5 mL置于10 mL的棕色量瓶中,用0.5%醋酸水溶液定容稀释,可以制得含丹参素钠42.00、84.00 μg/mL和原儿茶醛的质量浓度为16.00、32.00 μg/mL的混合溶液,如此操作可以制得含丹参素钠5.25、10.50、21.00 μg/mL和原儿茶醛的质量浓度为2.00、4.00、8.00 μg/mL的系列混合溶液,在上述色谱条件下操作,进样量为10 μL,以丹参素钠、原儿茶醛峰面积(A)为纵坐标,以丹参素钠、原儿茶醛质量浓度(C)为横坐标,绘制标准曲线,丹参素钠与原儿茶醛的回归方程分别为:A1=3.915×104C1-6.912×102,r=0.998 9;A2=5.453×105C2-6.569×103,r=0.999 3。
结果表明:丹参素钠与原儿茶醛进样量分别在5.25~168.00 μg/mL和2.00~64.00 μg/mL范围内与峰面积呈良好线性关系。
2.4 系统适应性试验 按上述色谱条件下,取线性关系项下制备的混合对照品标准溶液、供试品溶液及阴性样品溶液,设定进样次序。记录HPLC图,在以上色谱条件下,丹参素和原儿茶醛与其他色谱峰能达到较好的分离,丹参素钠保留时间约8.9 min,原儿茶醛保留时间为15.9 min;理论塔板数按丹参素计算不低于4 000,按原儿茶醛计算不低于5 000;阴性对照品溶液在丹参素和原儿茶醛吸收峰的位置上均无吸收峰,供试品溶液中丹参素钠、原儿茶醛可达到基线分离,峰形对称,阴性对照品溶液无干扰,基线稳定,方法可行。实验结果见图1。
2.5 精密度试验 取线性关系项下的同一混合对照品溶液(含丹参素钠42.00 μg/mL,原儿茶醛16.00 μg/mL)10μL,在拟定的色谱条件下重复进样6次,记录峰面积,计算得丹参素钠和原儿茶醛的RSD(n=6)分别为1.06%和1.09%,结果表明该仪器精密度良好。
2.6 重现性试验 取HXDTM(批号:20110216)适量,按“2.2.2”项下方法平行制备供试品溶液6份,在上述色谱条件下,重复进样5次,记录丹参素钠和原儿茶醛的峰面积,计算得到RSD分别为0.92%和0.87%,结果表明该测定方法的重现性符合要求。
2.7 稳定性试验 取HXDTM(批号:20110216)适量,室温放置,按上述色谱条件,分别于0、2、4、8、12、24 h进样分析,测定峰面积,丹参素钠和原儿茶醛的RSD(n=6)分别为1.62%和1.49%,结果表明供试品溶液在24 h内稳定。
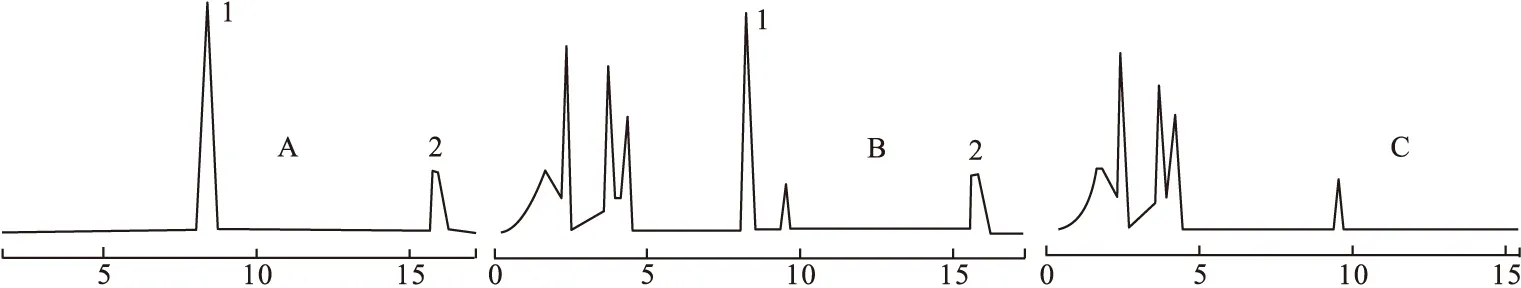
图1 HXDTM的高效液相色谱图
2.8 加样回收率试验 精密吸取已知丹参素钠和原儿茶醛含量的HXDTM样品(批号:20110221)9份,每份1 mL,按大约样品含量的20%、40%、80%分别加入线性关系项下的丹参素钠及原儿茶醛适量,按“2.2.2”项下方法制备供试品溶液,在上述色谱条件下,进样测定,计算加样回收率,结果见表1,表明方法的回收率良好。
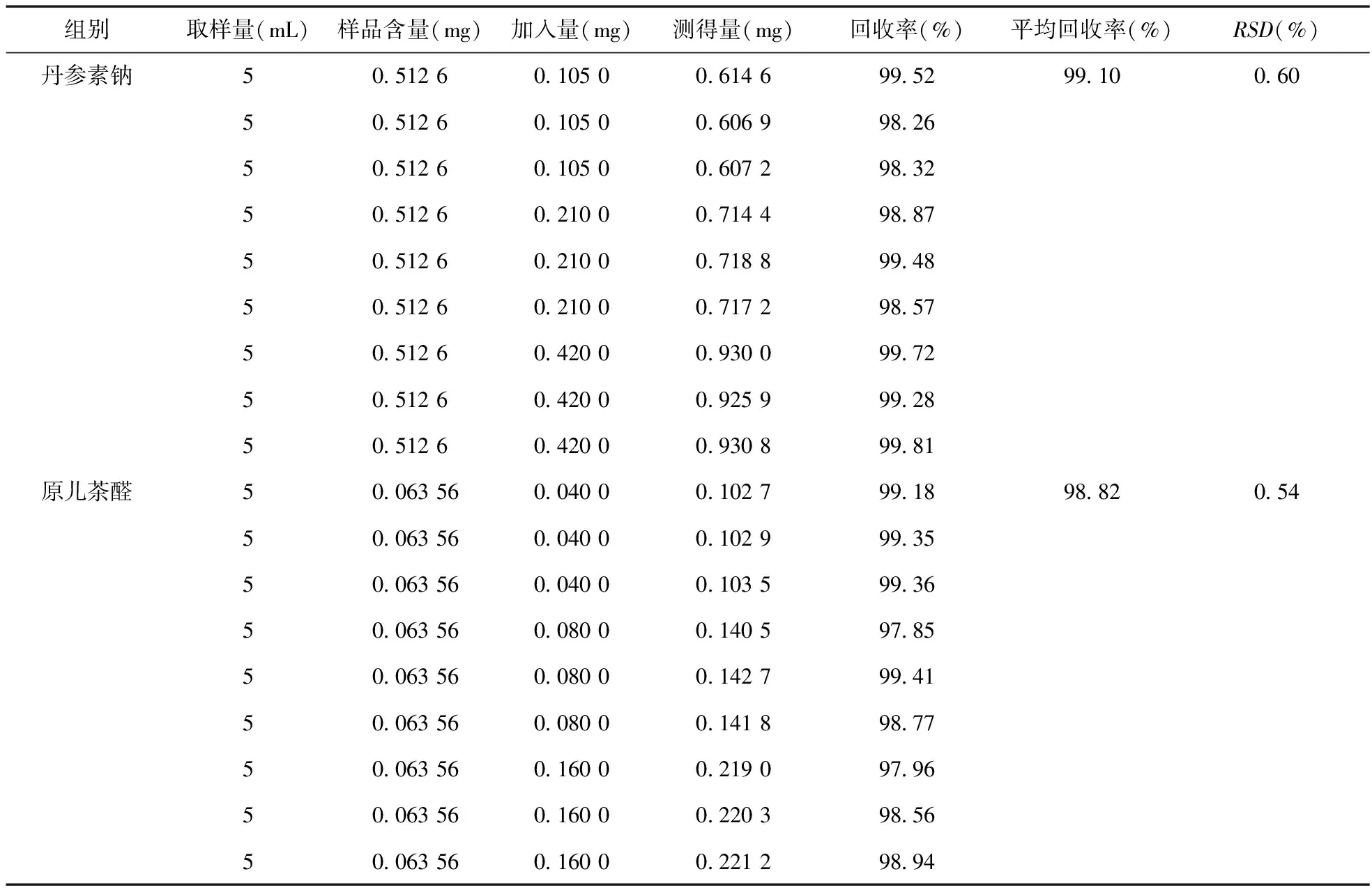
表1 回收率实验结果(n=9)
2.9 样品含量测定 取3批HXDTM样品(批号:20120628、20120816、2011012),按“2.2.2”项下方法制备供试品溶液,样品量为10 μL,注入高效液相色谱仪,按上述高效液相色谱条件进样,记录色谱图,按外标法计算HXDTM中丹参素钠和原儿茶醛的含量,结果见表2。
根据上述结果,考虑到每批药材的产地、质量及生产过程中纯化水用量及药材的称量等所带来的误差,暂定本品中每100 mL含丹参素不得少于9.0 mg,含原儿茶醛不得少于1.2 mg。
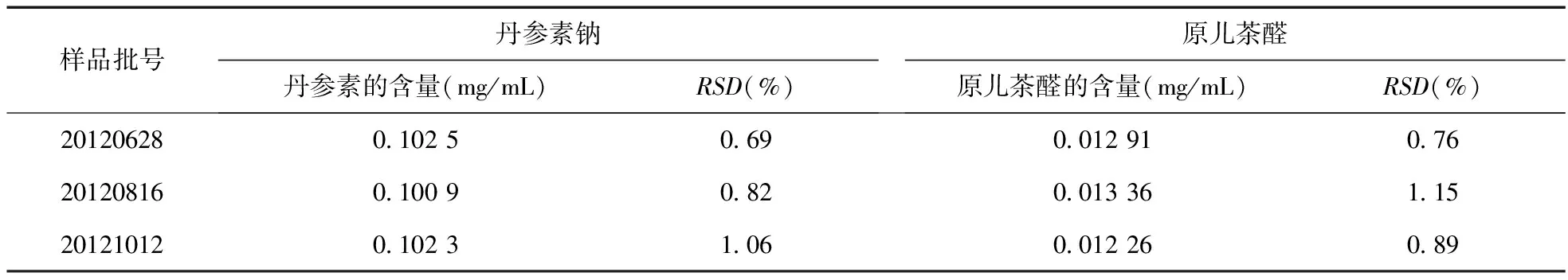
表2 样品测定结果(n=3)
3 讨论
3.1 流动相的选择 丹参的水溶性成分丹参素和原儿茶醛均是酚酸类化合物,极性大,在水溶液中易溶解,与空气接触极易氧化成醌式结构化合物,在偏碱溶液时更易氧化,使溶液呈桔黄色,在中性流动相中存在着离解平衡而使测定的结果偏低且色谱峰易产生拖尾现象,所以,目前在测定上述两种物质时,在流动相中加入适量酸,既抑制其氧化也可抑制其拖尾,乙腈能使色谱峰保持良好的峰形[8-9]。在实验初期,考察甲醇-磷酸水溶液、甲醇-冰醋酸水溶液、甲醇-乙腈-冰醋酸水溶液[10-16]及不同比例等多个流动相系统的效果,均难以获得较好的分离度和峰形,结果选择乙腈-0.5%冰醋酸作为流动相,分离效果较好[17-18]。
3.2 流动相比例的确定 实验中考察了混合对照品标准溶液(“2.3”线性关系考察项下方法制备)在不同比例的乙腈与0.5%冰醋酸的流动相体系下的出峰时间及峰形等的分离效果,在几个不同流动相比例1∶1、1∶2、1∶3、1∶4、1∶5的分离效果中,以乙腈-0.5%冰醋酸为1∶3时分离效果最优,峰形对称,柱效高,保留时间适宜,干扰成分少,丹参素钠、原儿茶醛均可达到基线分离。
3.3 检测波长的选择 实验是在同一色谱系统中对丹参素钠和原儿茶醛同时检测,因此,找到二者共同的最大吸收波长选择尤为重要。实验中将丹参素钠和原儿茶醛对照品溶液分别在200~400 nm波长范围内进行紫外扫描,丹参素钠和原儿茶醛均在280 nm波长处有最大吸收,且吸收良好,利于含量测定,故选用280 nm作为检测波长;流动相比例确定以后,考察了流动相对两种活性成分丹参素钠和原儿茶醛在280 nm吸收的影响,结果影响不明显。
3.4 柱温的确定 柱温对于分离的效能也有影响,合适的柱温能调整保留时间,提高分离度,在拟定的色谱条件下,调整柱温在室温及30、35、40、50 ℃条件下分别进样分析,考察柱温对分离的影响,结果表明:理论塔板数N基本随着温度升高而增大;随着柱温升高,各物质峰的保留时间均逐渐提前,这可能是由于温度升高使化合物在两相之间的分子运动加快引起;分离度R在室温时较差,其余温度下影响不大;不对称性因子S除室温和50 ℃较大外,其他均比较理想,故在30~40℃范围内均为适合的柱温。但考虑到升温导致色谱柱的稳定性差、寿命低,综合考虑选择35 ℃为测定柱温。
3.5 柱长的选择 在相同色谱条件下,色谱柱长短不一样时,柱子越长,保留时间就越长。柱长选用150 mm,丹参素钠的保留时间为5.30 min左右;柱长选用250 mm,其保留时间为8.90 min左右,色谱柱内径小对色谱峰分离效果要好,但测试中产生的压力也高。因此,实验选用柱长以250 mm为好。
3.6 流动相的速度 在相同色谱条件下,只改变流动相的速度,进行实验操作,流动速度增大,保留时间就缩短。实验中通过调整流动相比例与流动速度,使其相匹配,产生的色谱峰分离效果好,色谱峰峰形稳定、对称,测得数据准确可靠,实验中实际选用流动相速度为1.0 mL/min。
HXDTM是由丹参等十多味药材经过水提工艺制得的,丹参是方中主药之一,而水溶性成分丹参素和原儿茶醛是丹参中主要成分,因此,将丹参素和原儿茶醛作为含量考察指标之一,建立了含量测定方法;但中药复方制剂的药效是多种化学成分共同作用的结果,单一一味药中的一种或几种成分含量的高低并不能全面反映中药复方制剂的药效,方中其他有效成分含量测定的实验有待进一步研究。本实验中供试品经简单处理后即可测定,方法简便、快速、重复性好、专属性好,可用于HXDTM的质量控制。
参考文献:
[1] 李全斌,孙芬,何开勇,等.活血定痛合剂的主要药效学研究[J].实用药物与临床,2012,15(7):414-416.
[2] 舒菁菁,李菲,董雅芬,等.丹参素药理作用及机制的研究进展[J].药学实践杂志,2012,30(4):266-269.
[3] 李骅,王四旺,张邦乐,等.丹参素的药理活性与药物动力学研究进展[J].西北药学杂志,2011,26(4):310-312.
[4] 王炜辰,吴学辉,郑芳.丹参药理学研究进展[J].海峡药学,2013,25(10):24-26.
[5] 赵艳威,杨宣,董璨瑾,等.丹参素及原儿茶醛研究进展[J].武警医学院学报,2009,18(3):260-262.
[6] 翟学佳,徐锦凤.高效液相色谱法同时测定丹参药材水溶性和脂溶性成分的含量[J].医药导报,2009,28(10):1345-1348.
[7] 李全斌,李纪元,钱洪波.活血定痛合剂合剂制备及质量控制[J].辽宁中医药大学学报,2012,14(4):226-228.
[8] 李骅,谢艳华,张邦乐,等.RP-HPLC法同时测定双丹口服液中没食子酸、丹参素和原儿茶醛的含量[J].中国医药导报,2012,9(5):117-119.
[9] 赵晶,曹红.HPLC法同时测定川参通注射液中丹参素和原儿茶醛的含量[J].解放军药学学报,2013,29(2):141-143.
[10]张熙洁,王玉,侯林中,等.宽心口服液中丹参素和原儿茶醛的含量测定[J].中国药学杂志,2011,46(19):1530-1531.
[11]刘佩坚,杨辉,苏健芬,等.HPLC法同时测定复方丹参输卵管灌注液中丹参素和原儿茶醛的含量[J].中国药师,2012,15(7):963-965.
[12]屈蓉,仇雅静,陈骁鹏,等.高效液相色谱法测定心可舒片中丹参素钠和原儿茶醛含量[J].中国药业,2012,21(19):23-25.
[13]尹萌,孟月兰,闻刑毓,等.不同厂家香丹注射液中丹参素钠和原儿茶醛含量的比较[J].中国医院用药评价与分析,2010,10(10):903-905.
[14]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2010:906-907.
[15]靖会,杨黎彬,边军昌,等.RP-HPLC法测定丹参不同部位中丹参素和原儿茶醛的含量[J].安徽医药,2011,15(6):691-692.
[16]赵娅柯,张长弓,隆清娥,等.高效液相色谱法测定丹红片中丹参素和原儿茶醛的含量[J].中国药师,2012,15(1):68-69.
[17]傅黎春,李桃英,彭栋梁.HPLC法测定丹枣口服液中丹参素及原儿茶醛的含量[J].中国药师,2009,12(1):72-73.
[18]黄敬群,宋扬.HPLC法同时测定心复康口服液中丹参素和原儿茶醛的含量[J].西北药学杂志,2010,25(4):267-269.

