氧化苦参碱保留灌肠对重症急性胰腺炎的疗效
吴 洁,荣大庆,柳青峰,耿 宣,张志强,董 齐,王燕庆
0 引言
急性胰腺炎(Acute pancreatits,AP)是一种外科常见急腹症。临床分轻、重2型:轻型胰腺炎(Mild acute pancreatitis,MAP)经对症治疗后短期可治愈;重症急性胰腺炎(Severe acute pancreatitis,SAP)常涉及多器官衰竭、败血症,是临床极其棘手的疾病之一。由于急性胰腺炎是一类多阶段进展、多脏器受累的疾病,现在还缺乏预测病情演变的有效临床观察指标,特别是SAP肠黏膜屏障损伤,肠黏膜通透性增强引起的细菌移位是目前尚未解决的难题。
人类胃肠道大约有300~500种细菌生存,上消化道生存的微生物比较少,结肠由于蠕动慢、有浓缩粪便的功能,故结肠内生存的细菌种类较多。重症胰腺炎的继发感染最主要因素是结肠内常驻细菌移位[1],研究提示,细菌可能是跨细胞通过肠屏障到达胰腺周围。统计资料显示,继发感染导致患者死亡占重症胰腺炎总死亡率的80%[2]。近年来国内外研究提示,肠道内细菌移位是引发SAP发生的重要因素[3]。动物模型显示,细菌移位的发生在急性胰腺炎的早期,但细菌移位的途径及发生因素还不清楚。国内多家医院采用大黄或甘露醇灌肠治疗的方法清除大肠内积存腐败物,但这种治疗仅减少大肠中的细菌含量,对细菌移位及肠黏膜屏障的损坏没有起到有效的治疗作用。
肠上皮屏障是肠黏膜屏障最重要的一道屏障。正常情况下肠上皮细胞旁间隙是由蛋白复合体封闭,其主要有跨膜蛋白Occludin、Claudins、连接粘附分子(Junctional adhesion molucule,JAM)和胞质附着蛋白Zos、AF6、7H6等蛋白紧密连接所组成。受细胞因子等调节,ZO-1的N末端可直接与catenin蛋白或E-钙粘连素结合,介导紧密连接的开放和闭合。有研究报道,在肠道感染、炎性肠病时,肠上皮细胞旁通透性增加,紧密连接崩解[4-6],而在众多调节紧密连接的蛋白复合体中,跨膜蛋白Claudin-1最具代表性[7-9]。
氧化苦参碱(Oxymatrine,OM)是一种较强的免疫抑制剂,可抑制多种炎性因子的释放,有明确的抗炎作用。本研究应用OM灌肠治疗SAP,取得了良好的治疗效果。
1 资料与方法
1.1 资料 选择我院2012年1-10月住院确诊的SAP患者30例。入选标准:①符合2007年中华医学会外科学会胰腺学组重症急性胰腺炎诊断标准;②能够耐受灌肠者;③排除其他非本病所致腹膜炎者。氧化苦参碱,批号:960304,宁夏紫荆花药业生产;D-乳酸检测试剂盒,编号:EDLC-100, 测试:100T,购自BioAssay Systems;显色基质鲎试剂盒(含偶氮),货号:CE80545 80T,标准曲线10T+检测35个样品,购自厦门市鲎试剂实验厂有限公司。
1.2 方法
1.2.1 分组 将30例SAP患者随机分成对照组和OM灌肠组,每组15例。两组确诊后,患者先应用温盐水500 mL灌肠清理肠道,每12 h 1次;停止排便后20 min,插入肛管深度约10~15 cm,对照组将100 mL盐水(温度39~41 ℃)低流速灌入大肠内,液面距肛门不超过30 cm,以利于药液的保留,灌毕,嘱患者保留1 h。OM灌肠组,将OM溶液100 mL(OM 200 mg,温度39~41 ℃)低流速灌入大肠内,液面距肛门不超过30 cm,以利于药液的保留,灌毕,嘱患者保留1 h,以利于药液吸收。
1.2.2 检查指标 对照组和OM灌肠组确诊前1 d(D0)及确诊后第1、2、3天(D1、D2、D3)抽取静脉血,采用酶比色法测定血浆D-乳酸浓度,终点显色法检测内毒素浓度(均按试剂盒上的操作说明书进行操作)。
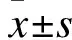
2 结果
血浆内毒素、D-乳酸浓度变化见表1。由表1可见,对照组与OM灌肠组确诊前D0及确诊后D1时,血浆D-乳酸浓度比较差异无统计学意义(P>0.05);D2、D3时,OM灌肠组血浆D-乳酸浓度较对照组显著下降(P<0.01),提示胰腺炎模型早期发生肠黏膜屏障破坏,肠黏膜通透性增加。OM灌肠组与同时间点的对照组进行两两比较,OM干预24 h后,患者血浆D-乳酸含量较同时点的对照组显著下降(见表1、图1),提示OM干预可修复肠黏膜屏障,恢复肠黏膜通透性,降低血浆D-乳酸含量。
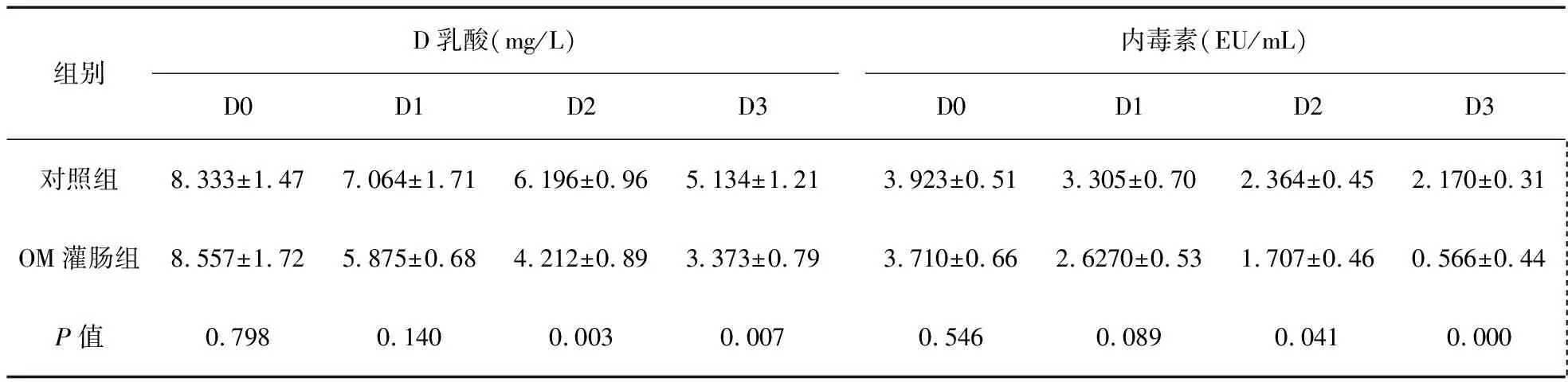
表1 两组血浆内毒素、D-乳酸浓度比较
确诊前D0及确诊后D1时,对照组与OM灌肠组血浆内毒素浓度比较差异无统计学意义(P>0.05);D2、D3时,OM灌肠组血浆内毒素浓度较对照组显著下降(P<0.05),提示胰腺炎早期有细菌移位发生;OM灌肠组与同时间点位的对照组进行两两比较,OM干预24 h后,患者血浆内毒素浓度较同时点的对照组显著下降(见表1、图2),提示OM干预可抑制细菌移位,降低血浆内毒素含量。

图1 血浆D-乳酸变化示意图
注:c.对照组,o.OM灌肠组;与对照组同时刻比较,**P<0.01
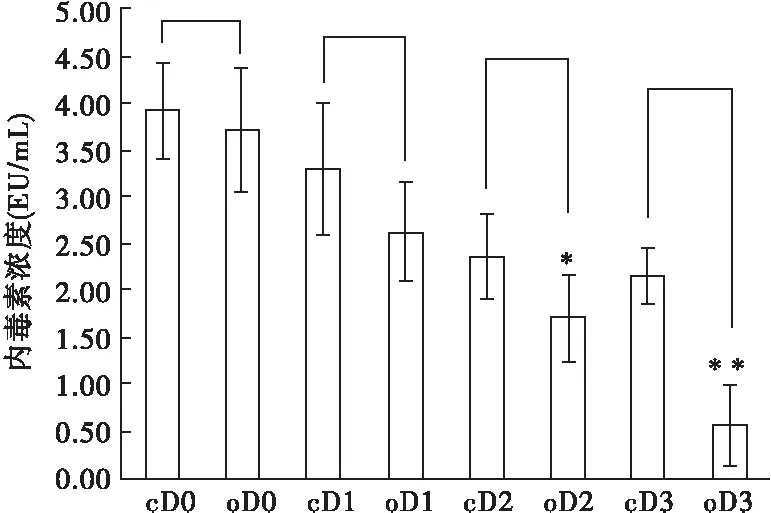
图2 血浆内毒素变化示意图
注:c.对照组,o.OM灌肠组;与对照组同时刻比较*P<0.05,**P<0.01
3 讨论
急性胰腺炎的病理特点为弥漫性或局灶性炎性损害,其发病机制还不完全清楚。早期病变是胰腺腺泡细胞生理特性发生改变,以消化酶活化导致胰腺细胞自行消化、坏死为主要病理改变。如原发诱因没有解除或伴有不同程度的感染,胰腺组织的损伤加重可引发全身多器官衰竭,使患者在短期内死亡。第二死亡高峰是在患病2周后继发胰腺组织感染导致多器官所致。
重症胰腺炎的继发感染最主要因素是结肠内常驻细菌移位,研究提示,细菌可能是跨细胞通过肠屏障到达胰腺周围。统计资料显示,继发感染导致患者死亡占重症胰腺炎总死亡率的50%[2]。研究显示,引起细菌移位是由多途径、多种因子参与的病理损伤过程。早期的研究成果证明内毒素、肿瘤坏死因子起重要作用,虽然目前抗内毒素药物较多,但至今还没有一种能被临床广泛认同的药物。有报道,血小板活化因子是损害肠上皮屏障的最主要靶点,由国际多中心共同进行的血小板活化因子抑制剂-来昔帕泛治疗SAP二期临床试验显示,其在抗器官衰竭及降低死亡率上存在着诸多问题。由此可见,抑制一种因子的活化不能阻止复杂的生物活动[7]。因此,寻找既能抑制发病过程中过度免疫反应,减少粒细胞凝聚,又能阻止引起机体损伤的血小板活化因子、内毒素活化并能阻止肠道屏障开放,同时源于对人体无害的自然植物药,是治疗疾病的最佳选择。
笔者在临床工作中发现,急性胰腺炎发病早期静脉给予抗氧化剂甘露醇,后者通过与羟自由基(OH-)结合,能减轻胰腺炎发病过程中全身中毒症状,与对照组相比,肺部损伤患者的比例明显减低。采用甘露醇清洁消化道,可减轻肠麻痹和减少粪便积存。研究发现,急性胰腺炎病例的细菌感染是影响患者预后的最重要因素。近年来,国内外研究提示,肠道内细菌移位是引发SAP发生的决定因素。动物模型显示,细菌移位发生于急性胰腺炎早期,但细菌移位的途径及发生因素尚不清楚。我院采用大黄或甘露醇灌肠治疗的方法清除大肠内积存腐败物,但这种治疗仅减少大肠中的细菌含量,对肠璧屏障的损坏及细菌移位没有起到治疗作用。
笔者曾通过L-精氨酸制作大鼠SAP动物模型,应用OM腹腔注射及灌肠进行干预,证实了OM通过上调靶向调控蛋白Claudin-1表达促进肠粘膜屏障恢复的作用原理[13-14]。在此研究的基础上,笔者应用OM灌肠治疗SAP,促进了肠粘膜屏障恢复,防止细菌移位,取得了良好的治疗效果。
OM是从我国传统中药苦豆子中提取的一种生物碱,分子式:C15H24N2O2,分子量:264.36,是一种较强的免疫抑制剂,可抑制多种炎性因子的释放,有明确的抗炎作用。虽然氧化苦参碱在临床上已广泛用于抗肿瘤和治疗病毒性肝炎,但其生物学作用机制还需进一步研究。近年研究显示,氧化苦参碱对大鼠肝脏星状细胞旁分泌活化途径也有抑制作用,限制肝血窦细胞旁间隙的通透性[15-17]。笔者曾应用腹腔镜下氧化苦参碱腹腔灌洗对SAP进行治疗,取得了良好的效果[18],但OM对于SAP治疗的最佳方式及作用机理还不清楚。本研究通过对SAP患者早期OM保留灌肠治疗,探讨了OM对SAP治疗的方式及机理。
D-乳酸是细菌发酵的代谢产物,当肠道发生急性损伤时,肠道中细菌产生的大量D-乳酸,通过受损的黏膜入血,使血浆D-乳酸水平升高,可及时反映肠黏膜损害程度和通透性变化[19]。内毒素是存在于革兰阴性细菌细胞壁中的脂多糖,当肠屏障功能障碍时,内毒素穿过肠黏膜,进入血循环,形成内毒素血症,并成为了解患者肠屏障功能、细菌移位发生的重要手段。
本试验通过对患者血浆内毒素、D-乳酸的监测,观察肠黏膜通透性变化、损害程度和细菌移位发生情况。通过对血浆内毒素、D-乳酸的监测发现,对照组与OM灌肠组确诊前D0及确诊后D1时,血浆内毒素、D-乳酸浓度对比差异无统计学意义(P>0.05);对照组与OM灌肠组确诊前D0及确诊后D1时,血浆内毒素、D-乳酸含量远高于正常值,提示胰腺炎患者早期便存在肠黏膜通透性增加,肠黏膜屏障破坏,细菌移位;OM灌肠组与同时间点位的对照组进行两两比较,OM灌肠治疗24 h后,血浆内毒素、D-乳酸含量较同时点的对照组显著下降(P<0.05),提示OM灌肠治疗可恢复肠黏膜通透性,防止细菌移位,修复肠黏膜屏障,从而降低血浆内毒素、D-乳酸含量。
综上所述,氧化苦参碱灌肠治疗SAP,不但能减少肠内细菌含量,还能对肠黏膜屏障的损伤及细菌移位起到治疗作用,值得临床应用。本研究以临床成功治疗结果为依据,利用分子生物学实验方法解析其作用机制,具有较强的理论价值和临床应用价值,并为治疗细菌移位药物提供实验室数据和理论依据。
参考文献:
[1] Morrow LE,Gogineni V,Malesker MA.Synbiotics and probiotics in the critically ill after the PROPATRIA trial[J].Curr Opin Clin Nutr Metab Care,2012,15(2):147-150.
[2] 吕建芳,范恒,沈霖,等.氧化苦参碱对实验性结肠炎大鼠肠黏膜细胞因子和核因子-κB p65表达的影响[J].世界华人消化杂志,2008,16(20):2289-2294.
[3] Zhang J,Yuan C,Hua G,et al.Early gut barrier dysfunction in patients with severe acute pancreatitis:attenuated by continuous blood purification treatment[J].Int J Artif Organs,2010,33(10):706-715.
[4] Rees LE,Cogan TA,Dodson AL,et al.Campylobacter and IFNgamma interact to cause a rapid loss of epithelial barrier integrity[J].Inflamm Bowel Dis,2008,14(3):303-309.
[5] Sakorafas GH,Lappas C,Mastoraki A,et al.Current trends in the management of infected necrotizing pancreatitis[J].Infect Disord Drug Targets,2010,10(1):9-14.
[6] Al Mofleh IA.Severe acute pancreatitis:pathogenetic aspects and prognostic factors[J].World J Gastroenterol,2008,14(5):675-684.
[7] Bücker R,Troeger H,Kleer J,et al.Arcobacter butzleri induces barrier dysfunction in intestinal HT-29/B6 cells[J].J Infect Dis,2009,200(5):756-764.
[8] Li Q,Zhang Q,Wang C,et al.Disruption of tight junctions during polymicrobial sepsis in vivo[J].J Pathol,2009,218(2):210-221.
[9] 马佩炯,陈健林,郑小青.前列地尔联合清胰汤治疗急性胰腺炎并局限性腹膜炎的价值[J].中国医师杂志,2013,15(8):1125-1127.
[10]陈玉梅,冯志杰.急性胰腺炎肠道功能障碍的发病机制与治疗[J].世界华人消化杂志,2009,17(16):1643-1648.
[11]Qin H,Zhang Z,Hang X,et al.plantarum prevents enteroinvasive Escherichia coli-induced tight junction proteins changes in intestinal epithelial cells[J].BMC Microbiol,2009,31(9):63.
[12]Severson EA,Kwon M,Hilgarth RS,et al.Glycogen Synthase Kinase 3(GSK-3)influences epithelial barrier function by regulating occludin,claudin-1 and E-cadherin expression[J].Biochem Biophys Res Commun,2010,397(3):592-597.
[13]Zhang Z,Wang Y,Dong M,et al.Oxymatrine ameliorates l-arginine-induced acute pancreatitis in rats[J].Inflammation,2012,35(2):605-613.
[14]张志强,王燕庆,董明,等.氧化苦参碱诱导跨膜蛋白Claudin-1表达在重症急性胰腺炎大鼠肠黏膜损害中的作用[J].世界华人消化杂志,2011,19(5):510-514.
[15]Liu Y,Zhang XJ,Yang CH,et al.Oxymatrine protects rat brains against permanent focal ischemia and downregulates NF-kappaB expression[J].Brain Res,2009,1268:174-180.
[16]刘浩,仇毓东,毛谅,等.苦参碱对大鼠小体积肝移植缺血再灌注损伤的保护作用[J].世界华人消化杂志,2008,16(15):1617-1621.
[17]李晓红,张铁民.氧化苦参碱抑制MKN-45细胞迁移及其机制的研究[J].实用医学杂志,2013,29(1):28-30.
[18]吴杰,荣大庆,柳青峰,等.腹腔镜下氧化苦参碱腹腔灌洗对重症急性胰腺炎肠粘膜屏障损伤的作用[J].腹腔镜外科杂志,2013,18(6):21-24.
[19]Li Y,Chen Y,Zhang J,et al.Protective effect of glutamine-enriched early enteral nutrition on intestinal mucosal barrier injury after liver transplantation in rats[J].Am J Surg,2010,199(1):35-42.

