尾加压素Ⅱ通过ERK1/2途径诱导大鼠肺动脉平滑肌细胞增殖和上调Egr-1表达*
孟庆红, 蔡直峰, 赵翠芬△, 李福海, 孔清玉, 夏 伟, 李 栋
(1山东大学齐鲁医院儿科,山东 济南 250012; 2潍坊市人民医院新生儿科,山东 潍坊 261041;3山东大学齐鲁医院低温医学研究室,山东 济南 250012)
肺血管重构是肺动脉高压发展为不可逆的标志,随着肺动脉压力的升高,患者逐渐发生难以纠正的右心衰竭和肺血管病变,甚至导致死亡[1]。肺血管重构以肺动脉平滑肌细胞增殖和迁移为核心环节,最终导致肺血管狭窄和闭塞[2]。尾加压素Ⅱ(urotensin Ⅱ,UⅡ)是近年发现的具有强效血管收缩效应的生长抑素样环肽[3]。体内一种孤立的G蛋白偶联受体GPR14是UⅡ的特异性受体,后来被命名为UT[4]。UⅡ及其受体UT在心血管系统中广泛分布,参与多种心血管疾病包括肺动脉高压和肺血管重构的发病过程[5]。Urantide是迄今发现的最为强效的UⅡ受体拮抗剂,能够有效抑制UⅡ的促主动脉平滑肌细胞增殖作用[6]。早期生长反应因子1(early growth response factor-1, Egr-1)是参与肺动脉高压形成的重要调节因子[7-8]。研究证实Egr-1参与慢性缺氧性肺血管重构过程[9]。高血流性肺动脉高压大鼠肺血管组织中Egr-1 mRNA 表达明显增加[10]。据此我们推测UⅡ与Egr-1之间存在着一定的联系。本研究探讨UⅡ诱导的培养大鼠肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)增殖的信号转导机制,并探讨Egr-1是否参与了UⅡ诱导的PASMCs增殖过程。
材 料 和 方 法
1 动物
100~150 g健康雄性Wistar大鼠(购自山东大学医学院实验动物中心)。
2 主要试剂
UⅡ、urantide和PD98059(Sigma);RPMI-1640(HyClone);兔抗α-actin单克隆抗体、辣根酶标记山羊抗兔IgG、兔抗GAPDH 单克隆抗体(Sigma);FITC标记山羊抗兔IgG(中杉金桥);兔抗磷酸化细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2, ERK1/2 )、应激活化蛋白激酶(stress-activated protein kinase, SAPK)、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38 MAPK)多克隆抗体(Biosysthesis);兔抗Egr-1多克隆抗体(Sigma);Trizol提取液、PCR引物及实时荧光定量PCR试剂盒(TaKaRa);SDS-PAGE凝胶配制试剂盒(杭州碧云天公司);HRP显色试剂(Millipore)。实验用仪器、设备及其它试剂均有山东大学齐鲁医院低温医学研究室提供。
3 主要方法
3.1大鼠PASMCs的培养及免疫荧光鉴定 取100~150 g Wistar大鼠,2%戊巴比妥钠(40 mg/kg)麻醉处死后,迅速于无菌条件下取心肺组织。显微器械小心分离出肺动脉血管壁中膜并剪成约1 mm×1 mm×1 mm大小碎块,置于25 cm2培养瓶内,倒置放于培养箱内,待组织块干涸(约1~1.5 h),加入含15%胎牛血清的RPMI-1640培养液,于37 ℃、5% CO2培养箱内培养。当原代细胞融合至80%后即传代。经形态学及兔抗α-肌动蛋白(α-actin)抗体免疫荧光检测证实为平滑肌细胞,且细胞纯度达89%以上。实验采用3~6代细胞。
3.2BrdU掺入实验 取3~6代细胞,酸处理盖玻片放入6孔板内做细胞爬片,分为(1 μmol/L、0.1 μmol/L 和0.01 μmol/L)UⅡ组、1 μmol/L UⅡ+1 μmol/L urantide组和不给予刺激组,分别作用24 h,固定前3 h掺入BrdU,终浓度为30 μg/L,每组做2张爬片,兔抗BrdU 4 ℃过夜,FITC标记山羊抗兔IgG (1∶100)孵育30 min,DAPI染核,封片。每张爬片在荧光显微镜下(×400)随机取5个视野,计数视野中细胞总数及BrdU阳性细胞数目,计算标记指数(labeling index)=BrdU阳性细胞数/细胞总数。
3.3Real-time PCR 各组细胞经处理,作用24 h后参照Trizol试剂盒使用说明提取总RNA,去除基因组DNA,参照TaKaRa公司的逆转录试剂盒说明书将总RNA逆转录为cDNA。按照Albertin real-time PCR方法将cDNA置于ABI 7500 real-time PCR反应系统中进行PCR反应。以GAPDH为内参照,计算ERK1/2、SAPK、p38 MAPK及Egr-1 mRNA表达量。ERK1/2上游引物: 5′-CCCAGGGGAACTGCTGGG-3′ (18 bp),下游引物: 5′-GTCAAGAGCTTTGGAGTC-3′ (18 bp); SAPK上游引物: 5′-ATGAGCCTCATTCGGAAA-3′ (18 bp), 下游引物: 5′-TTCACGGCCAGGTTGCCT-3′ (18 bp); p38 MAPK上游引物: 5′-AACAAGACCGTCTGGGAGGTGC-3′ (22 bp), 下游引物: 5′-TTGGCGTGAATGATGGACTGAAA-3 ′(23 bp); Egr-1上游引物: 5′-ACGGGGCTCCCCAGTTTCCTC-3′ (21 bp), 下游引物: 5′-GGGTTGTTCGCTCGGCTCCC-3′(20 bp); GAPDH上游引物: 5′-GCTCTCTGCTCCTC CCTGTTCT-3′ (22 bp), 下游引物: 5′-CAGGCGTCCGATACGGCCAAA-3′ (21 bp)。
3.4Western blotting分析 各组细胞经处理,作用24 h后检测磷酸化ERK1/2 (p-ERK1/2)、p-SAPK和p-p38 MAPK蛋白表达,常规裂解细胞提取细胞总蛋白,加入上样缓冲液后煮沸5~10 min使蛋白变性,经SDS-PAGE分离,再电转至PVDF膜,封闭后分别加入兔抗GAPDH(1∶200)、p-ERK1/2(1∶200)、p-SAPK(1∶300)、p-P38MAPK(1∶300)和Egr-1(1∶500)多克隆抗体, 4 ℃摇床孵育过夜,与辣根过氧化物酶标记山羊抗兔IgG(1∶10 000)室温孵育1 h,再与电致化学发光液ECL温育1 min后曝光,显影和定影。最后对结果进行吸光度扫描分析。
4 统计学处理
采用SPSS 17.0软件进行统计分析,实验数据均以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(ANOVA),以P<0.05为差异有统计学意义。
结 果
1 培养大鼠PASMCs鉴定
培养3~5 d,原代PASMCs在倒置相差显微镜下可以看到有的组织块周围出现以“铺路石”样形状的细胞爬出,逐渐长出长梭形细胞,2周左右长满瓶底的80%左右,传代至3代以后的细胞生长到一定密度后可见典型的“峰-谷”样生长方式。用兔抗血管平滑肌细胞单克隆抗体(α-actin抗体)及FITC标记山羊抗兔抗体鉴定为平滑肌细胞,见图1。

Figure 1. Identification of rat PASMCs by immunofluorescence(×200).
2 UⅡ对培养大鼠PASMCs 增殖的影响
BrdU掺入实验结果显示UⅡ(1 μmol/L、0.1 μmol/L和0.01 μmol/L)呈浓度依赖性地促进PASMCs增殖(P<0.05或P<0.01);urantide可抑制UⅡ促PASMCs增殖作用(P<0.05),见图2。这提示UⅡ通过与特异性受体UT结合刺激PASMCs增殖。
3 不同浓度UⅡ、urantide及PD98059对大鼠PASMCs ERK1/2、SAPK、p38 MAPK和Egr-1 mRNA表达的影响
Real-time PCR结果显示:UⅡ(1 μmol/L、0.1 μmol/L和0.01 μmol/L)呈浓度依赖性地上调ERK1/2、SAPK和Egr-1 mRNA表达(P<0.01或P<0.05),p38 MAPK mRNA表达无明显变化;urantide和PD98059均可拮抗UⅡ上调ERK1/2、SAPK及Egr-1 mRNA表达的作用(P<0.01或P<0.05),见图3。
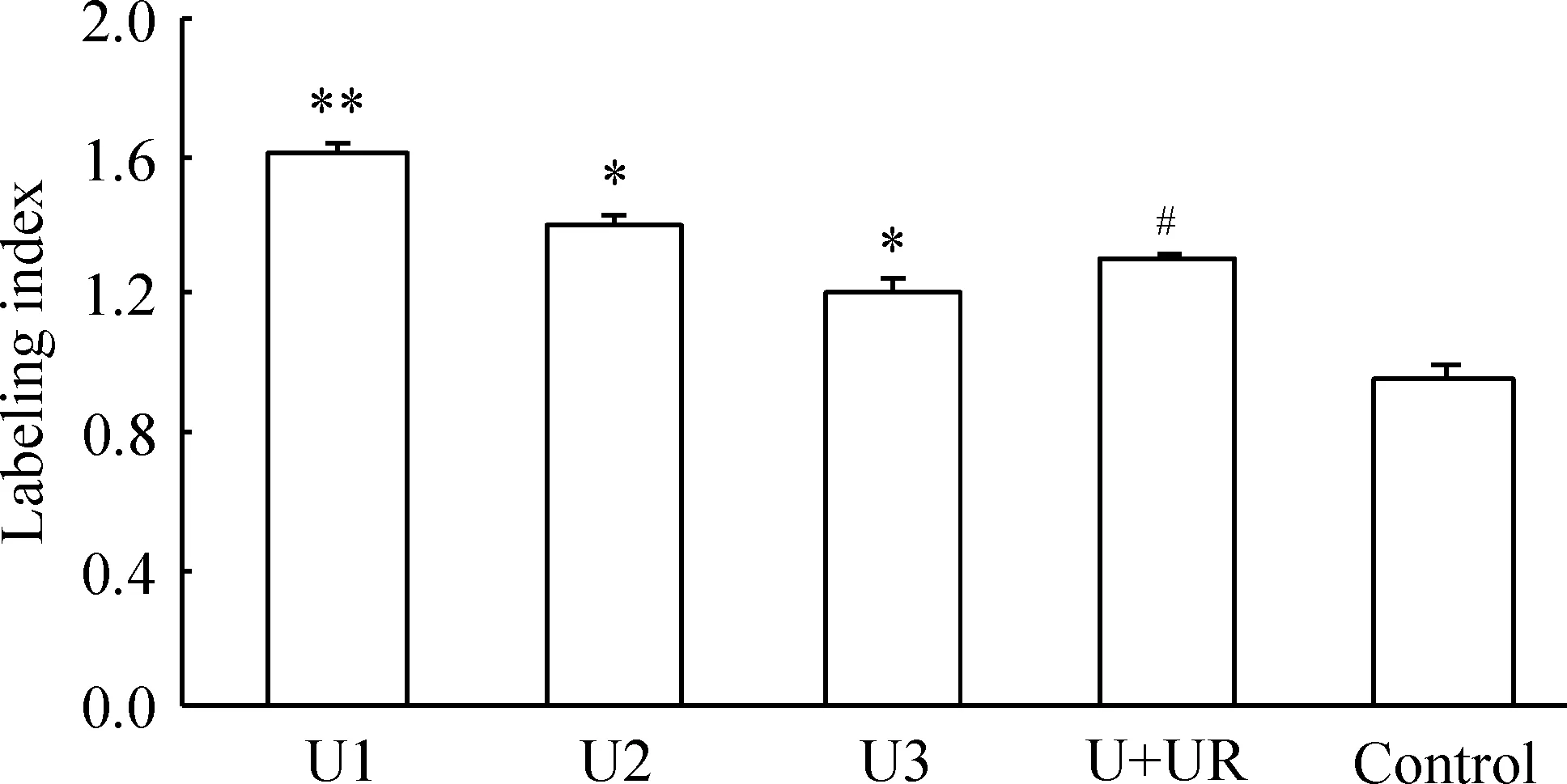
Figure 2. Effect of different concentrations of UⅡand urantide on the proliferation of cultured PASMCs detected by BrdU incorporation.U1: 1 μmol/L UII; U2: 0.1 μmol/L UII; U3: 0.01 μmol/L UII; U+UR: 1 μmol/L UII+1 μmol/L urantide. Mean±SD. n=6. *P<0.05, **P<0.01 vs control; #P<0.05 vs U1.

Figure 3. Effect of different concentrations of UⅡand urantide on the expression of ERK1/2, SAPK, p38 MAPK and Egr-1 mRNA in cultured PASMCs detected by real-time PCR.U1: 1 μmol/L UII; U2: 0.1 μmol/L UII; U3: 0.01 μmol/L UII; U+UR: 1 μmol/L UII+1 μmol/L urantide; U+PD: 1 μmol/L UII+10 μmol/L PD98059. Mean±SD. n=6. *P<0.05, **P<0.01 vs control; #P<0.05, ##P<0.01 vs U1.
4 不同浓度UⅡ及urantide及PD98059对大鼠PASMCs p-ERK1/2、p-SAPK、p-p38 MAPK和Egr-1蛋白表达的影响
Western blotting分析显示:UⅡ (0.01、0.1和1 μmol/L)呈浓度依赖性地增加p-ERK1/2、p-SAPK和Egr-1蛋白表达(P<0.05),p-p38 MAPK蛋白表达无明显变化;urantide和PD98059可拮抗UⅡ上调p-ERK1/2、p-SAPK及Egr-1表达的作用,见图4。

Figure 4. Effect of different concentrations of UⅡand urantide on the protein expression of p-ERK1/2, p-SAPK, p-p38 MAPK and Egr-1 in PASMCs detected by Wes-tern blotting. U1: 1 μmol/L UII; U2: 0.1 μmol/L UII; U3: 0.01 μmol/L UII; U+UR: 1 μmol/L UII+1 μmol/L urantide; U+PD: 1 μmol/L UII+10 μmol/L PD98059. Mean±SD. n=6.*P<0.05, **P<0.01 vs control; #P<0.05, ##P<0.01 vs U1.
讨 论
本研究发现UⅡ浓度依赖性地促进肺动脉平滑肌细胞增殖,UⅡ受体拮抗剂urantide可拮抗UⅡ的促PASMCs增殖作用。推测不同浓度UⅡ首先与其特异性受体结合,促使PASMCs增殖。血管平滑肌细胞是血管中膜的主要组成成分,在炎症及机械损伤的作用下,血管平滑肌细胞由正常的收缩表型向分泌型转化,促使血管平滑肌细胞分泌多种血管活性肽,导致多种心血管疾病的发生。UⅡ是近年来发现的重要的心血管调节活性肽,UⅡ及其特异性受体UT发生特异性结合后,可发挥广泛的生物学作用,如收缩血管使血压升高、促进细胞增殖及一些内分泌效应等[11]。研究发现,在大鼠肺动脉高压病理模型中,肺中、小动脉UⅡ蛋白及其受体UT表达增加[12], 提示UⅡ参与肺动脉高压和肺血管重构的形成。
本研究还发现UⅡ可浓度依赖性地上调丝裂原活化蛋白激酶家族中ERK1/2、SAPK和Egr-1的基因及蛋白表达,同时ERK1/2选择性抑制剂PD98059和UⅡ特异性受体拮抗剂Urantide可拮抗UⅡ的上调作用,而p38 MAPK mRNA及蛋白表达不被PD98059和urantide所拮抗。推测UⅡ通过激活ERK1/2和Egr-1 mRNA及蛋白表达,促使PASMCs有丝分裂增加,导致肺动脉平滑肌细胞增殖,urantide通过受体途径拮抗UⅡ的促增殖作用。 但在UⅡ诱导细胞增殖过程中,ERK1/2和SAPK作用的重要性及两者之间的关系如何,本实验未进行相关研究。
丝裂原活化蛋白激酶通路为多种细胞外信号从细胞表面受体传向细胞内的重要信号转导通路。已被完全证实的传导通路有3条: ERK1/2、SAPK和p38 MAPK。ERK1/2和SAPK均与细胞增殖与分化反应有关,分别通过激活受体酪氨酸激酶和G蛋白途径,相继MAPK激酶激活,后者激活转录因子、刺激与细胞增殖有关的基因转录,促进细胞的生长、分化与增殖[13]。研究已证实MAPK在VSMCs增殖、分化、凋亡、细胞骨架等重构及细胞周期中起着非常重要的作用[14]。本研究结果显示ERK1/2及SAPK信号通路在尾加压素Ⅱ诱导PASMCs增殖中均被激活。
此外,本研究发现UⅡ浓度依赖性地促进Egr-1 mRNA的表达,同时其促进作用可被PD98059和urantide拮抗,证实Egr-1参与了尾加压素Ⅱ诱导EEK1/2表达,但Egr-1在三者间发挥作用的具体机制尚不明确,这也是本课题下一步的研究目标。目前已明确锌指转录因子Egr-1参与多种细胞可诱导基因的表达,慢性缺氧小鼠肺血管组织中Egr-1表达增加,并具有缺氧时间和氧气浓度依赖性[15]。肺血管系统中有2种基因受Egr-1调控:组织因子和ERK1/2,同时ERK1/2可反向诱导Egr-1的表达[16]。研究发现,慢性缺氧性肺动脉高压小牛,肺组织活性氧产生增加,从而导致Egr-1 mRNA表达增加,后者通过诱导ERK1/2通路而最终导致小牛肺血管重构[17]。
综上所述,一定浓度范围内的UⅡ通过与其特异性受体UT结合,激活ERK1/2信号途径,进一步诱导Egr-1表达,导致肺动脉平滑肌细胞增殖。
[参 考 文 献]
[1] Rabinovitch M.Molecular pathogenesis of pulmonary arterial hypertension[J]. Clin Invest, 2008, 118(7):2372-2379.
[2] Saji T. Update on pediatric pulmonary arterial hypertension[J]. Circ, 2013, 77(11): 2639-2650.
[3] Dai HY, He T, Li XL, et al. Urotensin-2 promotes collagen synthesis via ERK1/2-dependent and ERK1/2-independent TGF-β1in neonatal cardiac fibroblasts[J]. Cell Biol Int, 2011, 35(2): 93-98.
[4] Liu Q, Pong SS, Zeng Z, et al. Identification of urotensin Ⅱ as the endogenous ligand for the orphan G-protein-coupled receptor GPR14[J]. Biochem Biophys Res Commun, 1999, 266(1):174-178.
[5] Watanabe T, Arita S, Shiraishi Y, et al . Human urotensin Ⅱ promotes hypertension and atherosclerotic cardiovascular diseases[J]. Curr Med Chem, 2009, 16(5):550-563.
[6] McDonald J, Batuwangala M, Lambert DG. Role of urotensin Ⅱ and its receptor in health and disease[J].J Anesth, 2007, 21(3):378-379.
[7] Pagel JI, Deindl E. Disease progression mediated by Egr-1 associated signaling in response to oxidative stress[J]. Int J Mol Sci, 2012, 13(10):13104-13117.
[8] Pagel JI, Ziegelhoeffer T, Heil M,et al. Role of early growth response 1 in arteriogenesis: impact on vascular cell proliferation and leukocyte recruitmentinvivo[J]. Thromb Haemost, 2012, 107(3):562-574.
[9] Nozik-Grayck E, Suliman HB, Majka S, et al. Lung EC-SOD overexpression attenuates hypoxic induction of Egr-1 and chronic hypoxic pulmonary vascular remodeling[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 295(3):L422-L430.
[10]Dickinson MG, Bartelds B, Molema G, et al. Egr-1 expression during neointimal development in flow-associated pulmonary hypertension[J]. Am J Pathol, 2011, 179(5):2199-2209.
[11]Albertin G, Guidolin D, Sorato E, et al. Urotensin-Ⅱ-stimulated expression of pro-angiogenic factors in human vascular endothelial cells[J]. Regul Pept, 2011, 172(1-3):16-22.
[12]彭公永, 何志义, 刘启才, 等. 尾加压素Ⅱ促兔肺动脉平滑肌细胞增殖及机理探讨[J]. 中国病理生理杂志, 2004, 20(9):1597-1600.
[13]Chen CA, Chen TS, Chen HC. Extracellular signal-regulated kinase plays a proapoptotic role in podocytes after reactive oxygen species treatment and inhibition of integrin-extracellular matrix interaction[J]. Exp Biol Med, 2012, 237(7):777-783.
[14]Jiang J, Wang S, Wang Z, et al. The role of ERK1/2 in 15-HETE-inhibited apoptosis in pulmonary arterial smooth muscle cells[J]. Recept Signal Transduct Res, 2011,31(5):45-52.
[15]Zhang J, Guo C, Wang R, et al. An Egr-1-specific DNAzyme regulates Egr-1 and proliferating cell nuclear antigen expression in rat vascular smooth muscle cells[J]. Exp Ther Med, 2013, 5(5):1371-1374.
[16]Aggeli IK, Beis I, Gaitanaki C. ERKs and JNKs mediate hydrogen peroxide-induced Egr-1 expression and nuclear accumulation in H9c2 cells[J]. Physiol Res, 2009, 59(3):443-454.
[17]Hartney T, Birari R, Venkataraman S, et al. Xanthine oxidase-derived ROS upregulate Egr-1 via ERK1/2 in pulmonary arterial smooth muscle cells; model to test impact of extracellular ROS in chronic hypoxia[J]. PLoS One, 2011, 6(11):e27531.

