心包腔注入炎性渗出液诱导大鼠三叉神经脊束核神经元c-Fos表达*
王海华, 姜玉新, 王 静, 周萍萍, 包鹏举, 曾 瑾, 王海珍
(皖南医学院生理教研室,安徽 芜湖 241002)
冠心病、心肌缺血和心肌梗死是临床上的常见病多发病[1],出现典型的心绞痛症状,是由于多种化学和物理因素改变了心脏微环境所产生的一系列复杂的病理生理过程[2-6]。诱发心绞痛的信号通过心脏感觉传入神经纤维(包括心交感和心迷走纤维)传至中枢神经系统,进而引起或整合多种心血管反射[3-4, 7]。通过向心包腔注入炎性渗出液和/或暂时结扎冠状动脉前降支是复制心绞痛动物模型的常用方法[8],由于多种化学和物理因素改变了缺血期间心脏微环境,使心肌细胞外液一些物质的浓度升高,包括缓激肽、P物质、前列腺素、白三烯、乳酸、钾和腺苷[6],而这些物质激活了心脏的感觉传入神经元[3, 6, 8-15],其中包括脊髓T1~6和/或C1~3神经元的激活[2, 13, 16-17]。
通常情况下,典型的心肌缺血心绞痛患者常出现左前胸壁疼痛,并放射到左臂、颈部和下颚[18],心肌缺血激活心脏的感觉传入神经元兴奋投射至上颈髓和/或胸髓以及脊髓丘脑束神经元[19-21]。然而,最新研究表明,有相当一部分心肌缺血患者,在心肌缺血期间无上述典型症状,而颅面部疼痛是其唯一的症状[22],常导致误诊而延误治疗[23-26]。虽然心源性颅面部疼痛内在的神经机制尚不明晰,但依然可作为临床上的辅助诊断措施[27],研究报道迷走神经在介导颅面部疼痛中可能发挥一定作用[3, 28-29]。
颅面部组织受三叉神经分支的专一支配,颅面部感觉传入信息(包括伤害性传入信息)经过初级传入纤维到达三叉神经脊束核,再传入中枢脑干[30-31]。在此期间,有害的信息经初级传入纤维激活位于三叉脑干感觉核复合体二级神经元,其中包括三叉神经脊束核尾部、极间部和口部神经元,它们在颅面部有害的信息传输过程中起着重要作用[31]。许多研究表明,用有害的电和化学刺激心脏左侧迷走神经分支,可以激活位于三叉神经丘脑束水平的左侧脊髓丘脑束神经元[2, 32]。我们由此提出假设,心源性颅面部疼痛可能涉及到脊髓颈段及三叉脑干感觉核复合体神经元的激活,三叉神经脊束核神经元的活化尤为关键。
c-Fos是即刻早基因中的一种,正常情况下,c-Fos在多数神经元中有低水平表达,细胞内c-Fos蛋白很少,不易检测到,但在接受刺激后表达水平可以迅速而短暂提高, 根据c-Fos可以被刺激诱导快速短暂表达的特性, 其产物c-Fos蛋白可作为中枢神经元兴奋活化的标志[33],鉴于此,本实验通过从大鼠心包腔注入炎性渗出液复制心肌缺血心绞痛大鼠模型,运用免疫组化方法,以神经元活化为线索,观察大鼠脊髓和脑干神经元c-Fos表达,特别关注大鼠脑干三叉神经感觉核复合体神经元c-Fos的表达,进而为临床上部分心肌缺血患者颅面部疼痛是其唯一症状提供了实验依据。
材 料 和 方 法
1 实验动物
Wistar雄性大鼠(300~350 g)购于美国德克萨斯州,动物分笼喂养,以锯末为垫料,每笼3~4只,大鼠自由摄食和饮水,实验室配置,12/12 h(8:00~20:00)的光-暗循环周期,温度和湿度分别保持在(23±0.5)℃和60%。实验程序符合昭和大学动物研究伦理委员会标准,并遵照国际疼痛研究协会的指导守则进行[34]。
2 动物模型制备
2.1动物手术准备 大鼠用氨基甲酸乙酯(1.5 g/kg, ip)麻醉后,仰卧固定于鼠台上,通过气管插管,连接动物呼吸机维持正常通气(呼气末CO2浓度维持在3.5%~4.5%之间),同时分离右侧颈静脉,行颈静脉插管,在实验过程中,从颈静脉不定时地补充注入氨基甲酸乙酯(30 mg/kg, ip)对大鼠进行维持麻醉,体温保持在37 ℃。行大鼠左股动脉插管,由压力换能器经Spike2(CED)记录大鼠动脉血压(blood pressure,BP),同时记录心电图以观察大鼠心率(heare rate,HR)的变化。
2.2心包腔内注射炎性渗出液(inflammatory exudate solution, IES) 在文献[6]报道方法的基础上稍做修改,简言之,血压测量和气管插管手术后,实施心包内注射炎性渗出液(IES组,n=4)大鼠,通过胸骨中线左侧肋骨第2~3肋间隙开胸,露出胸腺,在靠近心底部分离胸腺一定长度找到一开口,经该处插入一小段硅胶管进入心包腔,由1 mL注射器向硅胶管内注入0.2~0.5 mL 37 ℃生理盐水,在注药的间期缓慢注入0.2 mL生理盐水冲洗心包腔。在输注IES期间,通过导管注入0.2 mL的IES,时间超过20~30 s,使其与心脏的表面接触约2 min,然后将其缓缓地抽出(20~30 s),然后改换成0.2 mL 37 ℃生理盐水注入到心包腔,使其与心脏的表面接触约2 min,然后将其缓缓地抽出(20~30 s);每12 min时间内重复上面操作3次,然后休息10 min后;在超过1 h期间,重复上面的操作步骤3次。IES包括腺苷(10-3mol/L),缓激肽(10-5mol/L)、前列腺素E2(10-5mol/L)、5-羟色胺(10-5mol/L)和血清素(10-5mol/L)。生理盐水组大鼠(saline组,n=4),在超过1 h期间,向大鼠心包腔注入生理盐水而不是IES,操作程序同IES组。假手术组(sham组,n=4)中的大鼠外科手术同上,但不进行心包注射程序。在完成上面的程序后,让大鼠休息90 min,然后通过导管向心包腔内注入少量(0.2 mL)伊韦氏蓝染料,以验证该导管是插到心包腔而没有出现IES的漏出。
为了进一步阐明IES激活的信号通路,我们还增加了2只大鼠,事先给予纳洛酮(一种阿片受体拮抗剂,1 mg/kg, ip)和育亨宾(一种α2肾上腺素受体拮抗剂,3 mg/kg, ip)20 min,然后再进行大鼠心包腔注入IES程序。
3 免疫组化实验
在实验程序结束,给予大鼠大剂量的氨基甲酸乙酯(600 g/L),然后用4 ℃ 的PBS 500 mL从大鼠心尖部对心脏灌流,从右心耳流出,接着用4 ℃ 的4%多聚甲醛对心脏灌流,然后将大鼠埋入冰块中1 h,后手术取出大鼠颈段脊髓和脑干,放置于4 ℃含4%多聚甲醛的磷酸缓冲液中(pH 7.4)冷冻固定3~7 d,后改放入在4 ℃含30%蔗糖的磷酸缓冲液中3~7 d。在-20 ℃的超速冷冻切片机中将其连续横向切割成50 μm的薄片,并立即转移到含有4 ℃ PBS的聚丙烯盒保存。第2天,对上面薄片用4 ℃PBS冲洗10min ,重复3次,然后将切片放入含3%的H2O2PBS液中孵育30 min以消除内源性过氧化物酶,再将薄片用4 ℃ PBS冲洗10 min ,重复3次,然后在含有3%山羊血清(Vector Laboratories)的封闭溶液中孵育30 min,再将薄片与抗兔c-Fos抗体(1∶5 000,Santa Cruz)放置在4 ℃环境下孵育过夜。在完成此次孵育后,将切片在4 ℃ PBS冲洗10 min,重复3次,并在室温下用生物素化羊抗兔IgG(1∶1000,Dako)孵育120 min,接着再与过氧化物酶偶联的链亲和素(1∶1000,Dako)中孵育60 min。所有的抗体均用含有1%山羊血清和0.5%的Triton X-100的PBS稀释。使用3’,3’-二氨基联苯胺四盐酸盐(DAB,Sigma)进行过氧化物酶反应,并用硫酸镍铵增强。将切片固定在载玻片上,风干过夜,在盖上盖玻片之前用中性红复染,通过倒置显微镜对每只大鼠110张连续切片(从对耳线到前囟即9.16~14.66 mm)中c-Fos蛋白标记细胞进行观察,包括三叉脑干感觉核复合体(VBSNC),观察的同时使用相机拍照制图。
VBSNC分为三叉神经感觉主核腹外侧部分(Pr5VL)以及三叉神经脊束核口部(Sp5O)、极间部(Sp5I)和尾部(Sp5C)。它们的命名和核区域的定义基于Paxinos and Watson(1986)的图谱。通过对3张切片中进行计数取均值确定每只大鼠各神经核团中c-Fos阳性神经元的数目。
4 统计学处理
数据均使用SPSS 16.0统计软件处理。所有数据用均数±标准差(mean±SD)表示,用Student配对t检验作为组内治疗前后进行比较的方法。多组均数比较使用单因素方差分析(One-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 实验期间大鼠心功能变化情况
实验期间大鼠心功能组间变化情况见表1。在整个实验过程中,sham组大鼠平均动脉压(mean arterial blood pressure,MAP)及HR无明显变化(P>0.05);saline 组,在向大鼠心包反复注入或抽出saline过程中,与静息水平相比,大鼠MAP及HR也无明显变化;IES组,在向大鼠心包反复注入或抽出IES过程中,与静息水平相比,HR无显著改变, MAP有明显下降(P<0.05),但在恢复过程中又回升到静息水平,说明向心包腔反复注入或抽出saline或IES大鼠心功能没有显著影响。

表1 心包腔内注入IES期间心血管功能变化
2 脊髓C2节段c-Fos表达
如图1所示,在sham 组,C2脊髓节段被检测到几个c-Fos阳性神经元出现,c-Fos阳性神经元在C2脊髓节段左、右侧分布无明显差异(P>0.05)。而saline 组大鼠C2脊髓节段c-Fos阳性神经元数量比静息水平有所增加,但差异无统计学意义(P>0.05)。然而,同sham 组和saline 组大鼠相比,IES组大鼠C2段脊髓背角I-V层c-Fos阳性神经元数量显著增加(P<0.05)。有趣的是,IES组大鼠C2段脊髓背角I-V层c-Fos阳性神经元数量的增加,左侧比右侧明显(P<0.05),说明向心包腔反复注入或抽出IES复制大鼠心绞痛的信号通过心脏感觉传入神经纤维(包括心交感和心迷走纤维)传至中枢C2段脊髓,因为心脏位于大鼠胸腔偏左侧,故C2段脊髓c-Fos阳性神经元数量左侧比右侧明显增多。
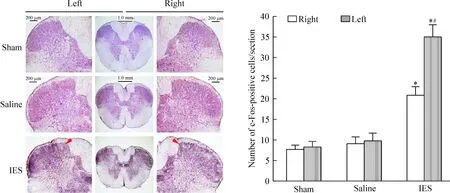
Figure 1. c-Fos immunoreactivity in the rat C2 spinal cord.c-Fos-positive cells are indicated with red arrows. Mean±SD. n=4.*P<0.05 vs sham or saline;#P<0.05 vs right.
3 三叉神经脊束核 c-Fos阳性神经元的变化
3.1c-Fos阳性神经元在三叉神经脊束核Sp5C的变化 Saline 组大鼠三叉神经脊束核尾部(Sp5C) c-Fos阳性神经元的数量与静息状态相似(图 2A),静息时c-Fos阳性神经元数量在Sp5C左、右侧也无明显差异(图2B)。然而,同sham 组和saline 组大鼠相比,IES组大鼠c-Fos阳性神经元数量在Sp5C明显大量增多(P<0.05)(图2B),Sp5C左侧c-Fos阳性细胞数量明显多于右侧(P<0.05)(图2B),无论在左侧还是在右侧, c-Fos阳性细胞数量在胶质细胞层(GCL)明显多于大细胞层(LCL)(P<0.05)(图2C),说明向心包腔反复注入或抽出IES复制大鼠心绞痛的信号通过心脏感觉传入神经纤维(包括心交感和心迷走纤维)由中枢C2段脊髓传至三叉神经脊束核尾部(Sp5C),因为心脏位于大鼠胸腔偏左侧,故c-Fos阳性神经元数量左侧比右侧明显增多,介导该信号的主要是三叉神经脊束核尾部的胶质细胞。用育亨宾(1 mg/kg, ip)和纳络酮(3 mg/kg, ip)预处理20 min,IES组大鼠Sp5C腹侧边c-Fos阳性神经元的表达未受影响(P>0.05)(图2D),说明向心包腔反复注入或抽出IES复制大鼠心绞痛的中枢信号上传没有α2-肾上腺素受体和阿片受体的参与。
3.2c-Fos阳性神经元在三叉神经脊束核Sp5I、Sp5O 和Pr5VL的变化 Sham组和saline 组大鼠c-Fos阳性神经元在三叉神经脊束核Sp5I、Sp5O 和Pr5VL均有少量c-Fos阳性神经元表达,左、右侧也无明显差异(P>0.05)。然而,同sham 组和saline 组大鼠相比,IES组大鼠呈圆锥体状的三叉神经感觉核复合体自前囟到对耳线Pr5VL、Sp5O 和Sp5I c-Fos阳性神经元的数量逐渐增加,c-Fos阳性神经元的数量左侧明显多于右侧(P<0.05), 由此说明向心包腔反复注入或抽出IES复制大鼠心绞痛的信号通过心脏感觉传入神经纤维(包括心交感和心迷走纤维)由中枢C2段脊髓传至三叉神经脊束核尾部(Sp5C),再传至三叉神经感觉核复合体,自对耳线到前囟Sp5I、Sp5O 和Pr5VL c-Fos阳性神经元的数量逐渐减少,因为心脏位置偏左,故c-Fos阳性神经元数量左侧多于右侧,见图3。
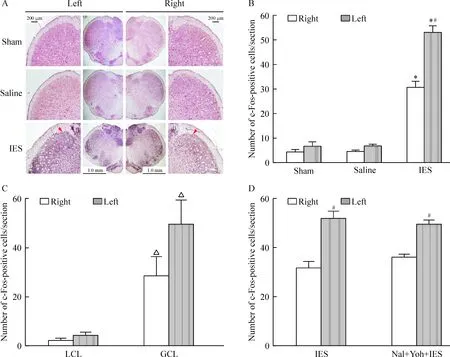
Figure 2. c-Fos immunoreactivity in rat spinal trigeminal tract neurons of the Sp5C. A: photomicrographs showing c-Fos immunoreactivity at the Sp5C level.c-Fos-positive cells are indicated with red arrows. B~D: quantification of c-Fos-positive sites in the Sp5C segment (B), in the large cell layer (LCL) and glial cell layer (GCL) of the Sp5C segment in the IES group (C), and in the Sp5C segment in the IES group pretreated with yohimbine (Yoh) and naloxane (Nal) prior to IES (D).Mean±SD. n=4. *P<0.05 vs sham or saline;#P<0.05 vs right;△P<0.05 vs LCL.
讨 论
通常情况下,典型的心肌缺血心绞痛患者常出现左前胸壁疼痛,并放射到左臂、颈部和下颚[18]。然而,最新研究表明,有相当一部分心肌缺血患者,在心肌缺血期间无上述典型症状,而颅面部疼痛是其唯一的症状[22]。
颅面部组织受三叉神经分支的专一支配,颅面部感觉传入信息(包括伤害性传入信息)经过初级传入纤维到达三叉神经脊束核,再传入中枢脑干[30-31]。在此期间,有害的信息经初级传入纤维激活位于三叉脑干感觉核复合体二级神经元,其中包括三叉神经脊束核尾部、极间部和口部神经元,它们在颅面部有害的信息传输过程中起着重要作用[31]。许多研究表明,用有害的电和化学刺激心脏左侧迷走神经分支,可以激活位于三叉神经丘脑束水平的左侧脊髓丘脑束神经元[2, 32]。我们由此提出假设,心源性颅面部疼痛可能涉及到脊髓颈段及三叉脑干感觉核复合体神经元的激活,三叉神经脊束核神经元的活化尤为关键。
c-Fos是即刻早基因中的一种,正常情况下,c-Fos在多数神经元中有低水平表达,细胞内c-Fos蛋白很少,不易检测到,但在接受刺激后表达水平可以迅速而短暂提高, 根据c-Fos可以被刺激诱导快速短暂表达的特性, 其产物c-Fos蛋白可作为中枢神经元兴奋活化的标志[33],笔者从大鼠心包腔反复注入或抽出IES复制心绞痛模型,运用免疫组化方法,以神经元活化为线索,观察大鼠脊髓和脑干神经元c-Fos表达,尤其关注大鼠脑干三叉神经感觉核复合体神经元c-Fos的表达,试图为临床上部分心肌缺血患者颅面部疼痛是其的唯一症状提供实验依据。
在心肌缺血期间,心迷走和心交感神经的传入纤维均被激活[34-35],先前诸多研究已表明,通常情况下,心交感神经的传入冲动进入上段胸髓和颈髓[2, 4, 20, 32],进而引起STT神经元的兴奋[2, 13, 16-17, 21, 32],与心绞痛患者出现左前胸壁疼痛,并放射到手臂有关。这些实验结果可以解释心脏疼痛时由上段颈髓支配区域潜在的牵涉痛发生的神经生理机制[2, 37]。然而,临床上有部分心肌缺血患者,颅面部疼痛是其唯一的症状[22],并且该种颅面部疼痛不是齿源性的[27],确与其牵涉到相同位置,由于对其病理发生和发展机制缺乏有效的了解,给临床上的及时诊断和治疗增加了难度[31]。心肌缺血的敏感传入神经元的激活是由心肌缺血相关的疼痛信号传递引发的[3, 38],既往的研究表明,上颈段脊髓(在C1~2节段)对心肌缺血的敏感传入神经元的信号传递整合中发挥着重要作用[1-2]。
我们的实验结果显示,同sham 组和saline 组大鼠相比,IES组大鼠C2段脊髓背角I-V层c-Fos阳性神经元数量显着增加,由此说明向心包腔反复注入或抽出IES复制大鼠心绞痛的信号通过心脏感觉传入神经纤维(包括心交感和心迷走纤维)传至中枢C2段脊髓,同时我们还观察到IES组大鼠c-Fos阳性神经元数量在三叉神经脊束核尾部(Sp5C)也明显增多(P<0.05),说明向心包腔反复注入或抽出IES复制大鼠心绞痛的信号通过心脏感觉传入神经纤维(包括心交感和心迷走纤维)由中枢C2段脊髓传至三叉神经脊束核尾部(Sp5C),介导该信号的主要位于三叉神经脊束核尾部的胶质细胞层。用育亨宾和纳络酮预处理20 min,IES组大鼠Sp5C腹侧边c-Fos阳性神经元的表达未受影响,初步证实向心包腔反复注入或抽出IES复制大鼠心绞痛的中枢信号上传过程中未发现α2-肾上腺素受体和阿片受体的参与。
此外,与sham 组和saline 组大鼠比较,IES组大鼠呈圆锥体状的三叉神经感觉核复合体自前囟到对耳线Pr5VL、Sp5O 和Sp5I c-Fos阳性神经元的数量逐渐增加,同样证实向大鼠心包腔反复注入或抽出IES的信号通过心脏感觉传入神经纤维(包括心交感和心迷走纤维)由中枢脊髓传至三叉神经脊束核尾部(Sp5C),再传至三叉神经感觉核复合体,自前囟到对耳线Pr5VL、Sp5O 和Sp5I c-Fos阳性神经元的数量逐渐增多,因为心脏位于大鼠胸腔偏左侧,故c-Fos阳性神经元数量左侧多于右侧。
众所周知,心肌自身代谢水平是调节冠脉血流量的最主要因素,而心肌的各种代谢产物中,腺苷所起的作用最重要。腺苷作为一种内源性嘌啶核苷,在生理和病理条件下都具有重要作用。IES包括腺苷、缓激肽、前列腺素E2、5-羟色胺和血清素构成的混合物,成分非常复杂,其中腺苷浓度最高,我们认为,通过向大鼠心包腔反复注入或抽出IES复制大鼠心绞痛模型获得中枢神经元激活的变化,在上调中枢三叉神经脊束核神经元c-Fos表达信号通路中,腺苷可能发挥了重要的信号转导分子作用,至于其确切机制有待今后进一步探讨。
总之,我们实验表明,通过向大鼠向心包腔反复注入或抽出IES复制大鼠心绞痛模型可以激活三叉神经脊束核心肌缺血的敏感传入神经元,不是通过阿片受体和α2-肾上腺素受体介导的。据此,我们通过实验性心肌缺血心绞痛动物模型,证实了此种疼痛可以转移到颅面组织,为临床上部分心肌缺血患者颅面部疼痛作为唯一症状提供了实验依据。
[致谢: 鹤岡正吉准教授和前田昌子讲师(昭和大学,日本)对整个实验的指导把关,郭试瑜准教授(昭和大学,日本)对文稿提出的批评指正,作者一同致谢!]
[参 考 文 献]
[1] 王海华,姜玉新,高 欣,等. 急性心肌梗死大鼠缺血心肌中差异microRNA的表达谱分析[J]. 中国病理生理杂志,2013,29(9):1546-1553.
[2] Chandler MJ, Zhang J, Qin C, et al. Intrapericardiac injections of algogenic chemicals excite primate C1-C2 spinothalamic tract neurons[J]. Am J Physiol Regul Integr Comp Physiol, 2000, 279(2):R560-R568.
[3] Foreman RD. Mechanisms of cardiac pain[J]. Ann Rev Physiol, 1999, 61:143-167.
[4] Meller ST, Gebhart GF. A critical review of the afferent pathways and the potential chemical mediators involved in cardiac pain[J]. Neurosci, 1992, 48(3):501-524.
[5] Fisch S. On the origin of cardiac pain. A new hypothesis[J]. Arch Internal Med, 1980, 140(6):754-755.
[6] Hua F, Ricketts BA, Reifsteck A, et al. Myocardial ischemia induces the release of substance P from cardiac afferent neurons in rat thoracic spinal cord[J]. Am J Phy-siol Heart Circ Physiol, 2004, 286(5):H1654-H1664.
[7] Huang MH, Horackova M, Negoescu RM, et al. Polysensory response characteristics of dorsal root ganglion neurones that may serve sensory functions during myocardial ischaemia[J]. Cardiovasc Res, 1996, 32(3):503-515.
[8] Hua F, Harrison T, Qin C, et al. c-Fos expression in rat brain stem and spinal cord in response to activation of cardiac ischemia-sensitive afferent neurons and electrostimulatory modulation[J]. Am J Physiol Heart Circ Physiol, 2004, 287(6):H2728-H2738.
[9] Baker DG, Coleridge HM, Coleridge JC, et al. Search for a cardiac nociceptor: stimulation by bradykinin of sympathetic afferent nerve endings in the heart of the cat[J]. J Physiol, 1980, 306:519-536.
[10]Kimura E, Hashimoto K, Furukawa S, et al. Changes in bradykinin level in coronary sinus blood after the experimental occlusion of a coronary artery[J]. Am Heart J, 1973, 85(5):635-647.
[11]Nerdrum T, Baker DG, Coleridge HM, et al. Interaction of bradykinin and prostaglandin E1 on cardiac pressor reflex and sympathetic afferents[J]. Am J Physiol, 1986, 250(5 Pt 2):R815-R822.
[12]Berger HJ, Zaret BL, Speroff L, et al. Cardiac prostaglandin release during myocardial ischemia induced by atrial pacing in patients with coronary artery disease[J]. Am J Cardiol, 1977, 39(4):481-486.
[13]Blair RW, Weber RN, Foreman RD. Responses of thoracic spinoreticular and spinothalamic cells to intracardiac bradykinin[J]. Am J Physiol, 1984, 246(4 Pt 2):H500-H507.
[14]Sylven C. Neurophysiological aspects of angina pectoris[J]. Zeitschrift fur Kardiologie, 1997, 86(Suppl 1):95-105.
[15]Xie Q, Li L, Kawada S. Hypotension after coronary arterial occlusion induces regional expression of c-Fos protein in the rat brain[J]. Annals Thoracic Cardiovasc Surg, 2000, 6(5):319-325.
[16]Chandler MJ, Qin C, Yuan Y, et al. Convergence of trigeminal input with visceral and phrenic inputs on primate C1-C2 spinothalamic tract neurons[J]. Brain Res, 1999, 829(1-2):204-208.
[17]Chandler MJ, Zhang J, Foreman RD. Vagal, sympathetic and somatic sensory inputs to upper cervical (C1-C3) spinothalamic tract neurons in monkeys[J]. J Neurophysiol, 1996, 76(4):2555-2567.
[18]Everts B, Karlson BW, Wahrborg P, et al. Localization of pain in suspected acute myocardial infarction in relation to final diagnosis, age and sex, and site and type of infarction[J]. Heart Lung, 1996, 25(6):430-437.
[19]Kuo DC, Oravitz JJ, DeGroat WC. Tracing of afferent and efferent pathways in the left inferior cardiac nerve of the cat using retrograde and transganglionic transport of horseradish peroxidase[J]. Brain Res, 1984, 321(1):111-118.
[20]White JC. Cardiac pain: anatomic pathways and physiologic mechanisms[J]. Circulation, 1957, 16(4):644-655.
[21]Hobbs SF, Chandler MJ, Bolser DC, et al. Segmental organization of visceral and somatic input onto C3-T6 spinothalamic tract cells of the monkey[J]. J Neurophysiol, 1992, 68(5):1575-1588.
[22]Kreiner M, Okeson JP, Michelis V, et al. Craniofacial pain as the sole symptom of cardiac ischemia: a prospective multicenter study[J]. J Am Dental Assoc, 2007, 138(1):74-79.
[23]McCarthy BD, Beshansky JR, D'Agostino RB, et al. Missed diagnoses of acute myocardial infarction in the emergency department: results from a multicenter study[J]. Annals Emergency Med, 1993, 22(3):579-582.
[24]Pope JH, Aufderheide TP, Ruthazer R, et al. Missed diagnoses of acute cardiac ischemia in the emergency department[J]. New Engl J Med, 2000, 342(16):1163-1170.
[25]Batchelder BJ, Krutchkoff DJ, Amara J. Mandibular pain as the initial and sole clinical manifestation of coronary insufficiency: report of case[J]. J Am Dental Assoc, 1987, 115(5):710-712.
[26]Rothwell PM. Angina and myocardial infarction presenting with pain confined to the ear[J]. Postgraduate Med J, 1993, 69(810):300-301.
[27]Kreiner M, Falace D, Michelis V, et al. Quality difference in craniofacial pain of cardiacvs. dental origin[J]. J Dental Res, 2010, 89(9):965-969.
[28]Foreman RD, Qin C. Neuromodulation of cardiac pain and cerebral vasculature: neural mechanisms[J]. Cleve Clin J Med, 2009, 76(Suppl 2):S75-S79.
[29]Myers DE. Vagus nerve pain referred to the craniofacial region. A case report and literature review with implications for referred cardiac pain[J]. Br Dental J, 2008, 204(4):187-189.
[30]Sessle BJ. Acute and chronic craniofacial pain: brainstem mechanisms of nociceptive transmission and neuroplasticity, and their clinical correlates[J]. Crit Rev Oral Biol Med, 2000, 11(1):57-91.
[31]Sessle BJ. Recent insights into brainstem mechanisms underlying craniofacial pain[J]. J Dental Edu, 2002, 66(1):108-112.
[32]Qin C, Chandler MJ, Miller KE, et al. Responses and afferent pathways of superficial and deeper C1-C2spinal cells to intrapericardial algogenic chemicals in rats[J]. J Neurophysiol, 2001, 85(4):1522-1532.
[33]周 青,陈 剑,刘 珏,等. 视觉刺激诱导c-Fos在弱视成年大鼠视皮层神经元表达的研究[J]. 中国病理生理杂志,2007,23(6):1228-1232.
[34]Zimmermann M. Ethical guidelines for investigations of experimental pain in conscious animals[J]. Pain, 1983, 16(2):109-110.
[35]Thoren PN. Activation of left ventricular receptors with nonmedullated vagal afferent fibers during occlusion of a coronary artery in the cat[J]. Am J Cardiol, 1976, 37(7):1046-1051.
[36]Brown AM. Excitation of afferent cardiac sympathetic nerve fibres during myocardial ischaemia[J]. J Physiol, 1967, 190(1):35-53.
[37]Sampson JJ, Cheitlin MD. Pathophysiology and differen-tial diagnosis of cardiac pain[J]. Prog Cardiovasc Dis, 1971, 13(6):507-531.
[38]Euchner-Wamser I, Meller ST, Gebhart GF. A model of cardiac nociception in chronically instrumented rats: behavioral and electrophysiological effects of pericardial administration of algogenic substances[J]. Pain, 1994, 58(1):117-128.

