成纤维样滑膜细胞Toll样受体在类风湿性关节炎的研究进展
唐媚,胡松,唐信威,刘阳,王衍堂,邹强*(.遵义医学院免疫学教研室,遵义 563003;.成都医学院免疫学教研室,成都 60083)
·综 述·
成纤维样滑膜细胞Toll样受体在类风湿性关节炎的研究进展
唐媚1,胡松2,唐信威2,刘阳2,王衍堂2,邹强2*
(1.遵义医学院免疫学教研室,遵义 563003;2.成都医学院免疫学教研室,成都 610083)
类风湿性关节炎;Toll样受体;成纤维样滑膜细胞
Toll样受体(toll-like receptor, TLRs)是一种I型跨膜蛋白受体,可识别微生物上特定结构的病原相关分子模式(pathogen-associated molecular patterns, PAMPs)和宿主自身损伤细胞产生的损伤相关分子模式(damage-associated molecular patterns, DAMPs),在天然免疫中发挥着重要作用。类风湿性关节炎(rheumatoid arthritis,RA)是以关节滑膜炎为主要特征的自身免疫性疾病。成纤维样滑膜细胞(fibroblast-like synoviocytes, FLSs)异常增生及分泌炎性细胞因子,最终可致关节慢性炎症和畸形[1]。FLSs是滑膜组织的重要组成成分之一,巨噬样滑膜细胞活化后分泌的细胞因子如IL-1β可诱导FLSs增殖,随后增生活化的FLSs一方面分泌趋化因子、炎性细胞因子引起关节炎症,另一方面FLSs分泌基质金属蛋白酶(matrix metalloproteinases,MMPs)侵蚀软骨,引起关节畸形,从而在RA的病理机制中发挥着至关重要的作用[2]。FLSs上表达的TLRs活化后,会激活下游一系列的信号转导通路,启动炎性细胞因子、趋化因子以及MMPs的表达,在RA发病进程中扮演了重要角色。为此,对TLRs在免疫反应中的调节作用及其胞内信号转导激活机制的研究将为RA治疗提供新思路[3]。
1 TLRs结构、信号通路及配体
TLRs的发现是近十余年天然免疫系统研究中最主要的进展之一。它主要由3个功能区构成:胞外区、跨膜区和胞内区。其胞外区有19~25个富含亮氨酸的重复序列,此结构能促进蛋白质间的相互黏附,有利于识别病原体及其产物,不同的TLRs胞外区同源性较低,可能与其识别不同结构的配体相关[2]。TLRs的跨膜区富含半胱氨酸。TLRs的胞内区与白细胞介素1受体(interleukin-1 receptor, IL-1R)的胞内区结构相似,为TIR(Toll IL-1R)同源区,它是Toll蛋白和IL-1R向下游转导信号的核心元件。不同的TLRs通过特异性识别一类PAMPs,如病毒、细菌和真菌;或来源于宿主自身损伤细胞产生DAMPs[4],如热休克蛋白,介导胞内信号转导,从而释放促炎因子、趋化因子,诱导T淋巴细胞产生适应性免疫反应。
TLRs家族信号通路包括髓样分化蛋白88(myeloid differentiation primary response protein 88, MyD88)依赖性传导途径和MyD88非依赖性传导途径两种(见图1)。在MyD88依赖性传导途径中,TLRs胞内区域与MyD88羧基端的TIR结构域相结合而激活MyD88。MyD88的DD结构域与IL-1R相关激酶(IL-1R-associated kinases, IRAKs)的氨基端死亡区域相互作用,招募IRAKs到TLRs信号复合物上引起IRAKs自身磷酸化[5]。随之,再与肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor associates factor 6, TRAF6)结合[6],促使NF-κB抑制蛋白自身磷酸化,从而激活NF-κB使之从细胞质转移到细胞核,最终辅助炎性细胞因子及刺激分子的转录、翻译和表达。MyD88非依赖性传导途径是通过干扰素调节因子3(interferon regulatory factor 3, IRF3)和NF-κB的晚发活化实现。TLRs是通过β干扰素TIR结构域衔接蛋白(TIR-domain-containing adaptor inducing interferon-β,TRIF)与TRIF连接,再与TRAF6结合:一方面激活IKKs复合体,使NF-κB抑制蛋白自身磷酸化,促使NF-κB从细胞质转移到细胞核[7],并与DNA上NF-κB的位点结合,启动转录调控机制;另一方面TRIF与TRF3结合,促使下游IRF3抑制蛋白自身磷酸化,随后IRF3从细胞质转移到细胞核内,启动干扰素的表达。
TLRs作为连接天然免疫和适应性免疫的关键环节,在免疫应答中发挥着极为重要的作用。迄今已发现的人类TLRs有10种[8],在多种细胞中都有表达,其中包括上皮细胞、成纤维细胞、免疫细胞(单核细胞和巨噬细胞)和非免疫细胞(树突细胞)等。现已发现的人关节滑膜细胞TLRs有6种(见表1),其中TLR1在细胞膜上表达,其配体是来源于细菌的三酰脂蛋白;TLR2在细胞膜上表达,其主要配体有脂蛋白、肽聚糖、HSP60、HSP70、Gp96、LDL和HMGB1;TLR3在溶酶体的内膜上表达,其主要配体有双链RNA;TLR4在细胞膜上表达,其主要配体有脂多糖(lipopolysaccharide, LPS)、HSP60、HSP70、HSPB8和Gp96;TLR5在细胞膜上表达,其配体是来源于细菌的鞭毛蛋白;TLR6在细胞膜上表达,其配体是二酰基脂蛋白[8]。此外,FLSs上TLRs的表达和激活,对RA病理机制的研究有重要作用。
Ospelt等[9]在人滑膜细胞TLR(1-10)表达谱的研究中发现:TLR(1-6)的mRNA有表达,TLR(7-10)的mRNA无表达,其中TLR3的mRNA表达最高,TLR2、TLR4的mRNA表达稍弱,其他TLRs的mRNA的表达未能检测出,提示TLR2、TLR3、TLR4对RA上FLSs的研究意义更为重大。为此,以下主要介绍FLSs上TLR2、TLR3、TLR4的配体种类、胞内信号传导途径以及目前的研究结果。

表1 人关节滑膜细胞上TLRs定位、配体及来源
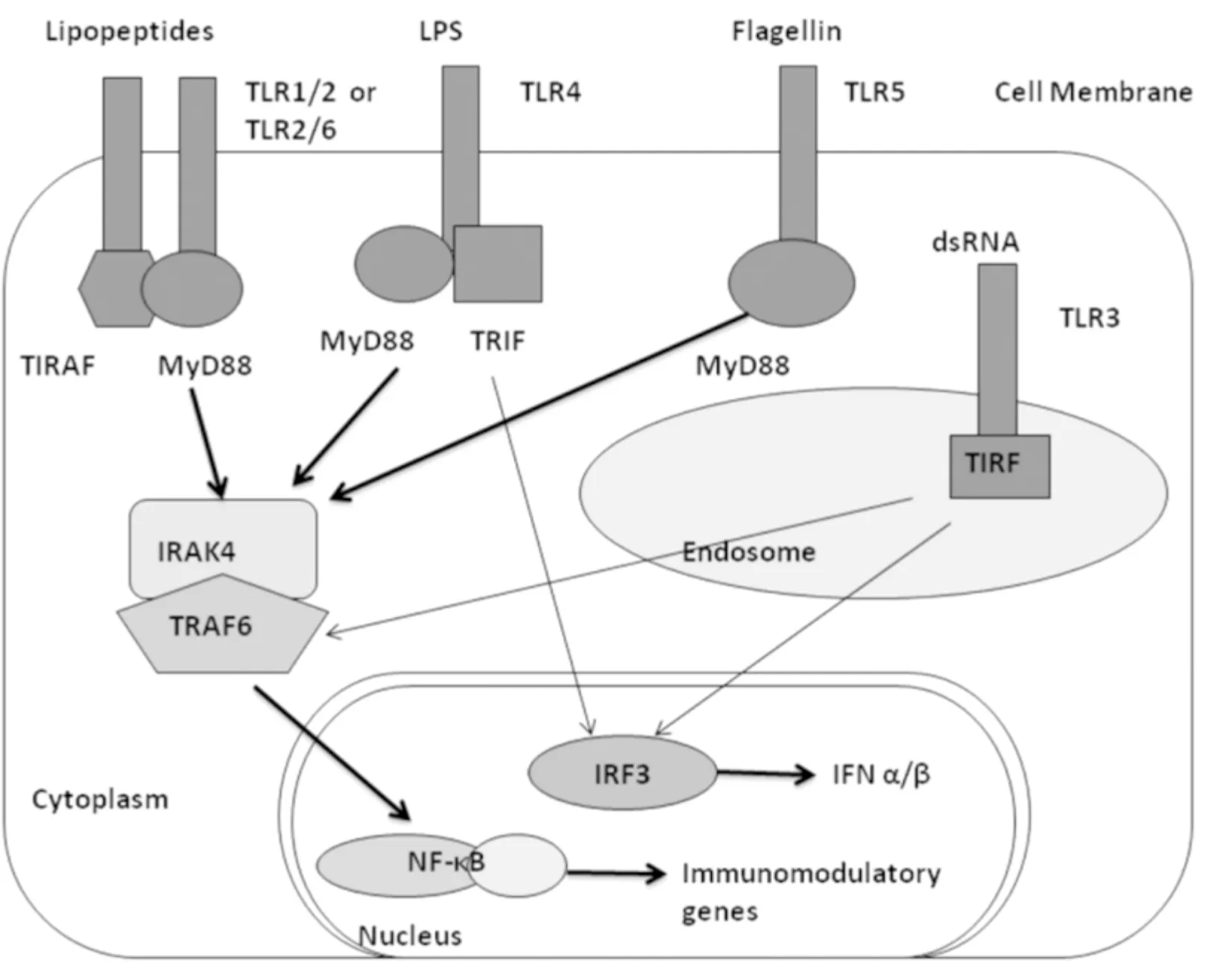
图1 人FLSs上TLRs信号传导途径
2 TLR2激活与RA的关系
TLR2是目前已克隆出的TLRs家族中识别病原微生物种类最多且表达范围最广的成员。TLR2主要通过识别特异性PAMPs来促发机体对病原微生物的级联免疫反应,其配体有革兰氏阳性菌的菌细胞壁组分,如胞壁酸、肽聚糖和细菌脂肽,革兰氏阴性菌细胞壁的脂蛋白和脂肽聚糖,霉菌的细胞壁成分以及真菌的酵母聚糖等。其中,TLR2在识别细菌肽聚糖时,需要TLR1和TLR6协助识别酰化的脂肽[10]。新近研究[11]发现,TLR2还可识别组织损伤的DAMPs和某些内源性抗原,如热休克蛋白和其他组织分泌的炎性因子。TLR2胞内信号传导是通过MyD88依赖性传导途径完成的。TLR2与TLR1或TLR6结合形成的异源二聚体可识别特异性配体;活化的TLR2胞内,TIR与MyD88羧基端结合后募集MyD88到受体上,随后MyD88利用N端的DD结构募集同样含DD结构的IRAK-1和IRAK-4;IRAK-1被IRAK-4作用后磷酸化,并从受体复合体上解离且与TRAF6结合使之活化,最终促使NF-κB转迁到核内,激活相应基因的转录[12]。
目前实验研究结果[13]表明,FLSs上TLR2的激活与RA发病密切相关,其中主要表现在RA的促炎反应中。Schrijver等[14]在RA病人滑膜液中检测到细菌的肽聚糖成分,提示TLR2可能参与RA的发病过程。Kyburz等[15]用TLR2配体刺激滑膜细胞,发现TLR2配体可促进滑膜细胞释放结合素、MMP、IL-6和IL-8等促炎因子。在小鼠关节动物模型[16]中,小鼠关节注射TLR2配体(细菌肽聚糖)可形成严重的关节炎,表明在只有肽聚糖而无活菌的情况下,也可刺激关节产生炎症反应。Pierer等[17]系统研究了RA病人滑膜细胞上TLR2介导的炎症因子表达情况:通过TLR2配体(细菌肽聚糖)刺激滑膜细胞,建立体外模型筛选炎症因子基因表达;利用高通量寡核苷酸微阵列对其技术分析发现,有74个基因表达增高,其中新发现了14个编码化学增活素的基因;定量PCR检测肽聚糖刺激后的正常人FLSs mRNA发现,粒细胞趋化蛋白2(granulocyte chemotactic protein2, GCP2)、T细胞激活分泌调节因子(RANTES)、单核细胞趋化蛋白2(monocyte chemoattractant protein2, MCP-2)、IL-8以及生长相关癌基因-2的表达均显著升高,MCP-1、EXODUS、CXCL-16表达量也有所升高;同时,经刺激的细胞上清中也有GCP2、RANTES和MCP2的分泌,在RA病人的滑膜组织中也检测到GCP2和MCP2,而在骨关节炎病人的滑膜组织中却未检测到。由此可见,TLR2配体通过刺激滑膜细胞活化释放趋化因子,对RA的炎症浸润起了较大作用。
3 TLR3激活与RA的关系
TLR3是位于细胞内的模式识别受体(pattern recognition receptor, PRR),可识别病毒双链RNA(dsRNA)。而宿主细胞本身不产生dsRNA,因此病毒在细胞内产生的dsRNA可被一种PAMPs识别。TLR3是唯一一种通过MyD88非依赖性传导途径进行信号传导的TLRs。Brentano等[18]用TLR3配体poly(I∶C)刺激关节滑膜细胞,可检测到炎性细胞因子和趋化因子,如IL-6、IFN-β、CCL5。RA病人坏死的滑膜细胞刺激FLSs,也可在上清中检测到上述细胞因子,提示坏死的滑膜细胞RNA可能是由TLR3的内源性配体刺激FLSs促炎因子基因表达而形成。FLSs上TLR3受体的激活与RA炎症的产生关系密切。Brentano等[18]用TLR3配体刺激RA和骨性关节炎(osseous arthritis, OA)病人的FLSs,发现RA滑膜细胞上TLR3的表达量高于OA。Roelofs等[19]发现RA病人滑膜组织上的TLR3受体比正常人表达量高。Ospelt等[9]研究显示,早期RA病人滑膜细胞上TLR3表达量比持续期的表达量高。然而在FLSs上TLR3的炎性研究中出现了相互矛盾的实验结果。 Zare等[20]发现正常小鼠关节在注射了dsRNA后会出现关节炎症,但同样的现象也出现在TLR3基因敲除小鼠上,这似乎无法解释TLR3参与RA促炎的机制。然而随后,Magnusson等[21]研究显示,dsRNA刺激关节后是通过单核/巨噬细胞分泌IFN-α来引起关节炎症反应的。Yarilina等[22]在血清和胶原抗体诱导的小鼠关节炎动物实验研究[22]中发现,TLR3配体对关节炎症有一定的抑制作用,表明FLSs上的TLR3介导了关节的抗炎反应。上述实验结果说明,TLR3参与了RA病程发生发展过程,其中包括促炎和抗炎两个方面,但TLR3在RA中介导炎症反应的机制仍不清晰。
4 TLR4激活与RA的关系
TLR4是IL-1R家族的一员,是人类发现的首个TLRs相关蛋白,几乎表达在所有细胞系上[23]。TLR4的配体种类繁多,按不同来源可分为内源性配体和外源性配体;其中内源性配体主要是因机体损伤、坏死或凋亡细胞释放的热休克蛋白、氧自由基和神经介质等,而外源性配体主要是LPS。TLR4胞内信号传导包括MyD88依赖性传导途径和MyD88非依赖性传导途径两种。
目前FLSs上TLR4在炎症方面的研究结果相互对立,大部分集中在TLR4介导促炎反应方面。Roelofs等[19]在RA病人的滑膜液、血清中检测到了高含量的TLR4配体,其中TLR4的内源性配体通过介导炎性细胞因子分泌来加重关节炎症。同时,Ospelt等[9]发现,RA病人FLSs上TLR4的表达量升高,尤其在病程早期和持续期更为显著。Nair等[24]通过RA和OA病人的滑膜液刺激体外培养的滑膜细胞,检测到微量的IL-8;经LPS和滑膜液共同刺激滑膜细胞后发现IL-8分泌明显升高。此外Nair等[24]实验发现滑膜液中存在的可溶性CD14分子可增强TLR2和TLR4的表达。Lee等[25]在CII抗体诱导关节炎的小鼠动物模型中发现,TLR4基因敲除小鼠的关节肿胀程度,促炎因子COX-2、TNF-α的分泌量均低于野生型小鼠。同样,在用免疫复合物诱导的小鼠关节炎模型(immune comlex-mediated arthritis,ICA)中发现,TLR4-/-小鼠关节肿胀程度轻于野生型小鼠,趋化因子以及IL-1、IL-6等促炎因子的分泌也明显减少。然而,在含有沙眼衣原体滑膜细胞诱导的关节炎动物模型[26]中,发现TLR4基因缺陷小鼠的关节炎症状较正常组小鼠严重。TLR4受体激活后会加重IL-1引起的关节炎症[27],而TLR4-/-小鼠可减轻因IL-1Ra基因缺失引起的关节炎症状[28],表明TLR4参与了抗炎反应。目前对TLR4配体存在、受体表达和发病机制的研究已较广泛,但仍存在一些相互矛盾的实验结果,说明现阶段还不能透彻地认识TLR4参与RA发病的分子机制。由此猜想,TLR4介导促炎反应和抗炎反应是否与其存在两条信号转导途径相关:MyD-88依赖性转导途径参与的促炎反应起着主要作用,而MyD88非依赖性转导途径参与的抗炎反应起着次要作用。
5 滑膜细胞上TLRs在RA靶向治疗的应用
传统的药物和疗法对RA病情的缓解有一定疗效,但不能完全治愈。靶向关键细胞因子的生物制剂因价格昂贵、需反复注射和存在局部不良反应等缺陷,也无法满足RA的治疗需要,这使得探究治疗RA的有效方法成为研究的热点。研究结果[29]证实,TLRs在RA的发病机制中起着重要作用,因此靶向TLRs受体也成为RA的治疗方法:阻断TLRs下游信号介导蛋白质分子,采用中和抗体或可溶性假性抗体来阻断TLRs配体和受体结合以抑制炎症以及阻断受体二聚化[30]等。
在抑制关节炎动物模型[31]中,辅助T细胞2表达的内毒素和肥大细胞表达的ST2蛋白可阻断TLR4介导的信号传导通路,从而减轻炎症反应。SIGIRR可通过负向调控TLR4的信号传导通路,来抑制RA病人FLSs产生炎性因子和细胞因子[32]。NovImmune公司研发的单克隆抗体NI0101/α可抑制TLR4激活,从而阻断下游信号传导[33]。烷酮衍生物、萝卜硫素和OSL07可抑制TLR4二聚化从而阻断下游信号[34]。Opsona公司研发的抗TLR2抗体、OPN-301可阻止RA病人体外培养的FLSs分泌炎性细胞因子。滑膜细胞上TLRs信号传导途径与RA的发生发展有必然联系,因此,阐明靶向滑膜细胞上TLRs信号传导途径将为RA的治疗提供新的思路。
6 展望
目前,临床上传统的RA治疗方法存在诸多不足,迫切需要寻找新的有效疗法。研究[29]发现,TLRs在RA的发病机制中发挥着至关重要的作用,主要表现在介导炎性介质生成和促进滑膜细胞增殖两大方面。然而,目前对TLRs参与RA的分子机制及TLRs之间的相互影响仍无全面透彻的认识,希望在不久的将来能从多角度透彻研究TLRs和RA之间的关系,以便为RA的临床治疗提供新思路。
[1] Fox DA, Gizinski A, Morgan R,etal.Cell-cell interactions in rheumatoid arthritis synovium[J]. Rheum Dis Clin North Am, 2010,36(2): 311-323.
[2] Huber LC, Distler O, Tarner I,etal.Synovial fibroblasts: key players in rheumatoid arthritis[J]. Rheumatology:Oxford,2006,45(6): 669-675.
[3] Bartok B, Firestein GS. Fibroblast-like synoviocytes: key effector cells in rheumatoid arthritis[J]. Immunological Reviews, 2010, 233(1): 233-255.
[4] Akira S, Takeda K. Toll-like receptor signalling[J]. Nature Reviews Immunology, 2004, 4(7): 499-511.
[5] Li T, Hu J, Thomas JA,etal. Differential induction of apoptosis by LPS and taxol in monocytic cells[J]. Molecular Immunology, 2005, 42(9): 1049-1055.
[6] Kaisho T, Akira S. Toll-like receptor function and signaling[J]. Journal of Allergy and Clinical Immunology, 2006, 117(5): 979-987.
[7] Muroi M, Ohnishi T, Tanamoto K. Regions of the mouse CD14 molecule required for toll-like receptor 2-and 4-mediated activation of NF-kappa B[J]. J Biol Chem,2002,277(44): 42372-42379.
[8] Takeuchi O, Akira S. Pattern recognition receptors and inflammation[J]. Cell, 2010, 140(6): 805-820.
[9] Ospelt C, Brentano F, Rengel Y,etal. Overexpression of toll-like receptors 3 and 4 in synovial tissue from patients with early rheumatoid arthritis: toll-like receptor expression in early and longstanding arthritis[J]. Arthritis Rheum,2008,58(12): 3684-3692.
[10] Ozinsky A, Underhill DM, Fontenot JD,etal. The repertoire for pattern recognition of pathogens by the innate immune system is defined by cooperation between toll-like receptors[J]. Proceedings of the National Academy of Sciences, 2000, 97(25): 13766-13771.
[11] Takeuchi O, Hoshino K, Kawai T,etal. Differential roles of TLR2 and TLR4 in recognition of gram-negative and gram-positive bacterial cell wall components[J]. Immunity, 1999, 11(4): 443-451.
[12] Qiu Y, Shen Y, Li X,etal. Molecular cloning and functional characterization of a novel isoform of chicken myeloid differentiation factor 88 (MyD88)[J]. Developmental & Comparative Immunology, 2008, 32(12): 1522-1530.
[13] Radstake TR, Roelofs MF, Jenniskens YM,etal. Expression of toll-like receptors 2 and 4 in rheumatoid synovial tissue and regulation by proinflammatorycytokines interleukin-12 and interleukin-18 via interferon-gamma[J]. Arthritis and Rheum,2004,50(12):3856-3865.
[14] Schrijver IA, Melief MJ, Tak PP,etal. Antigen-presenting cells containing bacterial peptidoglycan in synovial tissues of rheumatoid arthritis patients coexpress costimulatory molecules and cytokines[J]. Arthritis Rheum, 2000, 43(10): 2160-2168.
[15] Kyburz D, Rethage J, Seibl R,etal. Bacterial peptidoglycans but not CpG oligodeoxynucleotides activate synovial fibroblasts by toll-like receptor signaling[J]. Arthritis & Rheumatism, 2003, 48(3): 642-650.
[16] Liu ZQ, Deng GM, Foster S,etal. Staphylococcal peptidoglycans induce arthritis[J]. Arthritis Research, 2001, 3(6): 375-380.
[17] Pierer M, Rethage J, Seibl R,etal. Chemokine secretion of rheumatoid arthritis synovial fibroblasts stimulated by Toll-like receptor 2 ligands[J]. The Journal of Immunology, 2004, 172(2): 1256-1265.
[18] Brentano F, Schorr O, Gay RE,etal. RNA released from necrotic synovial fluid cells activates rheumatoid arthritis synovial fibroblasts via toll-like receptor 3[J]. Arthritis & Rheumatism, 2005, 52(9): 2656-2665.
[19] Roelofs MF, Joosten LA, Abdollahi-Roodsaz S,etal. The expression of toll-like receptors 3 and 7 in rheumatoid arthritis synovium is increased and costimulation of toll-like receptors 3, 4, and 7/8 results in synergistic cytokine production by dendritic cells[J]. Arthritis & Rheumatism, 2005, 52(8): 2313-2322.
[20] Zare F, Bokarewa M, Nenonen N,etal. Arthritogenic properties of double-stranded (viral) RNA[J]. The Journal of Immunology, 2004, 172(9): 5656-5663.
[21] Magnusson M, Zare F, Tarkowski A. Requirement of type I interferon signaling for arthritis triggered by double-stranded RNA[J]. Arthritis & Rheumatism, 2006, 54(1): 148-157.
[22] Yarilina A, DiCarlo E, Ivashkiv LB. Suppression of the effector phase of inflammatory arthritis by double-stranded RNA is mediated by type I IFNs[J]. The Journal of Immunology, 2007, 178(4): 2204-2211.
[23] Muzio M, Bosisio D, Polentarutti N,etal. Differential expression and regulation of toll-like receptors (TLR) in human leukocytes: selective expression of TLR3 in dendritic cells[J]. The Journal of Immunology, 2000, 164(11): 5998-6004.
[24] Nair A, Kanda V, Bush-Joseph C,etal. Synovial fluid from patients with early osteoarthritis modulates fibroblast-like synoviocyte responses to Toll-like receptor 4 and Toll-like receptor 2 ligands via soluble CD14[J]. Arthritis & Rheumatism, 2012, 64(7): 2268-2277.
[25] Lee EK, Kang SM, Paik DJ,etal. Essential roles of Toll-like receptor-4 signaling in arthritis induced by type II collagen antibody and LPS[J]. International Immunology, 2005, 17(3): 325-333.
[26] Zhang X, Glogauer M, Zhu F,etal. Innate immunity and arthritis: neutrophil Rac and toll-like receptor 4 expression define outcomes in infection-triggered arthritis[J]. Arthritis & Rheumatism, 2005, 52(4): 1297-1304.
[27] Abdollahi-Roodsaz S, Joosten LA, Koenders MI,etal. Local interleukin-1-driven joint pathology is dependent on toll-like receptor 4 activation[J]. The American Journal of Pathology, 2009, 175(5): 2004-2013.
[28] Abdollahi-Roodsaz S, Joosten LA, Koenders MI,etal. Stimulation of TLR2 and TLR4 differentially skews the balance of T cells in a mouse model of arthritis[J]. Journal of Clinical Investigation, 2008, 118(1): 205-216.
[29] Takagi M. Toll-like receptor-a potent driving force behind rheumatoid arthritis[J]. J Clin Exp Hematopathol, 2011, 51(2): 77-92.
[30] Meng L, Zhu W, Jiang C,etal.Toll-like receptor 3 upregulation in macrophages participates in the initiation and maintenance of pristane-induced arthritis in rats[J]. Arthritis Res Ther,2010,12(3):103.
[31] Abdollahi-Roodsaz S, Joosten LA, Roelofs MF,etal. Inhibition of toll-like receptor 4 breaks the inflammatory loop in autoimmune destructive arthritis[J]. Arthritis & Rheumatism, 2007, 56(9): 2957-2967.
[32] Drexler SK, Kong P, Inglis J,etal. SIGIRR/TIR-8 is an inhibitor of toll-like receptor signaling in primary human cells and regulates inflammation in models of rheumatoid arthritis[J]. Arthritis & Rheumatism, 2010, 62(8): 2249-2261.
[33] Raby AC, Le Bouder E, Colmont C,etal. Soluble TLR2 reduces inflammation without compromising bacterial clearance by disrupting TLR2 triggering[J]. The Journal of Immunology, 2009, 183(1): 506-517.
[34] Park SJ, Kang SH, Kang YK,etal. Inhibition of homodimerization of toll-like receptor 4 by 4-oxo-4-(2-oxo-oxazolidin-3-yl)-but-2-enoic acid ethyl ester[J]. International Immunopharmacology, 2011, 11(1): 19-22.
国家自然基金资助项目(NO:81273530,81202363,81302786)
邹强,E-mail:qiangzou99@gmail.com
http://www.cnki.net/kcms/detail/51.1705.R.20140410.1537.005.html
10.3969/j.issn.1674-2257.2014.02.032
R392.9
A

