紧密连接蛋白Claudin-3在人乳腺癌组织的表达与临床意义
姚永强,韩 雪,曹铭谦,方 红,解继平
(大连大学附属中山医院,辽宁 大连 116001)
紧密连接蛋白Claudin-3在人乳腺癌组织的表达与临床意义
姚永强,韩 雪,曹铭谦,方 红,解继平
(大连大学附属中山医院,辽宁 大连 116001)

目的 探讨Claudin-3在不同转移淋巴结个数乳腺癌患者中表达的差异。方法 将128例乳腺癌组织标本按淋巴结转移个数分组,转移淋巴结个数<4个为A组,≥4个为B组,2组各64例。应用实时定量逆转录聚合酶链反应(RT-PCR)检测2组乳腺癌组织Claudin-3的表达水平并进行比较。结果 A组Claudin-3 mRNA表达低于B组,2组比较有显著性差异(P<0.05)。不同年龄、激素受体状态、CerbB-2、p53、ki67和组织学分级患者Claudin-3表达水平比较差异均无统计学意义(P均>0.05)。结论 Claudin-3表达上调可促进乳腺癌的淋巴结转移,与预后不良有关。
乳腺癌;Claudin-3;淋巴结转移
WHO最新研究结果显示,全球每年新增乳腺癌患者超过120万。乳腺癌作为女性高发肿瘤,严重威胁着女性的生命及健康。每年约有20万乳腺癌患者死于复发和转移。故复发和转移是造成乳腺癌患者死亡的主要原因[1]。淋巴结转移是乳腺癌的主要转移途径,淋巴结转移情况是预测乳腺癌患者复发及死亡的独立预后因素。肿瘤细胞向远处转移的机制异常复杂。上皮间叶转化(EMT)是恶性肿瘤细胞转化为间叶性细胞形态的过程,是恶性肿瘤细胞向远处转移的起始阶段,主要表现为肿瘤边缘细胞(前缘癌细胞)紧密连接的破坏[2]。紧密连接是细胞间连接形式的一种,主要存在于上皮细胞间的连接复合体中。恶性肿瘤细胞发生EMT的过程可以促使上皮细胞内环境稳态的破坏,使上皮细胞获得一个迁移性的间质表型,促使肿瘤细胞远距离的转移形成。Claudin是构成细胞间紧密连接复合体的骨架蛋白之一,研究发现多种上皮性恶性肿瘤中Claudin蛋白表达异常,Claudin-3表达的改变与很多上皮细胞恶性肿瘤的恶性程度及转移密切相关[3]。关于紧密连接中Claudin-3的表达与乳腺癌的淋巴结转移的相关性研究暂无明确定论。本实验选择浸润性导管癌标本128例,采用实时定量逆转录聚合酶链反应(RT-PCR)方法检测Claudin-3表达在不同淋巴结转移个数患者中的差异,意在探讨Claudin-3表达与乳腺癌转移的关系,为临床预测乳腺癌患者预后提供新的指标。
1 临床资料
1.1 一般资料 128例乳腺癌标本采自2012于我院经手术治疗、术前未进行新辅助治疗(新辅助化疗及新辅助内分泌治疗)的乳腺癌标本。均于术中、术后经病理证实为浸润性导管癌。术中清扫淋巴结个数符合国际标准(清扫淋巴结总数均≥10个)。入组患者均为女性,年龄38~75岁,中位年龄48岁。为更好地研究转移期癌组织,标本取自以肿瘤边缘为中点,向肿瘤组织及正常乳腺组织各进深0.5 cm。标本离体后2min内用液氮保存。乳腺癌的诊断及常规病理资料由2位病理医生盲法阅片后提供。按淋巴结转移多少分为2组:A组患者淋巴结转移个数<4个,肿瘤长径(3.13±1.35)cm,淋巴结转移数(2.1±0.8)个;B组患者淋巴结转移个数≥4个,肿瘤长径(3.28±1.26)cm,淋巴结转移数(12.1±5.2)个。
1.2 实验方法
1.2.1 细胞总RNA的提取 采用Trizol(TakaRe公司)按照说明书提取组织细胞总RNA,紫外分光光度法测定RNA的浓度和纯度,A260/A280表达在1.8~2.2的标本方可转为cDNA。
1.2.2 cDNA的合成 总RNA 1.0 μL,5×PrimescriptTMBuffer 2.0 μL,PrimescriptTMRT Enzyme MIX Ⅰ 0.5 μL,Oligo dT Primer 0.5 μL,Random 6 mers 0.5 μL,RNase Free dH2O 5.5 μL。37 ℃孵育15 min,85 ℃ 5 s终止反应。4 ℃保存。
1.2.3 引物和探针的设计与合成 采用Primer designer 5.0软件设计引物。GAPDH和Claudin-3上下游引物均由大连TakaRa生物制剂有限公司提供。GAPDH为5’-CCATG TAGTTGAGGTCAATGAAG-3’,3’-GGTGAAGGTCGGAGT CAACG-5’;Claudin-3为5’-CTGCTCTGCTGCTCGTGTCC-3’,3’-TTAGACGTAGTCCTTGCGGTCGTAG-5’。
1.2.4 RT-PCR 2×SYBR®Premix Ex TaqTM5.0 μL,PCR Forword Primer 0.5 μL,PCR Reverse Primer 0.5 μL,H2O 3.0 μL,cDNA液 1.0 μL。反应条件:95 ℃ 2 min变性;95 ℃ 20 s,63 ℃ 30 s,72 ℃ 30 s,40个循环融解曲线分析:95 ℃ 55 s。读取结果进行分析。
1.3 统计学方法 应用SPSS 17.0统计软件进行统计分析,等级资料采用秩和检验,计量资料采用独立样本t检验;相关分析采用Spearman秩相关检验。P<0.05为有统计学意义。
2 结 果
2.1 2组标本免疫组化染色结果分析 2组患者雌激素受体(ER)、孕激素受体(PR)、癌基因(HER2)、核增殖抗原(Ki67)、抑癌基因(p53)表达差异均无统计学意义(P均>0.05)。见表1。
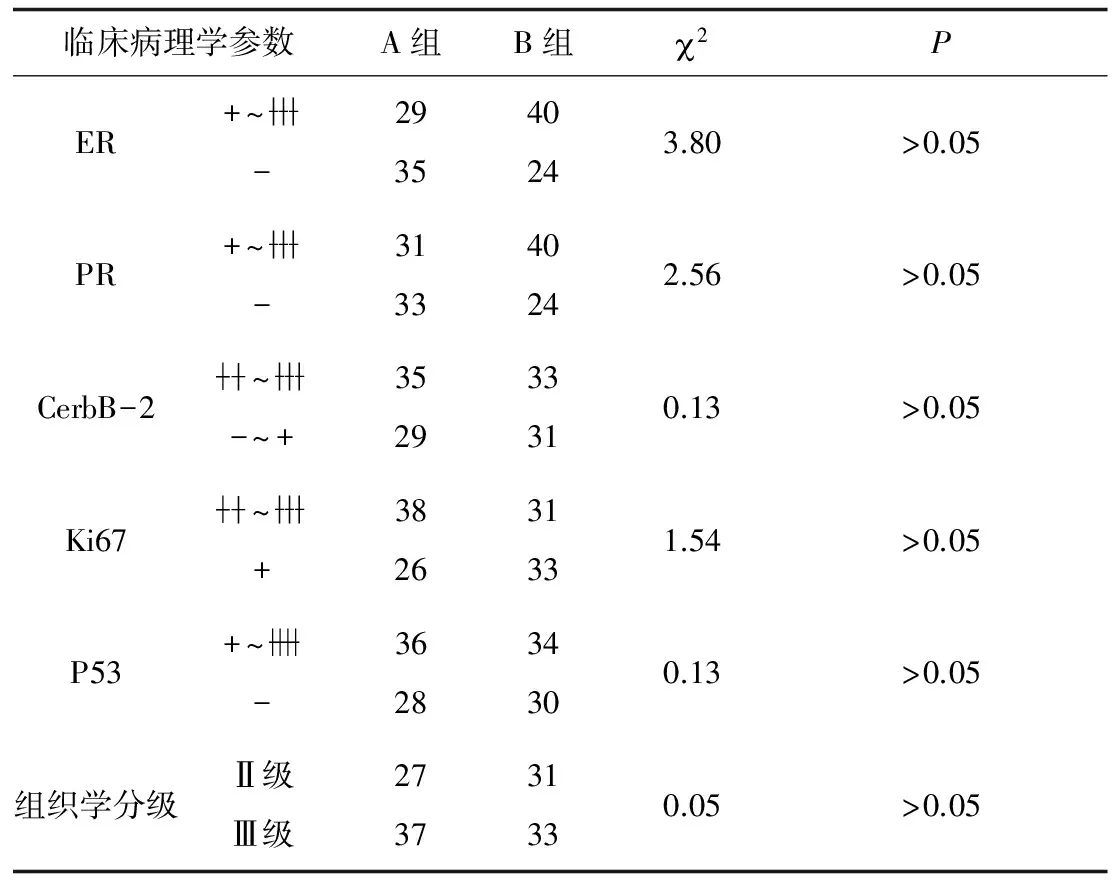
表1 2组患者临床病理学参数比较 例
2.2 乳腺癌组织的Claudin-3 mRNA表达与临床病理学参数的关系 对128例乳腺癌标本进行Claudin-3 mRNA检测结果显示,A组的Claudin-3 mRNA表达率显著低于B组(P<0.05);而不同年龄、激素受体状态、CerbB-2、Ki67、p53和组织学分级患者Claudin-3表达水平比较差异均无统计学意义。见表2。
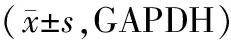
表2 Claudin-3表达与临床病理学参数的关系
3 讨 论
本实验128例乳腺癌患者按淋巴结转移多少分为A、B 2组,但2组乳腺癌组织大小无明显差异,2组患者淋巴结转移个数存在明显差异的原因用现有的影像及检验学指标无法解释。临床工作中,笔者通过检测乳腺癌组织中ER、PR、CerbB-2、p53、Ki67的表达情况来指导患者进一步治疗方案及判断患者的预后。正常人的CerbB-2癌基因为非激活状态,部分乳腺癌患者的CerbB-2受体在细胞膜过度表达可以促进乳腺癌细胞的分裂、扩增,促进乳腺癌细胞的远处转移。ER、PR的表达是评估乳腺癌患者预后和预测激素治疗反应的参数。Ki-67为增殖细胞核抗原,是一种与细胞周期调控密切相关的蛋白质,其表达的变化可反映细胞的增殖能力,Ki-67的高表达一般预示肿瘤细胞扩增、侵袭、转移的能力较强,是乳腺癌患者预后不佳的原因。p53蛋白属于抑癌基因,正常情况下通过参与细胞周期来调节细胞增殖和分化,其与恶性肿瘤的产生、调控和凋亡等关系密切,其变异与乳腺癌发生有密切关系。p53蛋白表达阳性者淋巴结转移较多, 故目前研究认为p53蛋白表达上调提示乳腺癌患者淋巴结转移的可能性较大。本组结果显示2组患者在上述检测指标方面无明显差异。但2组患者在临床分期及淋巴结转移个数上有明显差异,而此差异对于患者预后来说有极大的影响。因此除p53、Ki67等癌细胞增殖性指标外,临床还需要一种新的病理学指标来直接评价乳腺癌组织与淋巴结转移之间的关系。本研究发现,A组Claudin-3表达明显低于B组,故认为Claudin-3表达的改变可能与乳腺癌的浸润与转移存在一定的相关性。
转移是恶性肿瘤的重要生物学特征。大多数癌症患者并非死于原发性癌而是死于转移性癌。肿瘤转移的机制非常复杂,涉及多种黏附因子、基质蛋白酶、细胞因子以及相应的信号传导机制和相关基因的改变。肿瘤前缘癌细胞从原发肿瘤分离之后,侵袭到周围的组织,分解细胞与细胞间紧密连接,改变细胞与基质的黏着部位,进行解离去极化,即EMT。通常EMT在正常的胚胎发育中起着重要作用,与恶性肿瘤细胞的侵袭和转移也密切联系。肿瘤前缘癌细胞为发生EMT的主要场所,其重要的表现为恶性肿瘤细胞的活化与细胞外基质的降解,其结果是最终仅有少数肿瘤细胞可以在周围组织中立足,局部形成新生血管,进而形成一个稳定的转移灶。这其中紧密连接的破坏在乳腺癌侵袭、转移的过程中发挥着重要的作用。
Claudin蛋白是由Tsukahara等[4]研究Claudin缺失的成纤维细胞时被发现和分离的,当时命名为Claudin-1和Claudin-2,迄今已有24个人类的Claudin家族成员被发现。Claudin蛋白属于跨膜蛋白,参与维持紧密连接的选择渗透性和细胞极化,其表达有高度的组织特异性,多种上皮性恶性肿瘤的发生、发展过程中往往存在着Claudin异常表达[5]。
研究表明,Claudin-3在许多上皮细胞肿瘤中表达上调,且其上调的幅度与肿瘤组织学分级、淋巴结转移呈正相关,故Claudin-3可作为临床判断恶性肿瘤患者预后的生物学标记[6]。Claudin-3作为紧密连接的主要跨膜蛋白,在细胞间传输物质能量的过程中起着重要的连接作用。有研究表明,Claudin-3 和Claudin-4 蛋白在卵巢癌细胞中的表达上调,其表达上调与卵巢癌细胞的淋巴结转移存在一定的相关性;Claudin-3蛋白在正常的卵巢上皮组织细胞中的表达极低甚至不表达,而在上皮性卵巢恶性肿瘤细胞中Claudin-3蛋白表达明显增高,且其上调的幅度与肿瘤组织学分级、淋巴结转移呈正相关,这种表达的差异具有统计学意义[7]。我国学者通过对胃癌组织的研究检测发现Claudin-1与Claudin-3的表达呈负相关,Claudin-3 表达上调可以使组织的完整性遭到破坏,使肿瘤细胞易于脱离原发灶,向远处转移,从而使肿瘤细胞的转移能力增强[8]。也有学者对前列腺癌和良性前列腺增生组织的Claudin-3的表达进行检测发现,Claudin-3 mRNA在前列腺癌和良性前列腺增生组织中表达水平有明显差异,其在前列腺癌的表达水平明显高于良性前列腺组织[9]。Claudin-3表达的上调可以增强恶性肿瘤细胞的侵袭力和生存力,而这种效应的产生可能与增强基质金属蛋白酶-2(MMP-2 ) 的活性有关。细胞外基质(ECM)是构成细胞基底膜主要成分的一类糖蛋白,是肿瘤细胞侵袭和转移过程中的组织屏障。基质金属蛋白酶家族(MMPs)是降解ECM和基底膜(BM)的主要执行者。MMPs对ECM的降解作用可以帮助活化的癌细胞EMT后发生内渗。MMP-2和是降解型胶原中最主要的溶解酶之一,不仅可以降解ECM,而且可以破坏BM。Szasz等[10]认为,在恶性乳腺癌组织中MMP-2的表达是明显增高的,如患者还伴有腋窝淋巴结转移则其激活比例更加明显。
Claudin-3是产气荚膜杆菌肠毒素(CPE)的受体, CPE与细胞表面蛋白Claudin-3结合后能诱导细胞溶解。应用CPE可以显著抑制鼠乳腺癌细胞的生长,这为乳腺癌的综合性治疗提供了更多的方法,对于预防、治疗乳腺癌的复发和转移提供新的方法及思路[11]。
总之,Claudin-3表达的异常与乳腺癌的淋巴结转移存在一定的相关性,可能对于乳腺癌的淋巴结转移起到促进作用。但Claudin-3在乳腺癌转移过程中参与的传导通路、调控因子至今仍不清楚,需要进一步实验研究证实。而CPE是否可以成为乳腺癌患者综合性治疗的一部分,仍需进行探索及临床观察。
[1] 伍时传. 乳腺癌改良根治术化疗后相关预后因素分析[J]. 中国医学工程,2014,22(1):166
[2] Bryan.T.Hennessy,Ana-Maria Gonzalez-Angulo,Katherin Stemke-Hale,et al. Characteriazation of a Naturally Occurring Breast Cancer Subset Enrich in Epithelial-to-mesenchymal Transition and Stem Cell Characteristics[J]. Cancer Research,2009,69(10):4116-4124
[3] 李家兵,李锦绣,姚惠. Claudin-3 mRNA在前列腺癌组织中的表达及意义[J]. 山东医药,2009,49(1):55-56
[4] Tsukahara M,Nagai H,Kamiakito T,et al. Distinct expression patterns of claudin-1 and claudin-4 in intraducatal papillary-mucinoustumors of the pancreas[J]. Pathology International,2005,55(2):63-69
[5] 孟冬梅,张俊会,郭云岭,等. 胃癌组织和胃癌细胞株中Claudin-6、CD44v6的表达及其临床意义[J]. 重庆医学,2013,2(4):167-173
[6] 李燕,秦蓉,王弦,等. 子宫颈上皮内癌变进展过程中claudin-1、3、4、7的表达及意义[J]. 临床与实验病理学杂志,2013,29(1):49-57
[7] 石彬,王振海,蒋玉萍,等. 卵巢上皮性癌中Claudine-3和MT-MMP基因的表达及其意义[J]. 现代妇产科进展,2006,12(9):665-668
[8] 刘志勇,欧阳忠. Claudin-1、2、3、4在胃癌中的表达[J]. 广东医学,2013,34(5):760-763
[9] 朱永锋,张春霆,张洪团,等. 组织芯片检测Claudine-3在前列腺癌中的表达[J]. 中国中西医结合外科杂志,2013,19(6):636-638
[10] Szasz AM,Tokes AM,Micsina M,et al. Prognostic significance of claudin expression changes in breast cancer with regional lymphnode netastasis[J]. Clin Exp Metastasis,2011,28(1):55-63
[11] 徐东,刘通. Claudin 蛋白与肿瘤关系的研究进展[J]. 实用临床医学,2010,11(9):130-133
Expression of tight junction protein Claudin-3 in breast cancer tissues and its clinical significance
Yao Yongqiang, Han Xue, Cao Mingqian, Fang Hong, Xie Jiping
(The Affiliated Zhongshan Hospital of Dalian University, Dalian 116001, Liaoning, China)
Objective It is to investigate the difference of Claudin-3 expression between breast cancer patients had different number of metastatic lymph nodes. Methods 128 breast cancer tissue specimens were divided into two groups according to the number of metastatic lymph nodes, the number of metastatic lymph nodes < 4 in Group A, and ≥4 in Group B, there were 64 cases in each group. The different expression of Claudin-3 in Group A and B were examined by RT-PCR and compared. Results The level of Claudin-3 was significantly lower in Group A than that in Group B, there was significant difference (P<0.05). There was no significant difference in patiens with different age, status of hormone receptor, CerB-2, p53, ki67 and histologial type (allP>0.05)。 Conclusion Increasing expression of Claudin-3 is associated with the metastasis of breast cancer and lead to poor prognosis
breast cancer; Claudin-3; lymph nodes metastasis
姚永强,男,副主任医师,副教授,从事甲状腺及乳腺疾患的诊疗与研究。
10.3969/j.issn.1008-8849.2014.30.008
R737.9
A
1008-8849(2014)30-3329-03
2014-02-05

