延迟亚低温治疗对大鼠脑出血后出血灶周围水肿形成的影响
赵军苍,刘晓红,苏钰清,杨华堂,王献明
(河北省邯郸市中心医院,河北 邯郸 056001)
延迟亚低温治疗对大鼠脑出血后出血灶周围水肿形成的影响
赵军苍,刘晓红,苏钰清,杨华堂,王献明
(河北省邯郸市中心医院,河北 邯郸 056001)

目的 评估延迟脑低温(BH)(35 ℃)对脑出血(ICH)48 h后脑水肿形成的影响。方法 将Sprague-Dawley大鼠分为亚低温组(HT组)及常温组(NT组),将100 μL大鼠自体血注入基底节诱导ICH。HT组ICH发生后3,6,12,24 h分别进行亚低温处理,分别作为HT3、HT6、HT12、HT24组。检测比较各组ICH后48 h脑组织含水量。比较NT组(37 ℃,n=7)及HT6组血脑屏障通透性、DNA氧化损伤及行为学缺损评分的差异。结果 单侧基底节区脑组织水含量各亚低温组均明显少于NT组(P均<0.01)。与NT组相比,HT6组单侧基底节血脑屏障破坏明显减少(P<0.05)。在接受BH处理的大鼠中,提取出血侧半球DNA的8-OHdG水平明显低于NT组(P<0.05)。此外,ICH后48 h, HT6组大鼠前肢放置试验评分明显优于NT组(P<0.05)。结论 延迟BH治疗能够显著减轻ICH后的脑水肿。BH主要通过减轻血脑屏障功能损害、减轻炎性反应、减轻DNA的氧化应激损伤实现其神经保护功能。
脑水肿;脑部低温;脑出血;氧化应激损伤
自发性颅内出血(ICH)致死率高达30%~40%,占急性脑卒中的20%~30%,患者的神经功能缺损情况通常也比较严重[1]。在ICH发病后,由于血肿的占位效应及血肿引起的一系列炎症反应,脑组织将受到明显损伤,继发性的脑水肿形成进一步导致脑组织损伤及细胞死亡[2]。MacLellan等[3]指出将自体血液注射至大鼠纹状体产生ICH后1~4 h开始进行亚低温治疗,能够减少脑水肿形成及血脑屏障的紊乱,减少炎性细胞的渗透。目前亚低温治疗多在患者发病12 h内进行,能够减少ICH的继发性损伤,如脑水肿、血脑屏障损害、炎症及出血灶周围的氧化应激损伤。因为血肿周围组织损伤自ICH发生后逐渐进展,故本研究探讨了ICH后延迟的亚低温治疗(ICH发病超过12 h)对脑水肿形成、血脑屏障的通透性、炎性反应、DNA氧化应激性损伤及大鼠行为学损伤的影响,现报道如下。
1 实验资料
1.1 动物准备及颅内血液注射 选择250~400 g的成年雄性Sprague-Dawley大鼠34只,腹膜内注射苯巴比妥钠(60 mg/kg)进行麻醉。使用PE-50导管插入股动脉以检测动脉压及获得研究血气、pH、血细胞密度及血糖的动脉血。手术期间将大鼠体温维持在37 ℃。在左侧冠状缝距离中线3 mm处进行无菌钻孔,在立体导向的指引下,将钝的计量注射针插入左侧基底节。再使用微注射泵将100 μL大鼠自体全血以20 μL/min速率注入。自体血注入完成后,快速拔出针并在钻孔周围涂抹氰基丙烯酸酯粘合剂,缝合皮肤切口。术后将大鼠随机分为常温组(NT组,n=7)及亚低温组(HT组)。将NT组大鼠放置于温度保持在25 ℃的养育箱中48 h,HT组大鼠放置于温度保持在5 ℃的养育箱中,ICH诱导后3,6,12,24 h进行亚低温处理,分别作为HT3组(n=4)、HT6组(n=6)、HT12组(n=12)、HT24组(n=24)。将针样遥感测温探针插入冠状缝6 mm深处测量置于25 ℃及5 ℃养育箱中大鼠的脑部温度,监测48 h。
1.2 大脑水含量的测量 ICH 48 h后,使用苯巴比妥对大鼠进行深度麻醉,断头处死大鼠。快速去除脑组织,从距离额极3 mm处切2个厚度为3 mm的切片。前片(A片)包含位于基底节区的穿刺针的轨迹及动脉血注射点,相邻的一片(B片)是动脉血注射点后方的部分。沿正中线将脑切片分为左右半球两部分,将每侧皮质与基底节区分离,将位于基底节的血肿与周围组织分离。记录样品组织的湿质量(WW),精确到0.1 mg。之后将样品组织烘干测量干质量(DW)。公式(WW-DW)/WW×100%用于计算大脑水含量。
1.3 血脑屏障通透性 使用伊文思蓝(EB)测量血脑屏障的完整性。在诱导ICH 48 h后,将EB溶液静脉注入大鼠体内,30 min后将大鼠使用苯巴比妥钠麻醉。将胸腔打开,经左心室以100 mmHg(1 mmHg=0.133 kPa)的压力注入200 mL盐水直到没有带颜色的液体从右心房流出。大鼠断头处死后,快速去除脑组织,从距离额极3 mm处切2个厚度为3 mm的切片。前片(A片)包含位于基底节区的穿刺针的轨迹及动脉血注射点,相邻的一片(B片)是动脉血注射点后方的部分。沿正中线将脑切片分为左右半球两部分,将每侧皮质与基底节区分离,将位于基底节的血肿与周围组织分离。称量样品质量,将其放置于50%三氯乙酸溶液中,匀化并离心后,将离心染液使用乙醇稀释(1∶3),使用分光计进行荧光观察。计算组织所含EB的量。
1.4 DNA中8-OHdG含量 DNA容易受到氧化应激损伤。8-OHdG是细胞内氧化应激的敏感标志物[4]。提取DNA后,使用酶联免疫吸附试验测定8-OHdG的水平。
1.5 行为学测验 对所有大鼠进行前肢放置试验评分[5]。
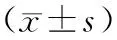
2 结 果
2.1 大脑的水含量 大脑亚低温处理可显著抑制A切片中单侧基底节区及皮质脑水肿的形成。在临近A切片的B切片中,大脑亚低温处理也显著抑制基底节区及皮质的脑水肿,在HT各组之间,大脑水含量没有统计学差异。见表1。
2.2 血脑屏障对EB的通透性 在A切片的单侧基底节区,与NT组相比,BH能够明显保护血脑屏障被破坏,但在A切片的单侧皮质区,没有观察到BH的这种效应。在临近B切片的单侧基底节区及皮质区,BH能够明显保护血脑屏障被破坏。见表2。
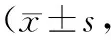
表1 各组单侧基底节区及皮质大脑的水含量比较%)
注:①与相应切片NT组比较,P<0.05。

表2 NT组和HT6组血脑屏障对EB的通透性
注:①与NT组比较,P<0.05;②与NT组比较,P<0.01。
2.3 DNA中8-OHdG含量 在接受BH处理的大鼠中,提取出血侧半球DNA的8-OHdG水平,HT6组为(41±8)pg/μg,明显低于NT组的((91±17)pg/μg(P<0.05)。对侧半球提取DNA的8-OHdG水平2组之间差异无统计学意义。
2.4 大鼠行为学评分 ICH后48 h, HT6组大鼠前肢放置试验评分明显优于NT组,但是ICH后24 h,2组的前肢放置试验评分差异无统计学意义。见表3。

表3 NT组和HT6组大鼠行为学评分
注:①与NT组比较,P<0.05。
3 讨 论
ICH后脑水肿的机制到目前为止并不明确[2]。有理论认为血肿的占位效应压迫大脑,导致被压区域组织微循环紊乱,缺血缺氧,最终出现血肿周围脑组织水肿[3]。但是,目前没有研究结果表明血肿的占位效应所导致低灌注的程度或持续时间足以产生缺血性脑损伤。研究者开始把注意力放在从血肿中释放出的导致脑水肿的生化物质上。ICH后脑水肿的形成主要包括2个时期:急性期(ICH后2 d),为凝血级联反应的激活,血块形成;亚急性期(ICH后3 d),为红细胞崩解及血红蛋白诱导的神经细胞毒性。血肿能够破坏血脑屏障的完整性并直接导致脑实质细胞死亡[6]。铁是血红蛋白的降解产物,大脑内铁超载会引起自由基的形成及氧化损伤,如ICH后的脂质过氧化反应[7]。炎性反应包括白细胞累积及脑实质补体系统的激活,均在与ICH相关脑水肿的形成中起重要作用[8]。
MacLellan等[3]使用向基底节区注射自体全血的ICH大鼠模型进行研究,发现在建模成功后1 h或4 h开始BH处理,均能够减轻脑水肿、血脑屏障功能紊乱及炎性细胞的渗透。本研究结果表明ICH后3~24 h内开始BH处理对ICH大鼠均有神经保护作用,与NT组相比,大鼠ICH后脑水肿的形成明显受到抑制,这提示延迟的亚低温治疗对ICH后脑水肿的形成仍是有效的;而且ICH后6 h进行BH处理能够减少病灶处DNA的氧化损伤,改善大鼠行为功能缺损。这些效应并不是BH的生理学作用结果,因为在所有大鼠未发生ICH的对侧大脑半球中,未发现上述结果,这提示HT本质上没有影响正常脑组织中水含量及DNA的氧化损伤。本研究所使用的ICH动物模型,早期有研究表明基底节区的脑水肿在ICH后24 h逐渐形成,大约4 d后才会逐渐消退[9]。ICH后24 h使用BH处理,能够迅速减轻大鼠血脑屏障损伤[10]。所以在本研究中,将HT的处理时间选定为24 h,在早期脑水肿形成阶段对其进行干预。之前有研究指出在缺血及创伤性脑损伤中,BH的治疗时间窗很窄[11-12]。但是,根据笔者的实验结果,ICH后3~24 h使用BH处理,均能够限制基底节区的血管源性水肿,这种效应的作用机制可能是BH治疗改善血肿周围区域血脑屏障损伤,并减少了DAN氧化应激损伤,从而改善了大鼠行为学功能缺损。
ICH及缺血的继发性损伤有很多共同机制,包括炎症、水肿及氧化应激等,ICH后早期的BH治疗能够减轻ICH大鼠模型血脑屏障的通透性损伤、PMN白细胞积累及脑水肿[13-14]。但MacLellan等[3]指出,在胶原酶诱导的ICH模型中,建模成功后立即开始BH处理,无法减轻脑组织损伤或行为学缺损。该结果可能与BH的不良反应有关(如血压升高及凝血功能紊乱等),这些不良反应能够与BH对早期ICH的益处相抵消。随后,他们提出在胶原酶诱导的ICH模型中,建模成功后12 h开始BH处理,大鼠的行为学缺损有明显改善,脑组织损伤也明显减少,因为在ICH发病后短时间进行BH内容易加重出血[15]。
本研究存在一些不足之处:没有判定延迟的BH对ICH大鼠的神经保护作用是否为长期存在的;本研究并没有明确精准的BH治疗ICH的时间窗。在设计本研究时,将最晚的时间设定为ICH后24 h,因为如果BH处理在晚于ICH后24 h开始,将不能缓解 ICH早期脑损伤。有关延迟BH(ICH发生后2~3 d)是否能够减轻自体血注射诱导的ICH大鼠模型的脑水肿还需要进一步研究。
总的来说,BH能够显著降低ICH后的脑水肿,即使在ICH后24 h才进行BH治疗。BH能够减轻血脑屏障功能损害、炎性反应、DNA的氧化应激损伤。
[1] 吴江. 神经病学[M]. 北京:人民卫生出版社,2005:170
[2] Xi G,Keep RF,Hoff JT. Mechanisms of brain injury after intracerebral hemorrhage[J]. Lancet Neurol,2006,5:53-63
[3] MacLellan CL,Davies LM,Fingas MS,et al. The influence of hypothermia on outcome after intracerebral hemorrhage in rats[J]. Stroke,2006,37:1266-1270
[4] Kasai H,Crain PF,Kuchino Y,et al. Formation of 8-hydroxyguanine moiety in cellular DNA by agents producing oxygen radicals and evidence for its repair[J]. Carcinogenesis,1986,7:1849-1851
[5] Hua Y,Schallert T,Keep RF,et al. Behavioral tests after intracerebral hemorrhage in the rat[J]. Stroke,2002,33:2478-2484
[6] Lee KR,Kawai N,Kim S,et al. Mechanisms of edema formation after intracerebral hemorrhage:Effects of thrombin on cerebral blood flow,blood-brain barrier permeability,and cell survival in a rat model[J]. J Neurosurg,1997,86:272-278
[7] Wagner KR,Sharp FR,Ardizzone TD,et al. Heme and iron metabolism:Role in cerebral hemorrhage[J]. J Cereb Blood Flow Metab,2003,23:629-652
[8] Gong C,Hoff JT,Keep RF. Acute inflammatory reaction following experimental intracerebral hemorrhage in rat[J]. Brain Res,2000,871:57-65
[9] Yang GY,Betz AL,Chenevert TL,et al. Experimental intracerebral hemorrhage:Relationship between brain edema, blood flow, and blood-brain barrier permeability in rats[J]. J Neurosurg,1994,81:93-102
[10] Smith SL,Hall ED. Mild pre-and posttraumatic hypothermia attenuates blood-brain barrier damage following controlled cortical impact injury in rat[J]. J Neurotrauma,1996,13:1-9
[11] Yanamoto H,Hong SC,Soleau S,et al. Mild postischemic hypothermia limits cerebral injury following transient focal ischemia in rat neocortex[J]. Brain Res,1996,718:207-211
[12] Markgraf CG,Clifton GL,Moody MR. Treatment window for hypothermia in brain injury[J]. J Neurosurg,2001,95:979-983
[13] Nakamura T,Keep RF,Hua Y,et al. Deferoxamine induced attenuation of brain edema and neurological deficits in a rat model of intracerebral hemorrhage[J]. J Neurosurg,2004,100:672-678
[14] Nakamura T,Keep RF,Hua Y,et al. Oxidative DNA injury after experimental intracerebral hemorrhage[J]. Brain Res,2005,1039:30-36
[15] MacLellan CL,Girgis J,Colbourne F. Delayed onset of prolonged hypothermia improves outcome after intracerebral hemorrhage in rats[J]. J Cereb Blood Flow Metab,2004,24:432-440
Delayed hypothermia on perihemorrhagic edema after intracerebral hemorrhage in rats
Zhao Juncang, Liu Xiaohong, Su Yuqing, Yang Huatang, Wang Xianming
(Handan Central Hospital, Handan 056001, Hebei, China)
Objective It is to evaluate the effect of delayed brain hypothermia (BH) (35℃) on brain edema formation 48 hours after intracerebral hemorrhage (ICH). Methods After the injection of 100μL of autologous blood into the basal ganglia to induce ICH in Sprague-Dawley rats, the rats were divided into two groups: hypothermia group (HT) and normal temperature group (NT). BH was started 3, 6, 12, and 24 hours after ICH in HT group which were divided into HT3, HT6, HT12 and HT24 group. Water content in cerebral tissue in every group in 48h after ICH was detected and compared, blood-brain barrier (BBB) permeability, and oxidative DNA damage in the lesion were compared between normothermic (NT) (37 ℃,n=7) and HT6 rats 48 hours after ICH. Finally, neurologic recovery was assessed using behavioral tests in NT and HT6 rats 48 hours after ICH. Results Brain water content in the ispilateral basal ganglia was significantly reduced in each HT subgroup compared with NT (P<0.01). The BBB disruption to Evans blue was significantly reduced with BH (HT6) compared with NT rats in the ipsilateral basal ganglia (P<0.05). HT treatment also significantly reduced oxidative DNA damage determined with 8-hydroxyl-2'-deoxyguanosine compared with NT treatment (P<0.05). Furthermore, HT6 treatment significantly improved neurologic recovery assessed with forelimb placing score compared with NT treatment (P<0.05). Conclusion Delayed BH can significantly reduce the brain edema formation after ICH, several neuroprotective mechanisms including reduced BBB disruption, inflammation and oxidative damage are suggested in this study.
brain edema; brain hypothermia; intracerebral hemorrhage; oxidative damage
赵军苍,男,主治医师,主要从事神经外科临床诊治和研究工作。
10.3969/j.issn.1008-8849.2014.13.008
R-332
A
1008-8849(2014)13-1389-03
2013-11-04

