CO2对赤泥的脱钠处理实验研究
纪志军,李士琦,张长春,唐小辉
(北京科技大学 冶金与生态工程学院,北京 100083)
CO2对赤泥的脱钠处理实验研究
纪志军,李士琦,张长春,唐小辉
(北京科技大学 冶金与生态工程学院,北京 100083)
基于对某铝厂赤泥的基础特性研究,进行了脱钠的热力学和动力学分析,采用温室气体CO2对赤泥进行了脱钠正交实验,以脱钠率为研究指标,分析了液固比、脱钠时间、脱钠次数对脱钠率的影响。实验结果分析表明,赤泥的液固比为2和4时脱钠率较高,但考虑到实际情况和实验误差取液固比为2作为最佳值;脱钠时间对脱钠率不显著,所以取脱钠时间最短20 min;脱钠次数对脱钠率有显著影响,脱钠次数为最多的3次,可保证脱钠率最高,但考虑到实际情况、后续处理及避免浪费水资源,脱钠次数定为2次。研究证明,该处理工艺既可将赤泥无害化,又可降低温室气体排放,并可进一步回收NaHCO3,有利于资源的循环利用。
赤泥;脱钠;正交实验
赤泥是氧化铝生产过程中产生的废渣,自20世纪90年代以来,我国冶金工业发展迅速,目前我国氧化铝生产量已居世界第一。 生产氧化铝的同时产生了巨量冶金废渣等固体废弃物,按每生产1 t氧化铝要排放1~2 t的赤泥,我国赤泥堆存量已非常大,预计2015年达到4亿t[1]。 赤泥中含有较高的Na2O,是其作为废弃物潜在的最大污染源,且Na2O的存在也不利于资源化利用[2]。目前国内外常用的赤泥脱碱方法有:石灰脱碱法、酸浸法、盐浸出法、工业“三废”中和等方法[3-7]。 笔者使用温室气体CO2对赤泥进行脱钠,可将其中有“毒”的苛性钠转变为NaHCO3,赤泥pH值由10以上降至中性,实现赤泥的去“毒”无害化处理;另一方面CO2来源广泛,该方法可吸收温室气体降低CO2排放量,且可对脱钠后所得NaHCO3溶液进行回收固体NaHCO3。与传统生石灰脱碱工艺相比,采用酸性废气进行脱碱处理具有操作简便、脱碱率高、无废弃物排放等优点,一方面可以降低酸性废气的排放,同时也可促进赤泥废弃物的综合利用。
1 赤泥的基础特性分析
赤泥是呈灰色和暗红色粉状物,颜色会随含铁量的不同发生变化,它具有较大内表面积多孔结构[8],其比重为2 840~2 870 kg/m3,含水量(质量分数)86.01%~89.97%,饱和度94.4%~99.1%,持水量79.03%~93.23%,塑性指数17.0~30.0,粒径d=0.075~0.005 mm的颗粒含量占90%左右;比表面积64.09~186.9 m2/g,孔隙比2.53~2.95。本实验所使用的某铝厂高铁赤泥颜色呈红褐色,潮湿状态下为块状,质地较硬,不易破碎,不溶于水,烘干后的赤泥堆密度为0.88 g/cm3。通过进行粒度分析、XRF分析和XRD分析,对赤泥的基础特性进行全面了解。
1.1 粒度分析
为确定赤泥的粒度分布情况,使用型号为LMS-30的激光衍射散射式粒度分布测定仪进行测定。
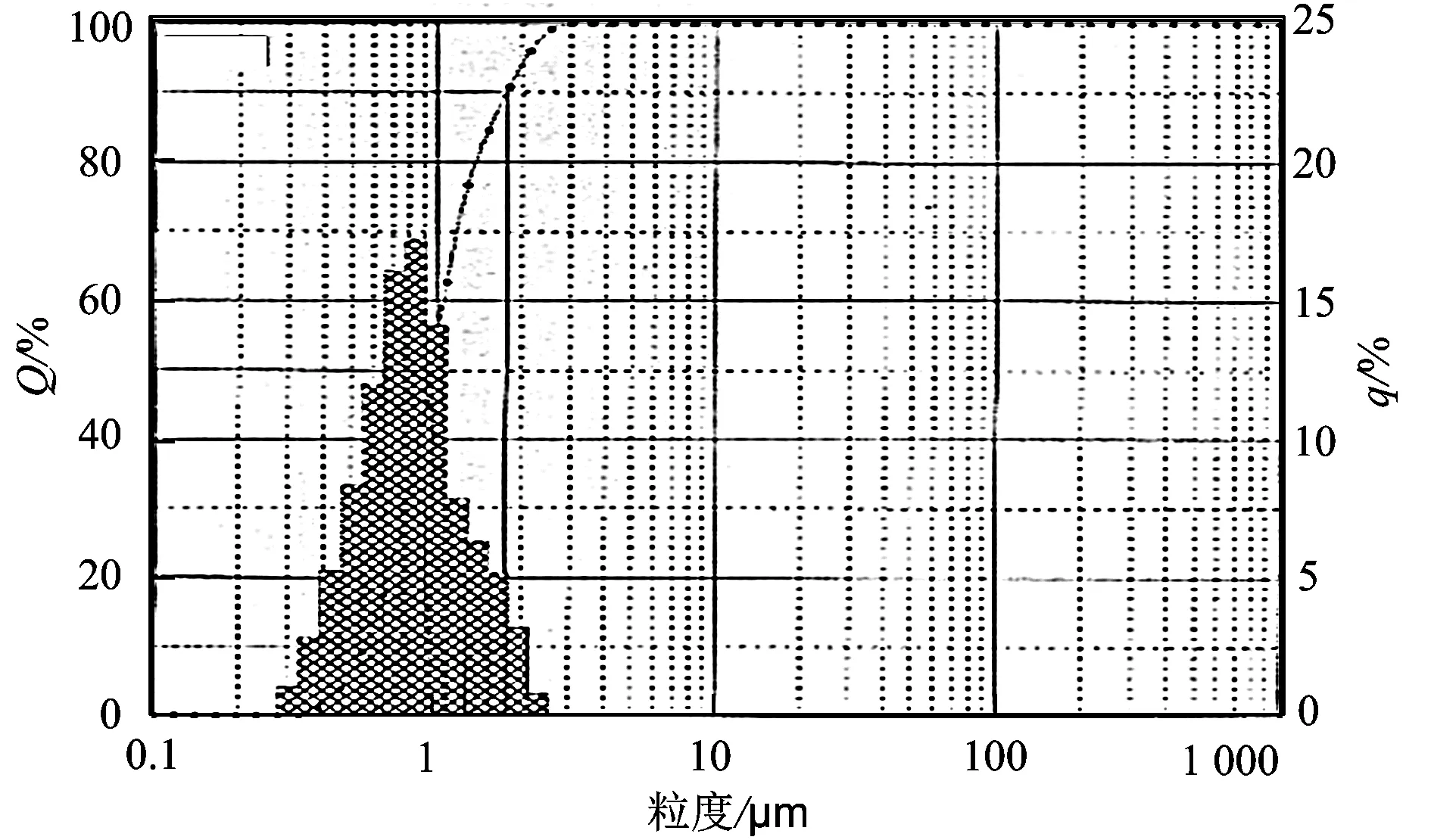
q—粒度分布;Q—累积分布
采用数秒间隔测定方法,对赤泥的粒度分布情况进行检测,其粒度分布情况如图1所示。可以直观看出,该赤泥的粒度分布范围是0.46~32.78 μm,分散度较宽,中值为2.55 μm.
1.2 XRF分析
为初步确定赤泥的化学组成,使用型号为岛津XRF-1800的XRF-荧光分析仪对赤泥进行全元素的定性半定量分析。
赤泥中多数元素均以氧化物形式存在,故选择标准氧化物法分析方式,测得主要元素氧化物的质量分数,并将分析结果折算成各元素的百分含量,结果如表1所示。
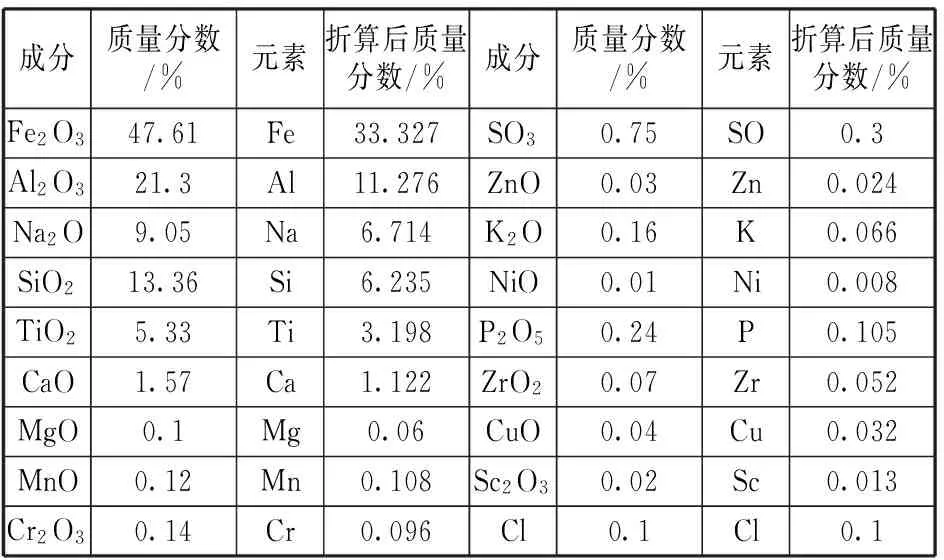
表1 赤泥XRF-荧光分析结果
由赤泥的XRF-荧光分析结果可以直观看出:赤泥主要由Fe、Al、Si、Na的氧化物组成,伴随少量Ti、Ca、Mg、Zn等元素的氧化物;其中Fe元素的质量分数达到33.33%、Al元素的质量分数达到11.28%,Na元素的质量分数达到6.72%,具有较高的Fe元素以及碱回收价值。
1.3 XRD分析
赤泥是一种复杂的混合物,其中含有多种元素,各种元素往往又存在多种价态,不同元素之间常相互结合形成复杂化合物,为确定赤泥中Fe、Na等主要元素的存在形式,使用型号为LMS-30的X射线衍射仪对赤泥进行了XRD检测。
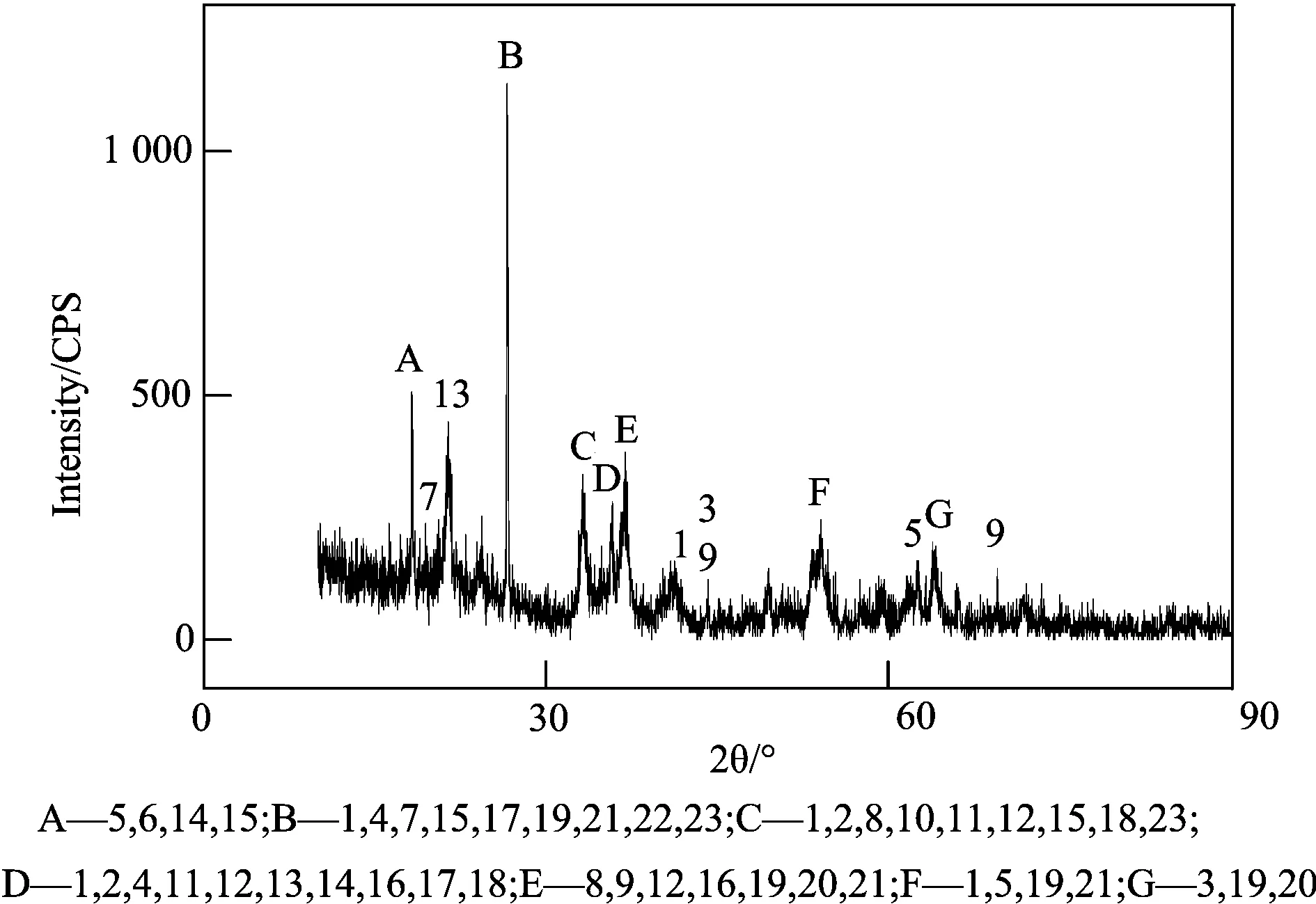
1—Fe2O3,2—Fe3O4,3—FeO,4—FeO(OH),5—Al2O33H2O,6—Al(OH)3,7—SiO2,8—Na2SiO33H2O,9—Fe2SiO4,10—Na2O,11—NaOHH2O,12—NaAlO2,13—NaAlSiO4,14—Na1.15Al1.15Si0.85O4,15—NaAl2(AlSi3)O10(OH)2,16—TiO,17 TiO2,18—Fe(TiO3),19—Fe2Ti3O9,20—CaO,21—CaTi4O9,22—C,23 Na2CO3
如图2,由赤泥的XRD检测结果可以看出:赤泥中Fe元素主要以Fe2O3及FeO(OH)的形式存在;Na元素主要以Na2SiO3·3H2O、NaAlO2、NaAlSiO4的形式存在。
总结可知本文研究的赤泥颜色呈红褐色,潮湿状态下为块状,质地较硬,不易破碎,不溶于水,含有约18%的自由水;赤泥粒度分布范围是0.46~32.78 μm,分散度较宽,中值为2.55 μm;赤泥主要由Fe、Al、Si、Na的氧化物组成,其总质量分数占90%以上。 Fe、Al元素含量较高,都有较高的回收利用价值;由XRD分析结果表明,赤泥中Fe元素主要以Fe2O3及FeO(OH)的形式存在;Na元素主要以Na2SiO3·3H2O、NaAlO2、NaAlSiO4的形式存在。
2 赤泥脱钠原理
赤泥中的苛性碱一方面容易造成环境的污染;另一方面,高Na2O含量会造成赤泥不能直接用作钢铁生产原料,同时也不能够满足常见无机非金属材料制备的原料要求。因此,Na2O的脱除是赤泥资源利用的必要环节。下面从热力学分析和动力学分析探讨赤泥脱钠的原理。
2.1 热力学分析
在水热反应条件下,赤泥的附着碱溶解于反应溶液中,并在赤泥颗粒表面与水相溶液之间形成一种亚稳态碱溶解平衡。当CO2进入反应体系中,与溶液中的碱发生反应后,这种平衡被破坏,造成了液固界面与溶液中碱量的浓度差,迫使赤泥的附着碱不断进入反应体系中进行脱钠反应,最终完成脱钠过程。
赤泥的脱钠属于气、液、固三相反应。研究采用CO2对赤泥进行脱钠,CO2是酸性气体,入水后形成H2CO3。赤泥中的铝酸钠(Na2O·Al2O3)、碳酸钠(Na2CO3)、氢氧化钠(NaOH)、硅酸钠铝(NaAlSiO4) 、硅酸钠(Na2O·Al2O3·1.7SiO2·nH2O)等在溶液中发生电离,能够电离出的离子与H2CO3反应。下面是在整个工艺过程中涉及到的化学反应及相应的平衡常数,在标准态条件下,各反应进行的平衡常数如表2所示[9-10]。
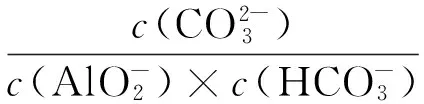
(1)
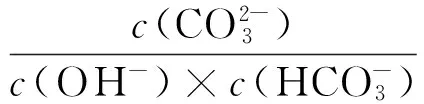
(2)
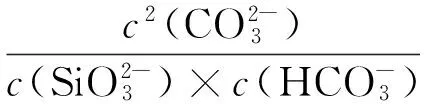
(3)
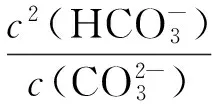
(4)

表2 各反应在标准态下的平衡常数
平衡常数大于1则满足反应条件,当平衡常数越大时,反应越容易进行。由表2中数据可以看到,各反应的平衡常数均在1以上,在室温条件下赤泥中含钠物质和CO2的反应进行能够满足热力学条件要求。通过计算平衡常数值,得到了在赤泥脱钠反应过程中,各碱性物质参与反应的先后顺序和难易程度。计算表明,CO2溶于水主要以HCO3-的形式存在,而与之反应容易程度依次是OH-,AlO2-,SiO32-,而Na2O·Al2O3·1.7SiO2·nH2O由于不溶于水而不参加反应。
2.2 动力学分析
根据经典双模理论的分析[11],CO2的分压作总推动力,分别消耗在气、液界面的气膜侧、液膜侧、液固界面液相侧和化学反应上。而液相反应物碱的质量分数作推动力则分配在克服液固传质阻力和进行化学反应上。气、液、固三相反应的这一碳化过程包括以下5个步骤:
1) 气相CO2溶于水并通过气膜向气液界面、液相主体和液固界面扩散并传质;
2) 固相赤泥中的碱溶解通过固液界面进入液相主体;
3) 液相主体中的碱向气液界面扩散传质;
4) 液相主体和液膜内的反应物CO2与碱的对流和扩散;
5) 液相主体和液膜内反应物CO2与碱发生化学反应。
由于前4步反应不会造成空间上的质量分数差异,化学反应速率主要取决于反应体系中碱(主要为钠盐)的质量分数和CO2分压。理论上这是一个不可逆的二级反应,反应各阶段各反应物的质量分数存在巨大差异,所以反应的速率方程采用拟一级反应模型。
r=k·c.
(5)
式中:r为反应速率,mol/(S·L);k为与CO2气体的传质有关的宏观速率常数,s-1;c为液相主体中决定反应控制步骤的反应物的浓度,mol/L。
3 赤泥脱钠试验
3.1 实验方案
采用正交实验设计重点考察液固比、脱钠时间、脱钠次数对高铁赤泥脱钠效果的影响。本文选取液固比、脱钠时间、脱钠次数为主要研究对象,考察不同因素对赤泥脱钠的影响,找出脱钠的最佳条件。正交试验因素水平如表3所示。根据实际经验判断各交互作用可忽视,利用正交表L9(34)作33因子试验的1/3实施,其中L9(34)正交表表头设计略[12]。

表3 因素水平表
3.2 脱钠实验装置和步骤
3.2.1实验装置
实验设备的示意图如图3所示。实验仪器包括:烧杯,CO2气瓶,流量计,漏斗,玻璃棒,量筒,电子秤,过滤瓶,pH计。
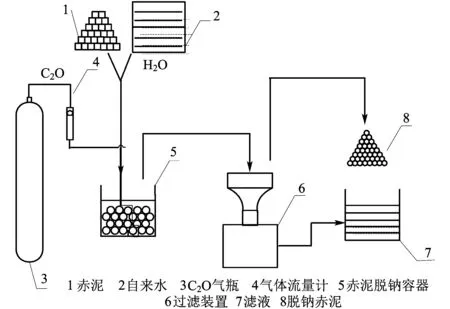
图3 脱钠流程示意图
3.2.2实验步骤
1) 每次实验称取赤泥样品30 g,将称量好的样品放入烧杯中,用量筒按液固比称量水倒入烧杯;
2) 对样品进行搅拌,使其混合均匀;
3) 按规定的时间通入CO2气体,气体流量为1.2 L/min;
4) 通气结束后,把烧杯残留物过滤;
5) 将分离所得的赤泥放在烘箱内烘干;
6) 烘干后的赤泥经研磨后进行荧光分析,得到脱钠后赤泥测量残留物的成分。
3.3 实验结果
在反应温度为25℃下,按照上述步骤进行实验。正交实验结果以脱钠率为指标, 结果列于表4。
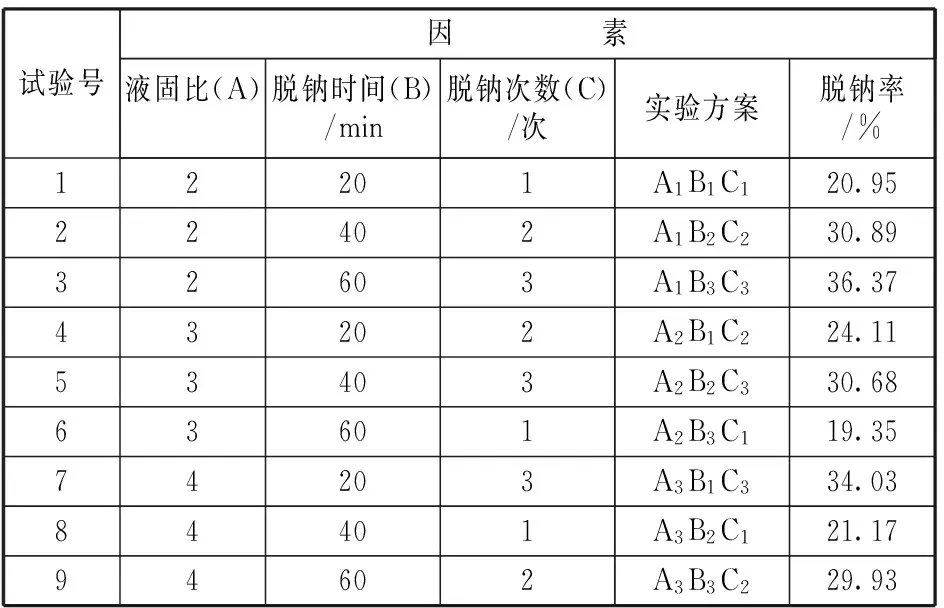
表4 脱钠结果
3.4 分析与讨论
由表4可以看出,脱钠次数越多,脱钠率越高,脱钠时间对脱钠率的影响也较大。 为分析各因素分别对金属化率的影响情况,对实验结果分别进行方差分析和主效应分析。
对脱钠正交试验分别进行方差分析、相关分析、主效应分析,以得到各个因素对试验指标的影响情况,确定出因素的主次顺序,找出较好的生产条件或者最优参数组合。
3.4.1方差分析
对表4的实验结果进行方差分析,方差分析结果列于表5。
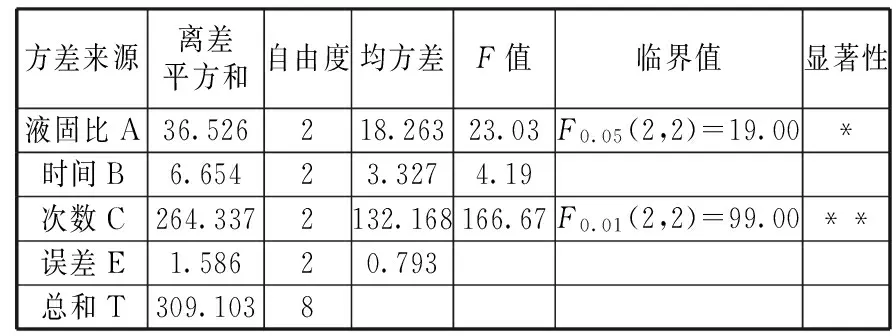
表5 方差分析结果
由表5可以看出,在本实验研究范围内,因子A(液固比)对脱钠率有较为显著的影响,因子B(脱钠时间)对脱钠率影响不显著,因子C(脱钠次数)对脱钠率有非常显著的影响。
3.4.2主效应分析
各因子对脱钠率影响的主效应分别列于表6和图4所示。
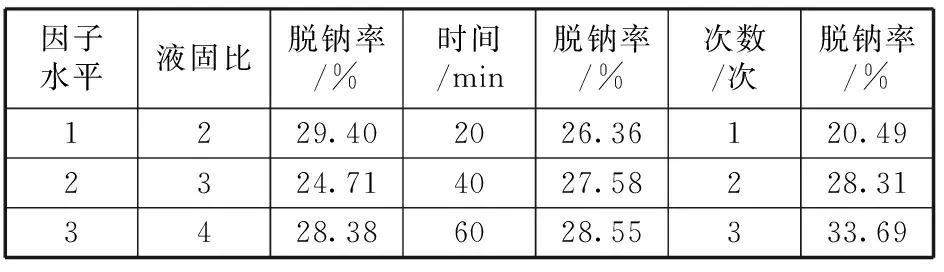
表6 主效应分析
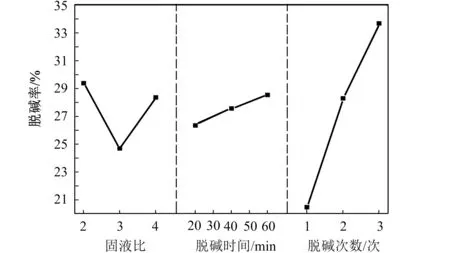
图4 各因子对脱钠率影响的主效应图
由各因子的主效应分析可以看出:
1) 当液固比很大时,由于固相溶质浓度较大,占据了液相反应主体的大部分空间,导致气相反应物进入反应主体的难度加大,从而在一定程度上减小了气液接触的比表面积,影响了气液传质过程。当液固比很小时,随着搅拌的进行,虽然减小了气液界面液膜侧的阻力,增大了气体向液相主体的传质,但是由于单位反应体系中固相溶质的浓度减少了,回收反应的速率反而会降低,进而影响了碱的回收率。因子A(液固比)取第1水平(液固比为2)和第3水平(液固比为4)时脱钠率较高,但考虑到实验误差、后续水处理及避免浪费水资源,取第1水平(液固比为2)作为最佳值。
2) 反应时间很低时,钠盐溶解不完全,同时CO2进入碳化反应体系中的量较少,最终导致碱的回收率低。反应时间很长时,钠盐已全部转化,在浪费原料气的同时增加了设备负荷,增大了能耗和成本。经60 min脱钠与20 min脱钠相比,脱钠率仅高2.19%,由于因子B(脱钠时间)对脱钠率不显著,所以取脱钠时间最短的第1水平(20 min),可以缩短时间。
3) 脱钠次数越高,脱钠率越高。每一次脱钠后的赤泥中的碱都会被带走一部分,所以脱钠次数越高越好,但由于考虑到时间因素和后期处理的负担,脱钠次数不能太多. 因子C(脱钠次数)越多,脱钠率越高,且脱钠次数对脱钠率有明显显著影响,C取第三水平(3次)脱钠率最高,但考虑到实际情况,为避免给后续步骤得到钠盐而蒸发大量水的缘故,脱钠次数为2次也可以。
4) 综合1)2)3)得最佳脱钠条件是A1B1C3,即液固比为2,脱钠时间为20 min,脱钠次数为3次。
4 结论
1) 赤泥中 Fe、Al元素含量较高,都有较高的回收利用价值,其中 Na元素主要以Na2SiO3·3H2O、NaAlO2、NaAlSiO4的形式存在。
2) 当赤泥浆中初始通入CO2时,赤泥碱度迅速下降,赤泥迅速和CO2发生中和反应,赤泥浆的碱度降低,反应后,溶液中主要为反应产物Na2CO3,以及NaAlO2、Na2SiO3等弱碱性物质。
3) 实验结果表明,液固比为2和液固比为4时脱钠率较高,但考虑到实验误差、后续水处理及避免浪费水资源,取液固比2作为最佳值。
4) 脱钠时间对脱钠率不显著,所以取脱钠时间最短20 min,缩短时间。
5) 脱钠次数越多,脱钠率越高,且脱钠次数对脱钠率有明显显著影响,所以脱钠次数取3次,保证脱钠率最高,但考虑到实际情况,为避免给后续步骤得到钠盐而蒸发大量水的缘故,脱钠次数为2次也可以。
[1] 姜玉敬.近30年世界铝电解工业的发展与启示[J].世界有色金属,2010(11): 15-18.
[2] 刘福刚.赤泥综合利用技术应用回顾和展望[J].化学工程师,2011(6): 45-46.
[3] 何润德,张念炳,黎志英,等.添加石灰处理纯碱烧结法赤泥的研究[J].贵州工业大学学报(自然科学版),2004,33(3): 7-9.
[4] 王云山,杨刚,张金平.氧化铝工业产出赤泥脱钠新工艺[J].有色金属,2010,62(3): 61-64.
[5] 陈利斌,张亦飞,张懿.亚熔盐法处理铝土矿工艺的赤泥常压脱碱[J].过程工程学报,2010,10(3): 470-475.
[6] 南相莉,张廷安,吴易全,等.拜耳赤泥吸收低浓度二氧化硫的研究[J].东北大学学报(自然科学版),2010,31(7): 986-989.
[7] Paradis M, Duchesne J, Lamontagne A, et al.Long-term neutralization potential of red mud bauxite with brine amendment for the neutralization of acidic mine tailings[J].Applied Geochemistry, 2007, 22(11): 2326-2333.
[8] 景英仁,景英勤,杨奇.赤泥的基本性质及其工程特性[J].轻金属,2001(4):20-23.
[9] Vishwajeet S,Murari P,Jeeshan K,et al.Sequestration of carbon dioxide (CO2)using red mud[J].Journal of Hazardous Materials,2010,176(1-3): 1044-1050.
[10] MontesHernandeza G,Perez-Lopeza R,Renardc F,et al.Mineral sequestration of CO2by aqueous carbonation of coal combustion fly-ash[J].Journal of Hazardous Materials,2009,161(2-3): 1347-1354.
[11] 张先棹.冶金传输原理[M].北京:冶金工业出版社,2004.
[12] 任露泉.试验设计及其优化[M].北京:科学出版社,2009.
(编辑:刘笑达)
ExperimentalStudiesonSodiumRemovalofRedMudbyCO2
JIZhijun,LIShiqi,ZHANGChangchun,TANGXiaohui
(SchoolofMetallurgicalandEcologicalEngineering,UniversityofScienceandTechnologyBeijing,Beijing100083,China)
Based on the research of basic characteristics of red mud from some aluminum plant, the thermodynamics and kinetics of sodium removal were analyzed. The orthogonal experiments were conducted to remove sodium from red mud by using greenhouse gas CO2. Taking sodium removal rate as the research indicator, the effects of liquid-solid ratio, sodium removal time and sodium removal frequency on sodium removal rate were analyzed. The experimental results show that the sodium removal rates were higher when liquid-solid ratio was 2 and 4, but considering the actual situation and experimental error, liquid-solid ratio 2 would be the optimum value. The sodium removal time had no obvious influence on sodium removal rate, so the shortest 20 min would be the optimal sodium removal time. The sodium removal frequency had significant effect on sodium removal rate, which means higher sodium removal frequency could obtain higher sodium removal rate, but for the sake of saving water and further treatment, the reasonable sodium removal frequency should be 2 times. The study indicates that the treatment process using CO2could not only remove sodium from red mud, but also reduce the greenhouse gas emission, and furthermore recycle NaHCO3, which is conducive to recycling of resources.
red mud; sodium removal; orthogonal experiments
2013-08-20
纪志军(1986-),男,山西朔州人,博士研究生,主要从事炼钢工艺与冶金固废资源回收研究,(Tel)15101126168
1007-9432(2014)01-0042-05
X758
:A

