南方根结线虫二龄幼虫对不同类型盐离子的趋化反应
孟 丽,漆永红,刘玉霞,曹素芳,杜 蕙,吕和平,李敏权,*
(1.甘肃农业大学草业学院,兰州 730070; 2.甘肃省农业科学院植物保护研究所,兰州 730070;3.甘肃省农业科学院林果花卉研究所,兰州 730070)
南方根结线虫二龄幼虫对不同类型盐离子的趋化反应
孟 丽1,2,漆永红2,刘玉霞1,曹素芳3,杜 蕙2,吕和平2,李敏权1,2*
(1.甘肃农业大学草业学院,兰州 730070; 2.甘肃省农业科学院植物保护研究所,兰州 730070;3.甘肃省农业科学院林果花卉研究所,兰州 730070)
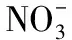
南方根结线虫; 无机盐; 有机盐; 趋化性
根结线虫(Meloidogynespp.)是植物病原线虫中种类最多,分布最广,危害最严重的一类线虫,其寄主范围超过3000种,主要危害茄科、葫芦科、十字花科等植物根部,形成串球瘤状根结,破坏根组织的分化和生理活动,抑制地上部正常生长,进而严重影响作物的产量和品质[1]。根结线虫不仅直接危害植物的根和茎,线虫造成的伤口还可诱发和加剧其他土传病害的发生,如枯萎病(FusariumoxysporumSchlecht)、黄萎病(VerticilliumdahliaeKleb.)和立枯病(RhizoctoniasolaniKühn)等[2]。根结线虫病主要以化学防治为主,但化学防治对环境影响大、易对作物产生药害等,因此,探索防治根结线虫的新方法势在必行。

Devine和Jones报道[14],施入土壤中的盐及肥料在供植物吸收的同时也显著影响着线虫的行为,从而间接影响田间的发病情况。这是由于土壤中施加的盐容易被作物吸收提高植物的抗病性,更重要的是有些盐在土壤环境下产生的剧毒化合物对线虫迁移和侵染具有抑制作用,这些化合物阻碍线虫完成生活史,遏制了线虫的危害,起到某种程度的防治作用。了解盐对南方根结线虫的影响具有重要的价值,本试验测试了南方根结线虫对48种盐的趋化反应,旨在为南方根结线虫的防治提供依据。
1 材料与方法
1.1 供试线虫
采自甘肃省武威市发放镇日光温室内发病的番茄根系,经鉴定后确定为南方根结线虫[15]。采用Giannakou等[16]的方法,将病根洗净,在解剖镜下从番茄根系挑取新鲜卵囊,放入直径9 cm的培养皿内,用0.5%次氯酸钠表面消毒3min,无菌水洗3次后放入24孔培养板中,在室温25 ℃左右孵化2龄幼虫,每隔24 h换水1次,保证每次选用的2龄幼虫新鲜和活力一致。
1.2 供试盐
本试验包括48种盐,其中37种为无机盐,11种为有机酸及其盐。供试盐分别是NH4Cl、NaCl、KCl、CuCl2·2H2O、FeCl3·3H2O、CsCl;(NH4)2SO4、Na2SO4、K2SO4、MnSO4·H2O、FeSO4·7H2O、CuSO4·5H2O、(NH4)2SO4·FeSO4·6H2O;NH4NO3、NaNO3、KNO3、Ba(NO3)2、 Mn(NO3)2;Na2HPO4、NaH2PO4、(NH4)2HPO4、NH4H2PO4; KH2PO4、K2HPO4;NH4HCO3、(NH4)2CO3、Na2CO3、K2CO3、KHCO3、CaCO3、NaHCO3;C2H4O2、 C2H3O2Na、C2H3O2K、C2H3O2NH4;NH4SCN、KSCN、NaSCN;NaOH、KOH;Na2WO4·2H2O、CO(NH2)2、C3H6O3、C4H6O6、C6H8O7、C6H5Na3O7、C7H5NaO3和C10H14N2Na2O8。以上盐均为分析纯,定购于天津市恒兴化学试剂厂。每种盐设6个浓度,分别为2×10-2、1×10-2、0.5×10-2、0.25×10-2、0.125×10-2及 0.062 5×10-2mol /L。
1.3 生测方法
试验方法在Wuyts等[17]的基础上有所改进。将直径为5 cm的培养皿底部通过两个内外环划分成16部分(见图1)。先在培养皿中倒入0.8%琼脂糖5 mL,接着在琼脂糖平板外环的圈内分别加入50μL的待测盐溶液和蒸馏水,室温25 ℃放置1h,然后将2 μL约30头南方根结线虫接种于中心环内,在25 ℃培养箱黑暗放置5 h。之后,在培养皿表面喷洒乙醇停止线虫运动。在显微镜下数出1~8区各区线虫的数量。每个浓度的盐重复3次,以蒸馏水处理为对照。
1.4 数据处理
本试验中,趋化指数定义为从+2到-2范围内的正值(吸引)和负值(排斥)。参照Saux和Quénéhervé的方法[9]有所改进,其表达式为:趋化指数=∑(p·Id),其中p表示各区线虫比率,即1~8区各区线虫数量与8个区线虫总数量的比率;Id表示距离系数,即1~2区为+2 cm,3~4区为+1cm,5~6区为-1cm,7~8区为-2 cm。
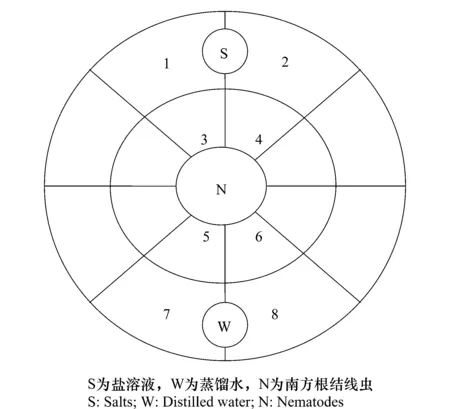
图1 南方根结线虫趋化性测试区Fig.1 Test arena for investigating the chemotaxis of Meloidogyne incognita
数据处理采用DPS软件,Duncan 氏新复极差法检验差异显著性(P<0.05)。
2 结果与分析
2.1 南方根结线虫对37种无机盐和11种有机盐的趋化性
表1南方根结线虫对不同盐离子在不同浓度下的趋化性及趋化指数1)
Table1ChemotaxisanditschemotacticindexofdifferentsaltionsatdifferentconcentrationstoM.incognita
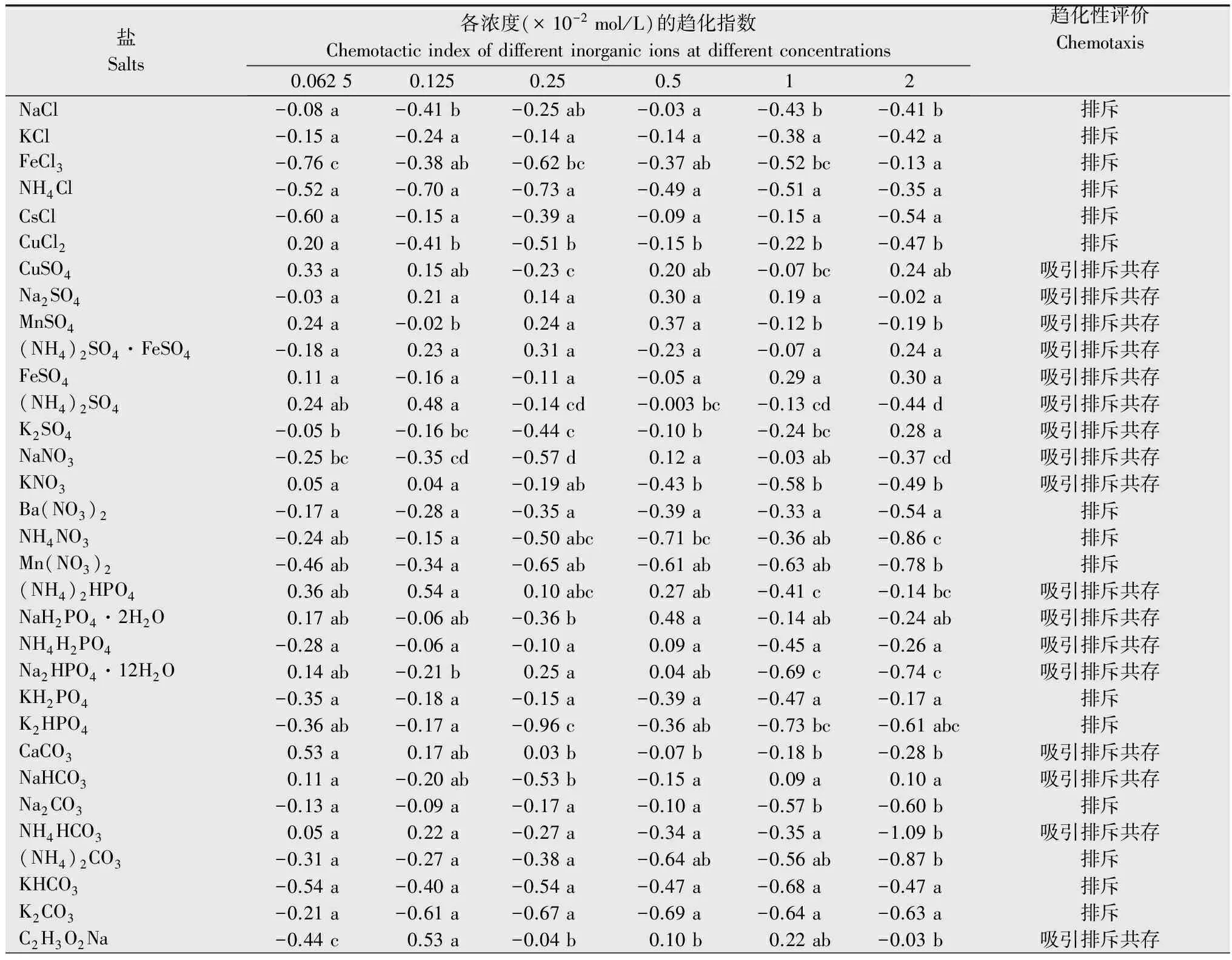
盐Salts各浓度(×10-2mol/L)的趋化指数Chemotacticindexofdifferentinorganicionsatdifferentconcentrations 0.06250.1250.250.512趋化性评价ChemotaxisNaCl-0.08a-0.41b-0.25ab-0.03a-0.43b-0.41b排斥KCl-0.15a-0.24a-0.14a-0.14a-0.38a-0.42a排斥FeCl3-0.76c-0.38ab-0.62bc-0.37ab-0.52bc-0.13a排斥NH4Cl-0.52a-0.70a-0.73a-0.49a-0.51a-0.35a排斥CsCl-0.60a-0.15a-0.39a-0.09a-0.15a-0.54a排斥CuCl20.20a-0.41b-0.51b-0.15b-0.22b-0.47b排斥CuSO40.33a0.15ab-0.23c0.20ab-0.07bc0.24ab吸引排斥共存Na2SO4-0.03a0.21a0.14a0.30a0.19a-0.02a吸引排斥共存MnSO40.24a-0.02b0.24a0.37a-0.12b-0.19b吸引排斥共存(NH4)2SO4·FeSO4-0.18a0.23a0.31a-0.23a-0.07a0.24a吸引排斥共存FeSO40.11a-0.16a-0.11a-0.05a0.29a0.30a吸引排斥共存(NH4)2SO40.24ab0.48a-0.14cd-0.003bc-0.13cd-0.44d吸引排斥共存K2SO4-0.05b-0.16bc-0.44c-0.10b-0.24bc0.28a吸引排斥共存NaNO3-0.25bc-0.35cd-0.57d0.12a-0.03ab-0.37cd吸引排斥共存KNO30.05a0.04a-0.19ab-0.43b-0.58b-0.49b吸引排斥共存Ba(NO3)2-0.17a-0.28a-0.35a-0.39a-0.33a-0.54a排斥NH4NO3-0.24ab-0.15a-0.50abc-0.71bc-0.36ab-0.86c排斥Mn(NO3)2-0.46ab-0.34a-0.65ab-0.61ab-0.63ab-0.78b排斥(NH4)2HPO40.36ab0.54a0.10abc0.27ab-0.41c-0.14bc吸引排斥共存NaH2PO4·2H2O0.17ab-0.06ab-0.36b0.48a-0.14ab-0.24ab吸引排斥共存NH4H2PO4-0.28a-0.06a-0.10a0.09a-0.45a-0.26a吸引排斥共存Na2HPO4·12H2O0.14ab-0.21b0.25a0.04ab-0.69c-0.74c吸引排斥共存KH2PO4-0.35a-0.18a-0.15a-0.39a-0.47a-0.17a排斥K2HPO4-0.36ab-0.17a-0.96c-0.36ab-0.73bc-0.61abc排斥CaCO30.53a0.17ab0.03b-0.07b-0.18b-0.28b吸引排斥共存NaHCO30.11a-0.20ab-0.53b-0.15a0.09a0.10a吸引排斥共存Na2CO3-0.13a-0.09a-0.17a-0.10a-0.57b-0.60b排斥NH4HCO30.05a0.22a-0.27a-0.34a-0.35a-1.09b吸引排斥共存(NH4)2CO3-0.31a-0.27a-0.38a-0.64ab-0.56ab-0.87b排斥KHCO3-0.54a-0.40a-0.54a-0.47a-0.68a-0.47a排斥K2CO3-0.21a-0.61a-0.67a-0.69a-0.64a-0.63a排斥C2H3O2Na-0.44c0.53a-0.04b0.10b0.22ab-0.03b吸引排斥共存
续表1Table1(Continued)
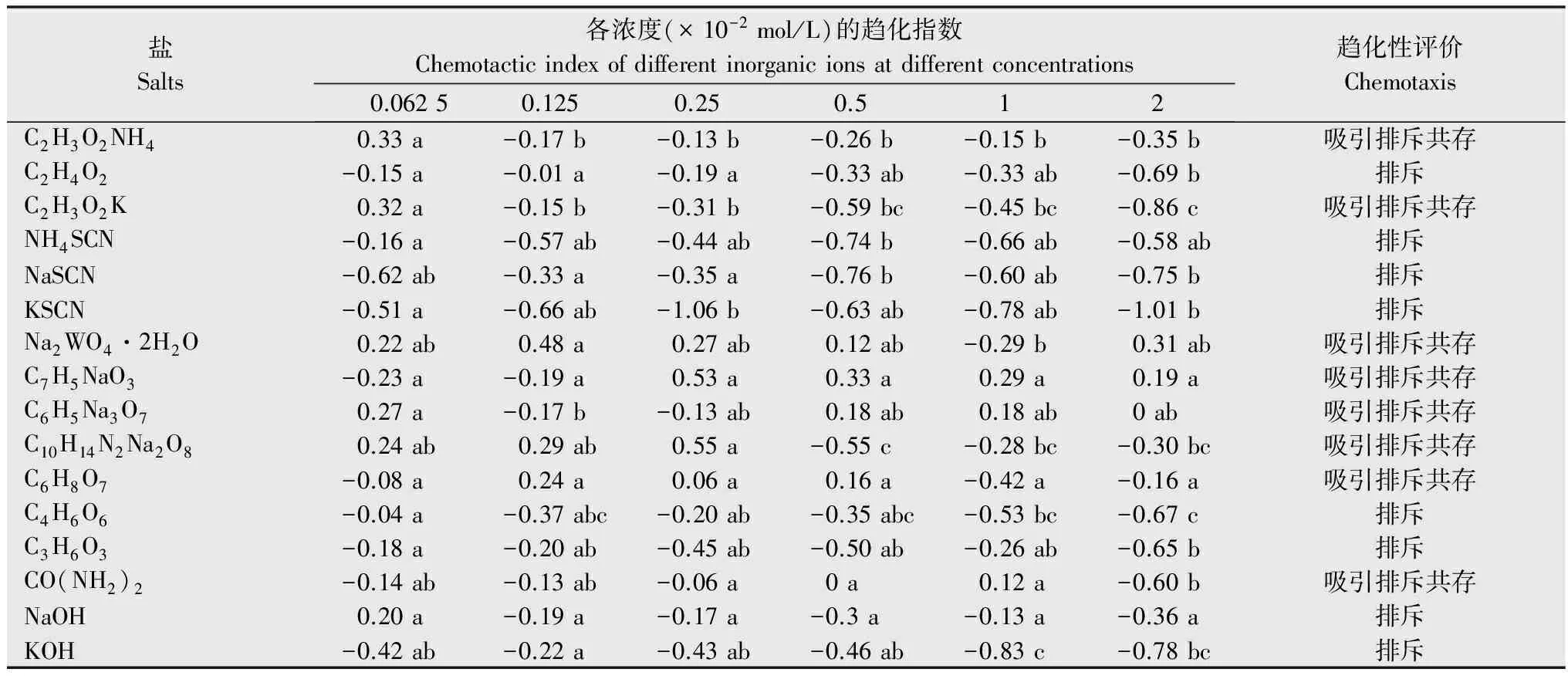
盐Salts各浓度(×10-2mol/L)的趋化指数Chemotacticindexofdifferentinorganicionsatdifferentconcentrations 0.06250.1250.250.512趋化性评价ChemotaxisC2H3O2NH40.33a-0.17b-0.13b-0.26b-0.15b-0.35b吸引排斥共存C2H4O2-0.15a-0.01a-0.19a-0.33ab-0.33ab-0.69b排斥C2H3O2K0.32a-0.15b-0.31b-0.59bc-0.45bc-0.86c吸引排斥共存NH4SCN-0.16a-0.57ab-0.44ab-0.74b-0.66ab-0.58ab排斥NaSCN-0.62ab-0.33a-0.35a-0.76b-0.60ab-0.75b排斥KSCN-0.51a-0.66ab-1.06b-0.63ab-0.78ab-1.01b排斥Na2WO4·2H2O0.22ab0.48a0.27ab0.12ab-0.29b0.31ab吸引排斥共存C7H5NaO3-0.23a-0.19a0.53a0.33a0.29a0.19a吸引排斥共存C6H5Na3O70.27a-0.17b-0.13ab0.18ab0.18ab0ab吸引排斥共存C10H14N2Na2O80.24ab0.29ab0.55a-0.55c-0.28bc-0.30bc吸引排斥共存C6H8O7-0.08a0.24a0.06a0.16a-0.42a-0.16a吸引排斥共存C4H6O6-0.04a-0.37abc-0.20ab-0.35abc-0.53bc-0.67c排斥C3H6O3-0.18a-0.20ab-0.45ab-0.50ab-0.26ab-0.65b排斥CO(NH2)2-0.14ab-0.13ab-0.06a0a0.12a-0.60b吸引排斥共存NaOH0.20a-0.19a-0.17a-0.3a-0.13a-0.36a排斥KOH-0.42ab-0.22a-0.43ab-0.46ab-0.83c-0.78bc排斥
1) 表中数据为平均值,同行数据后不同小写字母表示经Duncan氏新复极差法检验在P<0.05水平上差异显著。 The data in the figure are mean.Different lowercase letters within the same row show significant differences atP<0.05 levels by Duncan′s,multiple range test.
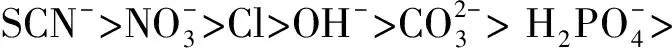
2.2 南方根结线虫对48种盐在6种不同浓度下的趋化指数
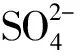
3 讨论
在生产中,施入土壤中的盐及肥料在供植物吸收的同时也影响着线虫的行为。本试验研究了37种无机盐对南方根结线虫运动行为的影响,且首次明确了南方根结线虫对11种有机酸及其盐,如C2H4O2、 C2H3O2Na、C2H3O2K、C2H3O2NH4、CO(NH2)2、C3H6O3、C4H6O6、C6H8O7、C6H5Na3O7、C7H5NaO3和C10H14N2Na2O8的趋化性。


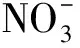
[1] 刘维志.植物病原线虫学[M].北京: 中国农业出版社,2000.
[2] Abawi G S,Barker K R.Effects of cultivar,soil temperature,and population levels ofMeloidogyneincognitaon root necrosis andFusariumwilt of tomatoes[J].Phytopathology,1984,74: 433-438.
[3] Bird A F.The attractiveness of roots to the plant parasitic nematodesMeloidogynejavanicaandM.hapla[J].Nematologica,1959,4: 322-335.
[4] Jairajpuri M S,Azmi M I.Aggregation and repulsion of nematodes at pH gradients[J].Nematologia Mediterranea,1978,6:107-112.
[5] Robinson A F.Optimal release rates for attractingMeloidogyneincognita,Rotylenchulusreniformisand other nematodes to carbon dioxide in sand[J].Journal of Nematology,1995,27: 42-50.
[6] El-Sherif M,Mai W F.Thermotactic response of some plant parasitic nematodes[J].Journal of Nematology,1969,1:43-48.
[7] Greet D N,Green C D,Poulton M E.Extraction,standardization and assessment of the volatility of the sex attractants ofHeteroderarostochiensisWoll andH.schachtiiSchm[J].Annals of Applied Biology,1968,61:511-519.
[8] Castro C E,Belser N O,Mckinney H E,et al.Strong repellency of the root knot nematode,Meloidogyneincognitaby specific inorganic ions[J].Journal of Chemical Ecology,1990,16: 1297-1309.
[9] Saux R L,Quénéhervé.Differential chemotactic responses of two plant-parasitic nematodes,MeloidogyneincognitaandRotylenchulusreniformis,to some inorganic ions[J].Nematology,2002,4:99-105.
[10]Qi Y H,Li X H,Ma J,et al.Chemotaxis ofDitylenchusdestructorin response to different inorganic ions[J].Russian Journal of Nematology,2008,16(2):69-76.
[11]Steiner G.The problem of host selection and host specialization of certain plant-infesting nemas and its application in the study of nemic pests[J].Phytopathology,1925,15: 499-534.
[12]Perry R N.An evaluation of types of attractants enabling plant-parasitic nematodes to locate plant roots[J].Russian Journal of Nematology,2005,13: 83-88.
[13]Croll N A,Maggenti A R.A peripheral nervous system in nematode,with a discussion of its functional and phylogenetic significance[J].Proceeding of the Helminthological Society of Washington,1968,35:108-115.
[14]Devine K J,Jones P W.Investigations into the chemoattraction of the potato cyst nematodesGloboderarostochiensisandG.pallidatowards fractionated potato root leachate[J].Nematology,2003,5: 65-75.
[15]高赟,漆永红,刘永刚,等.甘肃河西地区番茄根结线虫病病原鉴定[J].植物保护,2009,35(3):127-129.
[16]Giannakou I O,Karpouzas D G,Anastasiades I,et al.Factors affecting the efficacy of non-fumigant nematicides for controlling root-knot nematodes[J].Pest Management Science,2005,61: 961-972.
[17]Wuyts N,Swennen R,De W D.Effect of plant phenylpropanoid pathway products and selected terpenoids and alkaloids on the behaviour of the plant-parasitic nematodesRadopholussimiles,PratylenchuspenetransandMeloidogyneincognita[J].Nematology,2006,8: 89-101.
[18]Prot J C.Behaviour of juveniles ofMeloidogynejavanicain salts gradients[J].Revue de Nématologie,1979,2: 11-16.
[19]Oka Y,Tkachi N,Shuker S,et al.Field studies on the enhancement of nematicidal activity of ammonia-releasing fertilisers by alkaline amendments[J].Nematology,2006,8: 881-893.
ChemotaxisofthesecondstagejuvenilesofMeloidogyneincognitainresponsetodifferentsaltions
Meng Li1,2, Qi Yonghong2, Liu Yuxia1, Cao Sufang3, Du Hui2, Lü Heping2, Li Minquan1,2
(1.GrasslandCollege,GansuAgriculturalUniversity,Lanzhou730070,China; 2.InstituteofPlantProtection,GansuAcademyofAgriculturalSciences,Lanzhou730070,China; 3.InstituteofFruitandFloricultureResearch,GansuAcademyofAgriculturalSciences,Lanzhou730070,China)
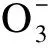
Meloidogyneincognita; inorganic salts; organic salts; chemotaxis
2013-03-29
:2013-05-08
国家自然科学基金(31000845);甘肃省自然科学基金(1107RJZA236)
S 432.45
:ADOI:10.3969/j.issn.0529-1542.2014.02.016
* 通信作者 E-mail: lmq@gsau.edu.cn

