桉木热水预水解液有机酸离子色谱分析
崔金龙 郭怀泽 李海明 周景辉 韩 颖 毕佳捷 王 安
(大连工业大学,辽宁大连,116034)
热水预水解是生物质精炼的重要手段之一[1-2]。在生物质的热水预水解过程中,酸性物质的生成是生物质利用平台建设的重要研究对象之一,如何快捷地对这些酸性物质进行测定,具有重要意义。
桉木中的半纤维素主要是聚木糖,同时还有少量的聚葡萄糖甘露糖,其中聚木糖类主要是聚O-乙酰基-(4-O-甲基葡萄糖醛酸)木糖[3]。在热水预水解过程中,含乙酰基支链的聚木糖脱乙酰基生成乙酸[4];所生成的乙酸在加速半纤维素水解和纤维素部分降解的同时,也加速了水解产物的进一步降解。其中的主要水解产物木糖和葡萄糖通过脱水反应分别降解生成5-羟甲基糠醛和糠醛[5-6],5-羟甲基糠醛进一步热分解生成乙酰丙酸和甲酸[7],而糠醛也可进一步分解产生甲酸[8],具体的降解过程如图1所示。综上所述,桉木热水预水解液中的有机酸主要是甲酸、乙酸和乙酰丙酸。
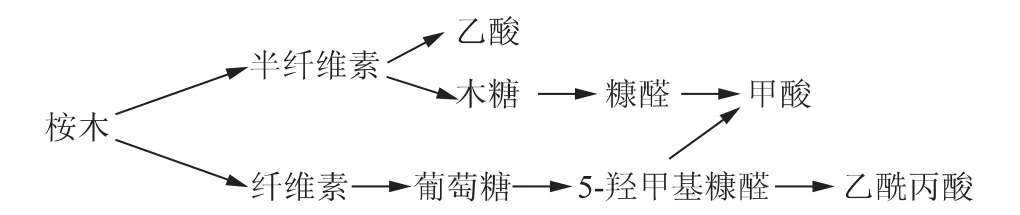
图1 桉木热水预水解过程中的主要降解过程
有机酸的测定方法主要有传统化学法[9]、高效液相色谱法[10]、气相色谱法[11-12]和离子色谱法[13]等。传统化学法只能测得酸总含量,不能测出具体每种酸的含量。高效液相色谱法分析有机酸的过程中,以保留时间作为定性依据,但是该法中有机酸保留时间受温度和pH值等条件影响较大,重现性较差,易导致定性不准[14];而气相色谱法受易挥发杂质干扰。离子色谱法采用阴离子交换机理进行分析,样品中其他非离子组分干扰较小;利用抑制电导进行检测,背景电导率很低,可以提高测定灵敏度,操作简单,无须繁琐的预处理或柱后处理,可以快速、高效地对多种常见有机酸和无机阴离子进行同时检测和分离[14],被广泛应用于医药[15]、食品[16]、环境[17]、轻工[18]等领域中有机酸的检测。
隋小玉等人[13]采用离子色谱法直接分析葡萄糖水解液中的有机酸,为乙酰丙酸的测定提供一种新方法,但是这种方法主要考虑乙酰丙酸和甲酸的分离测定,没有涉及乙酸和乙酰丙酸的分离。从结构角度考虑,如果方法选择不当,乙酸和乙酰丙酸有可能出现难以分离的现象,因此探究离子色谱法是否适于甲酸、乙酸和乙酰丙酸的同时测定很有必要。本研究建立了一种以NaOH溶液作为淋洗液,采用离子色谱法分析并分离桉木热水预水解液中乙酸、甲酸和乙酰丙酸的方法。建立的方法分析结果准确、重复性好、简便快速,为生物质热水预水解液中有机酸的测定提供了一种方法。
1 实验
1.1 试剂与材料
标准乙酸 (质量分数49% ~51%)、标准甲酸(质量分数49% ~51%)、标准乙酰丙酸 (纯度超过98%),均为Sigma-Aldrich公司提供;NaOH溶液,质量分数50% ~52%,Fluka公司提供;蒸馏水。
桉木片由山东华泰纸业股份有限公司提供。经筛选、洗涤风干后磨粉,取40~60目桉木粉作为原料。
1.2 实验仪器
ICS-5000型离子色谱仪,美国戴安公司;四元梯度泵,Chromeleon 6.80色谱工作站;IonPacTMAS11-HC(250 mm×4 mm)阴离子分析柱,IonPacTMAS11-HC(50 mm×4 mm)阴离子保护柱;ASRSTM300(4 mm)电解自再生阴离子电化学抑制器;电导检测器。
智能油浴锅,巩义市予华仪器有限责任公司。0.22 μm微孔水系过滤头,上海兴亚净化材料厂。
1.3 标准溶液的配制
准确称取2.0 g(精确到0.0001 g,下同)标准乙酸、2.0 g标准甲酸和1.0 g标准乙酰丙酸,分别置于100 mL容量瓶中,用去离子水定容,均配成10.0 g/L的单一标准储备液。
分别取1 mL配制好的单一标准储备液定容至100 mL,得到浓度均为100.0 mg/L的乙酸、甲酸和乙酰丙酸标准母液。
将配制好的单一标准母液分别稀释成0.5、1.0、2.0、4.0、8.0、10.0和15.0 mg/L的标准溶液。
分别取1 mL配制好的标准乙酸和甲酸母液、0.5 mL标准乙酰丙酸母液,混合后定容至100 mL,可得到含有1.0 mg/L乙酸和甲酸、0.5 mg/L乙酰丙酸的标准混合酸。
1.4 桉木的热水预水解
称取8 g绝干桉木粉于智能油浴锅的小罐中,按照液比 1∶6补充去离子水,分别在温度 150℃、170℃、190℃、210℃和230℃下反应1 h,从40℃升温至所需的预处理温度开始计时。反应结束后,用凉水迅速冲凉小罐,取出预水解液及水解后的木粉,过滤得到预水解液。稀释一定的倍数,用0.22 μm微孔水系过滤头过滤后,进行离子色谱分析。
2 结果与讨论
2.1 离子色谱分离条件
本实验采用NaOH溶液作为淋洗液,用蒸馏水(E1)、250 mmol/L NaOH(E2)和50 mmol/L NaOH(E3)调节浓度;柱温30℃;抑制器电流为99 mA;检测器温度35℃;流速1.0 mL/min;进样量25 μL,所采用的梯度洗脱程序见表1。从表1可以看出,0~15.0 min为有机酸的测定阶段,22.1~28.0 min为平衡系统阶段,这两个阶段均利用2.0 mmol/L的NaOH溶液等梯度淋洗;15.1~22.0 min为柱子清洗阶段,此阶段利用40.0 mmol/L的NaOH溶液冲洗。
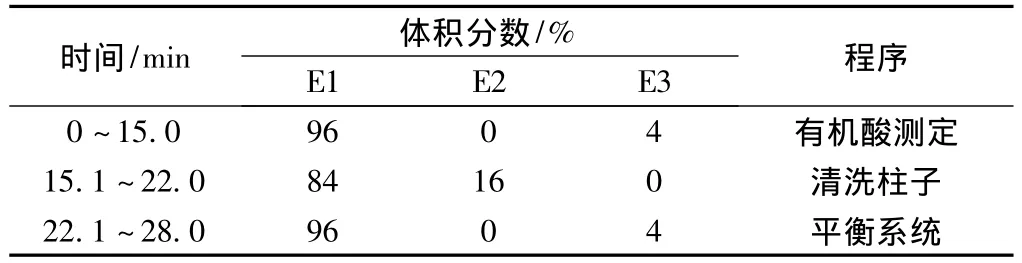
表1 淋洗液梯度洗脱程序
混合酸标准溶液离子色谱图如图2所示。从图2中可以看出,甲酸、乙酸和乙酰丙酸的峰形比较尖锐,且得到了有效分离。
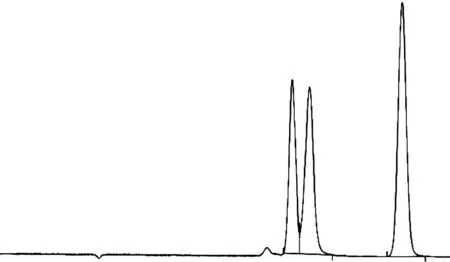
图2 标准混合酸溶液离子色谱图
2.2 线性关系和检出限
根据乙酸、甲酸和乙酰丙酸标准溶液的浓度和色谱峰的面积,求线性回归方程,按式 (1)计算出其相应的检出限,取各酸不同浓度下检出限的最大值作为该酸的检出限。各化合物的线性回归方程、检出限见表2。由表2可知,乙酸、甲酸和乙酰丙酸标准溶液浓度和色谱峰面积具有较好的线性相关性,检出限分别为12.5 μg/L、6.3 μg/L、18.8 μg/L,相关系数(r2)为0.9999、0.9997、0.9990。

式中,Cmin为最小检出限;CS为样品浓度;Hn为噪音峰高;H为样品峰高。

表2 线性关系和检出限
2.3 重现性
为了考察该方法的重现性,以含有1.0 mg/L乙酸、1.0 mg/L甲酸和0.5 mg/L乙酰丙酸的混合酸标准样,连续6次进样,测得结果如表3所示。分别计算出6次测定值的平均值 (X)和相对标准偏差 (RSD)。
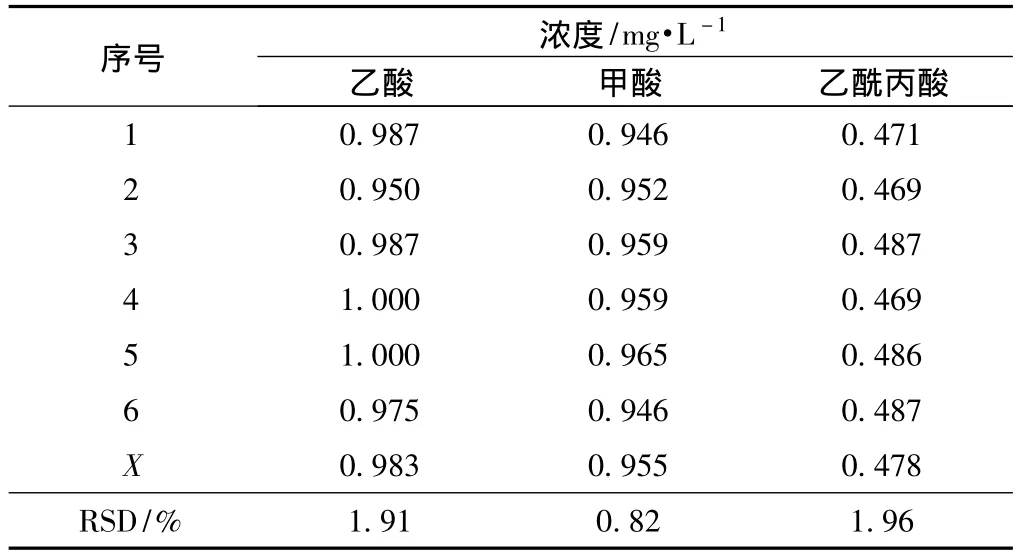
表3 混合酸标准样的重现性实验
RSD越小,表明重现性越好。如表3所示,各标准酸检测浓度的RSD在0.82%~1.96%之间,满足仪器分析RSD<3%的要求。这表明本方法用于测定桉木粉热水预水解液中有机酸的组成和含量具有良好的重现性。
2.4 样品加标回收率
为了考察该方法的准确度,在190℃下的样品稀释液中添加3种已知浓度的有机酸标准品,按照式(2)测定其回收率,结果见表4。

式中,c1为测得浓度,mg/L;c2为样品稀释液浓度,mg/L;c3为加入的标准酸浓度,mg/L。
由表4可以看出,这3种有机酸的测定均具有良好的准确性,也说明该方法系统误差较小。
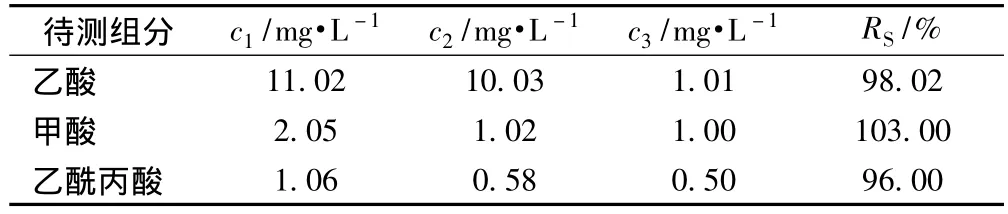
表4 190℃下样品稀释液加标实验结果
2.5 样品测定
根据上述有机酸测定方法,对温度150℃、170℃、190℃、210℃和230℃下制备的热水预水解液中的有机酸进行了测定,以掌握热水预水解过程中有机酸的生成规律和糖类的降解程度,测定数据如表5所示。210℃下测得的样品离子色谱图如图3所示。
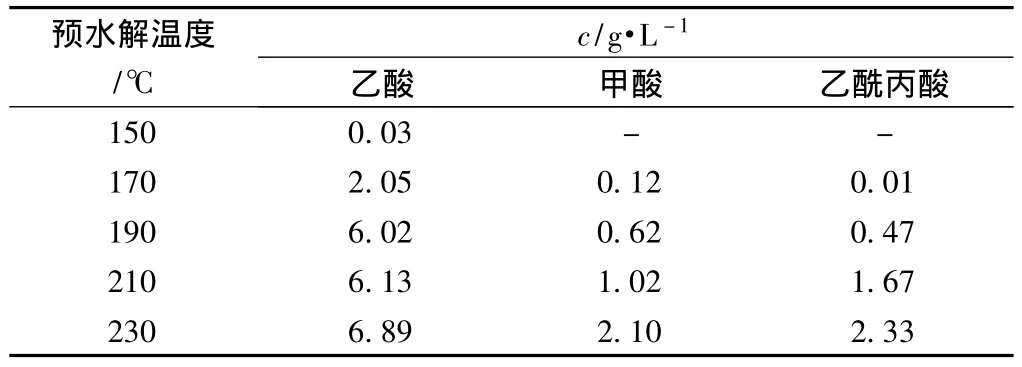
表5 不同预水解温度下热水预水解液中有机酸含量
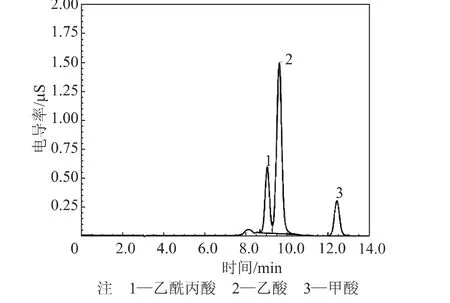
图3 210℃下的样品离子色谱图
由图3可知,离子色谱法可以有效分离桉木粉热水预水解液样品中的乙酸、甲酸和乙酰丙酸,表明这种方法适合于桉木粉水解液中有机酸的测定。由表5可知,在其他条件不变的情况下,随着预水解温度的升高,乙酸、甲酸和乙酰丙酸的浓度都呈上升趋势。在150℃下,甲酸和乙酰丙酸未检出,可见木糖和葡萄糖都没有发生酸降解反应;而随着预水解温度的升高,甲酸和乙酰丙酸含量的增加表明了木糖和葡萄糖降解生成酸的反应有所加强。
3 结论
以2.0 mmol/L NaOH等梯度淋洗15 min,采用离子色谱法可有效分离并定量检测桉木热水预水解液中有机酸,包括其中的乙酸、甲酸和乙酰丙酸。该方法前处理简单快速,检测灵敏度高,受样品中其他非离子组分干扰较小,重现性和加标回收率均符合仪器分析要求,适合于生物质水解液中有机酸的测定。
[1] Tunc M Sefik,Adriaan R P van Heiningen.Hemicellulose extraction of mixed southern hardwood with water at 150℃:Effect of Time[J].Industrial and Engineering Chemistry Research,2008,47(18):7031.
[2] LEI Yi-chao,LIU Shi-jie,WU Yuan,et al.Hot-water Extraction and Soda Pulping of Bagasse[J].China Pulp & Paper,2009,28(7):73.雷以超,刘世杰,吴 渊,等.蔗渣的热水抽提和碱法制浆[J].中国造纸,2009,28(7):73.
[3] LIN Da,PENG Hong,YU Zi-ping,et al.Research progress in separation and purification of hemicellulose[J].China Pulp & Paper,2011,30(1):60.林 妲,彭 红,余紫苹,等.半纤维素分离纯化研究进展[J].中国造纸,2011,30(1):60.
[4] Moritz Leschinsky,Gerhard Zuckerstatter,Hedda K Weber,et al.Effect of autohydrolysis of Eucalyptus globulus wood on lignin structure.Part 1:Comparison of different lignin fractions formed during water prehydrolysis[J].Holzforschung,2008,62:645.
[5] Bernard M Kabyemela,Tadafumi Adschiri,Roberto M Malaluan,et al.Glucose and fructose decomposition in subcritical and supercritical water:detailed reaction pathway,mechanisms and kinetics[J].Industrial and Engineering Chemistry Research,1999,38(8):2888.
[6] Michael Jerry Antal Jr,Tongchit Leesomboon,William S Mok,et al.Mechanism of formation of 2-fluraldehyde from D-xylose[J].Carbohydrate Research,1991,217(18):71.
[7] Girisuta B,Janssen L P B M,Heeres H J.A kinetic study on the conversion of glucose to levulinic acid[J].Chemical Engineering Research and Design,2006,84(A5):339.
[8] Jing Qi,Lü Xiuyang.Kinetics of non-catalyzed decomposition of D-xylose in high temperature liquid water[J].Chinese Journal of Chemical Engineering,2007,15(5):666.
[9] Jin Juanjuan.Total acid in beer and its determination[J].Liquormaking Science& Technology,2000(3):56.金娟娟.啤酒的总酸及其测定[J].酿酒科技,2000(3):56.
[10] Zhong Zhangjing,Ding Jianhua,Qiu Changfu,et al.Simultaneous determination of seven organic acids in beverages by high performance liquid chromatography coupled with immered three-phase liquid-phase microextraction[J].Journal of Instrumental Analysis,2010,29(6):589.衷张菁,丁健桦,邱昌福,等.浸入式三相液相微萃取-高效液相色谱法对饮料中7种有机酸的同时测定[J].分析测试学报,2010,29(6):589.
[11] He Shumei,Liu Jinglan,Zhang Hong,et al.Separation and analysis of organic acids in pharmaceutical waste water[J].Chinese Journal of Analysis Laboratory,2005,24(11):70.何书美,刘敬兰,张 宏,等.药厂废液中有机酸的分离分析[J].分析试验室,2005,24(11):70.
[12] Mei Li,Cui Lixia.Simultaneous determination of seven sorts of organic solvent residue in DP by headspace gas chromatography[J].Modern Instruments,2005(4):40.梅 黎,崔丽霞.顶空进样气相色谱法同时测定DP中7种有机溶剂残留量[J].现代仪器,2005(4):40.
[13] Sui Xiaoyu,Lin Lu.Determination of levulinic acid in the glucose hydrolyzate by ion chromatography[J].Food Science and Technology,2010,35(3):281.隋小玉,林 鹿.离子色谱法测定葡萄糖水解液中乙酰丙酸的含量[J].食品科技,2010,35(3):281.
[14] Yang Zhaoxia,Wang Xunqiu,Li Mei.Comparison of analysis methods of organic acids[J].Beer Science and Technology,2009(9):17.杨朝霞,王珣璆,李 梅.有机酸分析方法之比较[J].啤酒科技,2009(9):17.
[15] Yang Ping,Shi Wenbing,Zhou haiyun,et al.Determination of sodium monofluoroacetate in human blood and food samples by ion chromatography[J].Chinese Journal of Chromatography,2004,22(2):177.杨 萍,施文兵,周海云,等.离子色谱法测定血液等样品中的氟乙酸钠[J].色谱,2004,22(2):177.
[16] Long Junbiao,Zhou Jinsen,Zhang Hongying,et al.Determination of acetic acid,tartaric acid,sorbic acid and benzoic acid in beverages added organic modifier by ion chromatography[J].Chinese Journal of Health Laboratory Technology,2010,20(5):1025.龙军标,周金森,张红英,等.有机改性剂离子色谱法测定饮料中乙酸、酒石酸、山梨酸和苯甲酸[J].中国卫生检验杂志,2010,20(5):1025.
[17] Xie Yonghong,Zheng Changjie,Yang Ping,et al.Simultaneous determination of formic acid,acetic acid,crylic acid and chloroacetic acid in water by chromatography of ions[J].Sichuan Environment,2011,30(3):24.谢永洪,郑昌杰,杨 坪,等.离子色谱法同时测定水中的甲酸、乙酸、丙烯酸和氯乙酸[J].四川环境,2011,30(3):24.
[18] Hu Linlin,Rong Xiaowen.Determination of the methanoic acid,ethanoic acid and propanoic acid in bio-diesels via ion chromatography[J].Guangdong Chemical Industry,2009,36(7):220.胡琳琳,容晓文.离子色谱法测定生物柴油中甲酸、乙酸、丙酸[J].广东化工,2009,36(7):220. CPP

