纤维素高值化利用制备微晶纤维素
张向荣 张美云 李金宝 贺 行
(陕西科技大学轻工与能源学院,陕西科技大学教育部轻化工助剂化学与技术重点实验室,陕西西安,710021)
随着世界人口的逐渐增加和工业化的迅速发展,资源和能源危机成为目前全球亟待解决的严峻问题。为应对这一挑战,发展生物质资源是实现可持续发展的途径之一[1]。木质纤维原料是地球上唯一能够固定碳的清洁可再生资源,也是各国新资源战略的重点。木质纤维素是天然高分子化合物,主要来源于自然界的植物,包括棉纤维、木材纤维和禾本科植物纤维等。其中纤维素是由许多D-葡萄糖酐以β-1,4型糖苷键连接起来组成的直链多糖,纤维素的分子结构中每个重复单元含有3个游离醇羟基,一个是伯羟基,两个是仲羟基,因此纤维素具有高度亲水性。纤维素大分子中的β-1,4糖苷键是一种缩醛键,对酸特别敏感,在适当的氢离子浓度、温度和时间作用下,糖苷键断裂,聚合度下降,还原能力提高,这类反应称为纤维素的酸水解,部分水解后的纤维素产物称为水解纤维素 (hydrocellulose),完全水解的产物则是葡萄糖[2]。木质纤维素类生物质资源化和能源化利用目前存在的主要技术瓶颈之一是纤维素中存在致密的晶体结构,严重阻碍了化学试剂或生物酶对纤维素的可及度;二是纤维素酶降解纤维素效率低,成本高,完全产业化目前还难以实现。木质纤维素全结构转化的技术如今还难以取得很大突破。目前,国内外对纤维素类生物质资源的利用重点在生物质乙醇技术方面[3],重视的是将生物质中纤维素和半纤维素组分全部转化为乙醇的能源化利用研究,没有充分利用纤维素大分子结晶区和无定形区的结构及反应性能差异性这一特点。本课题针对纤维素大分子的聚集态结构,在保留纤维素结晶区用于制备微晶纤维素(Microcrystalline cellulose,MCC)的同时,促进无定形区的充分水解再利用,从而实现纤维素的选择性水解。
MCC是一种重要的纤维素类功能材料,是植物纤维素经过稀酸水解和多种后续处理而得到的具有极限聚合度的可自由流动的白色或者近白色粉末状物质,无味,无臭,其颗粒大小一般在20~80 μm之间,极限聚合度一般为15~375,结晶度高于原纤维素,具有纤维素I的晶格特征;MCC是一种水相稳定剂,它在水中形成胶质分散体;不溶于水、稀酸、稀碱和大多数有机溶剂[4];具有赋型、粘合和吸水膨胀等作用[5-6];属于应用价值极高的新型产品,并在轻化工业、医药卫生、食品工业等领域得到广泛应用[7-8]。目前利用酸水解技术生产 MCC的过程中,纤维素结晶区降解严重,使得MCC得率与性能下降。在工业生产和实验室制备MCC时均发现,现有的纤维素酸水解技术对纤维素无定形区的选择性较差,结晶区损失较大,最终对MCC产品的得率和性能影响很大。因此,本课题针对纤维素结晶区和无定形区的结构特点和性能区别,采取不同处理、分别利用的方法保留其结晶区用于制备MCC,无定形区水解为单糖后用于发酵乙醇,以期做到木质纤维素的高值化利用。
本课题以溶解浆为原料,通过Fe3+催化纤维素盐酸水解、分离、纯化制得MCC粗产品。针对纤维素大分子的聚集态结构,研究保护结晶区选择性酸水解无定形区的最优工艺,对MCC制备过程中的化学结构、晶性、结晶度及微观形貌特征变化进行表征和分析;最终对水解残液进行还原糖分析,探讨酸水解残液发酵制备生物乙醇的可行性。
1 实验
1.1 原料及药品
溶解浆,取自山东巴普贝博浆纸有限公司;FeCl3·6H2O,3,5-二硝基水杨酸 (C7H4N2O7),酒石酸钾 钠 (C4H4KNaO6·4H2O),Na2SO3,C6H12O6,37%HCl,NaOH,均为分析纯;铜乙二胺,由中国制浆造纸研究院提供。
1.2 MCC制备
精确称取10 g绝干溶解浆原料,置于三口烧瓶中进行水解,通过恒温水浴加热、搅拌器搅拌,搅拌速度为120 r/min。反应条件:不同浓度的HCl,反应时间60 min,温度80℃。水解纤维素产物立即用去离子水洗至中性,抽滤、干燥并进一步粉碎制得最终产物MCC粗产品,抽滤所得水解残液用于还原糖分析。
1.3 测试分析方法
利用德国Bruker V70傅里叶变换红外光谱分析仪 (FT-IR)测试样品化学组分及结构,将试样研磨成适合衍射实验用的粉末并制成KBr压片;利用日本理学D/max2200PC自动X射线衍射仪 (XRD)测定样品的结晶度和晶型结构,Cu、Ka作为射线源(λ=0.1518 nm),扫描入射角范围2θ为6~40°,Ni滤波;参照GB/T 1548—2004对样品聚合度进行检测;利用纤维分析仪 (MorFi Compat)对水解前后纤维质均长度、宽度等进行检测,待测试样需配制成0.03 g/L的悬浮液;利用日本HITACHI S4800型扫描电镜 (SEM)观察MCC微观形貌结构,加速电压为3 kV,试样风干后取少量喷金处理;水解残液中的还原糖浓度通过DNS结合722N可见分光光度计(上海精科仪器有限公司)测定。
2 结果与讨论
2.1 HCl浓度对纤维素酸水解的影响
实验发现,影响稀酸水解的主要因素有反应温度、时间、酸种类和浓度等[9]。实验分别称取10 g纤维素原料 (按绝干量计)5份,放入三口烧瓶中后分别加入浓度 1.0、1.5、2.0、2.5、3.0 mol/L的HCl,Fe3+浓度0.3 mol/L,放入80℃的恒温水浴锅中加热反应60 min,搅拌器搅拌速度120 r/min。考察HCl浓度对水解纤维素的影响,实验结果如图1所示。
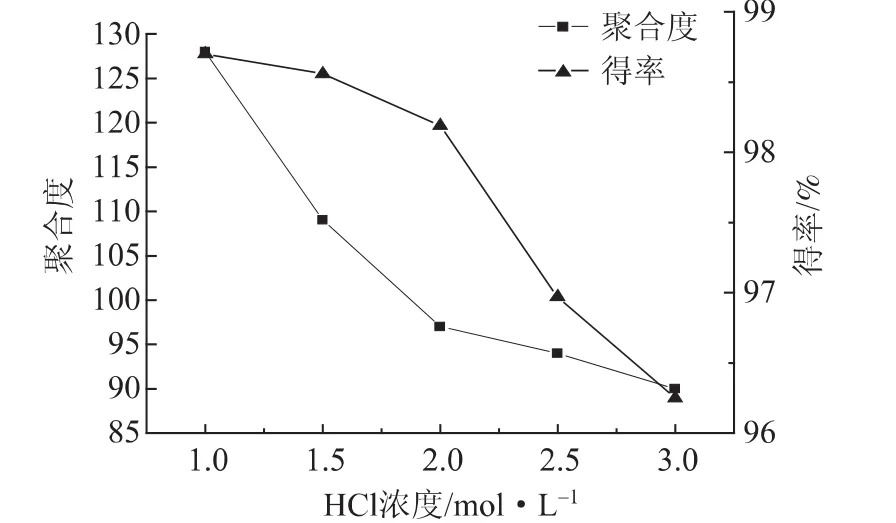
图1 HCl浓度对水解纤维素得率和聚合度的影响
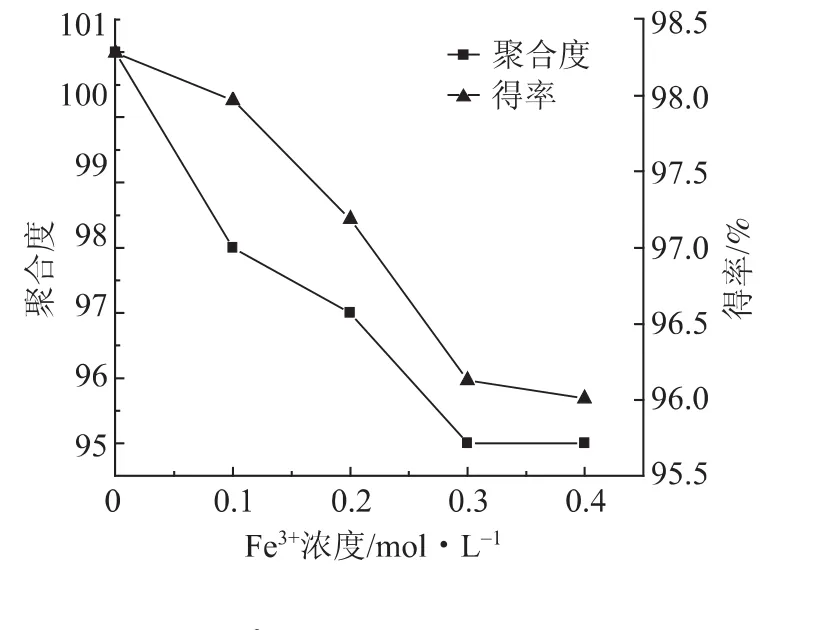
图2 Fe3+浓度对水解纤维素得率和聚合度的影响
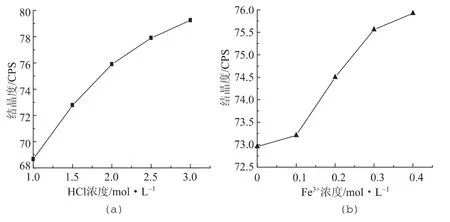
图3 HCl浓度和Fe3+浓度对水解纤维素结晶度的影响
图1 中得率曲线显示,水解纤维素得率随着所用HCl浓度的增加而降低,当HCl浓度低于2.0 mol/L时,得率基本维持在98%左右;HCl浓度增加到2.5 mol/L时,得率下降幅度较明显。因此,从保证水解纤维素得率方面来讲,HCl浓度应该控制在2.0 mol/L以下。结合图1中聚合度曲线可以看出,由于酸水解造成的纤维素分子链的断裂,酸水解后聚合度下降,当HCl浓度为2.0 mol/L时,聚合度达到100左右,聚合度基本保持稳定,这说明水解纤维素已经达到其极限聚合度 (MCC聚合度为15~375[10])。随着HCl浓度的增加,有效氢离子含量逐渐增加,这有利于降解纤维素的无定形区及糖苷键的断裂。理论上,HCl浓度提高1倍而其他条件不变时,水解时间可缩短l/3~1/2,但此时酸成本增大,对设备抗腐蚀要求也会提高,因此常用酸浓度不会超过3.0%。从实验结果综合分析来看,确定在此水解条件下,HCl浓度为2.0 mol/L较合适。
2.2 Fe3+对纤维素酸水解的影响
庄新姝等人[11]考察了Fe3+等不同金属离子对纤维素酸水解的促进作用,表明金属离子对反应进程和还原糖得率都有很大的影响。实验取10 g溶解浆原料5份,分别添加0.1、0.2、0.3、0.4 mol/L的Fe3+,其他条件不变,考察Fe3+浓度对水解纤维素得率和聚合度的影响,实验结果如图2所示。由图2可知,随着Fe3+浓度的增加,得率降低程度进一步增大,说明Fe3+有助于促进纤维素的酸水解;当Fe3+浓度为0.3 mol/L时,水解纤维素得率和聚合度均趋于平缓。
对Fe3+催化HCl水解过程中水解纤维素产品结晶度变化进行对比分析。随着Fe3+和HCl浓度的增加,水解纤维素的结晶度均呈上升趋势,如图3所示。从图3可看出,当HCl浓度为2.0 mol/L,纤维素结晶度可达到75.9%,催化作用下的产品其结晶度有一定程度的增加,这表明添加金属离子确实可以提高酸水解对无定形区的选择性,获得更高结晶度的水解纤维素。金属离子催化提高了酸水解速率,促使无定形区更快地被水解,使体系中更多的酸作用在无定形区的降解上,作用于结晶区的酸用量相对减少,这相当于结晶区得到了一定程度的保护,故产品结晶度上升[12]。与此同时,Fe3+破坏了葡萄糖单元之间通过羟基形成的氢键,削弱分子间范德华力,增加了纤维素水解速度[13]。从图3可看出,Fe3+在浓度为0.3 mol/L时,水解纤维素结晶度趋于稳定。综合考虑水解纤维素各个性能指标,确定 Fe3+的浓度0.3 mol/L时为最优。
2.3 水解残液还原糖含量分析
纤维素的降解产物主要为低聚糖和葡萄糖,低聚糖还可进一步水解为葡萄糖,即酸处理残液中含有一定量的葡萄糖等还原糖。因此,可以利用CaCO3中和酸水解残液经发酵来制备生物乙醇[14],提高纤维素的利用率。本实验利用3,5-二硝基水杨酸比色法(DNS法)测定水解残液中总还原糖含量,研究水解残液发酵制备生物乙醇的可行性。不同浓度的葡萄糖溶液在540 nm处的吸光度与葡萄糖浓度之间的关系如图4所示。
由图4可以看出,葡萄糖的浓度与吸光度基本呈线性关系,采用最小二乘法拟合后,得到还原糖浓度-吸光度标准曲线方程为y=1.2599x-0.0241,回归系数R2为0.9987,线性较好。测得混合废液的吸光度为0.108,代入标准曲线方程计算可以得到水解残液中还原糖含量 (X)由式 (1)表示。
X=DNS测得的还原糖浓度 (g/L)×0.9×

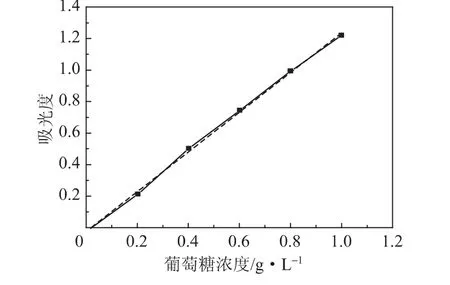
图4 还原糖浓度与吸光度关系标准曲线
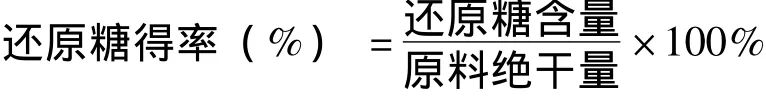
因以葡萄糖为标准品,而实际产物中糖种类比较多,公式以系数0.9修正测得还原糖浓度。
最终水解残液中还原糖含量为0.156 g/L,还原糖得率为1.56%。水解残液用CaCO3中和至pH值5~6,对混合残液进行一定蒸发浓缩后可用于发酵。相关文献研究发现[15],利用MCC制备过程中的酸水解废液经过进一步处理后发酵制备生物乙醇的工艺路线是可行的。
2.4 MCC形态和结构分析
通过图5样品的SEM图观测发现,水解前的原料纤维表面光滑、平整,随着水解反应的进行,纤维形态结构被破坏的程度加剧[16],逐渐变为碎片状,经Fe3+催化HCl水解后纤维素的微观形态大致呈棒状,伴随有片状堆砌的结构。纤维的断裂程度明显,纤维在发生横向断裂的同时,表面也出现不同程度的腐蚀孔,使得纤维的比表面积增加,有更多的纤维素分子暴露在表面,这为水解纤维素后续阶段的处理提供有利条件。

图5 原料纤维和水解纤维素纤维的SEM图
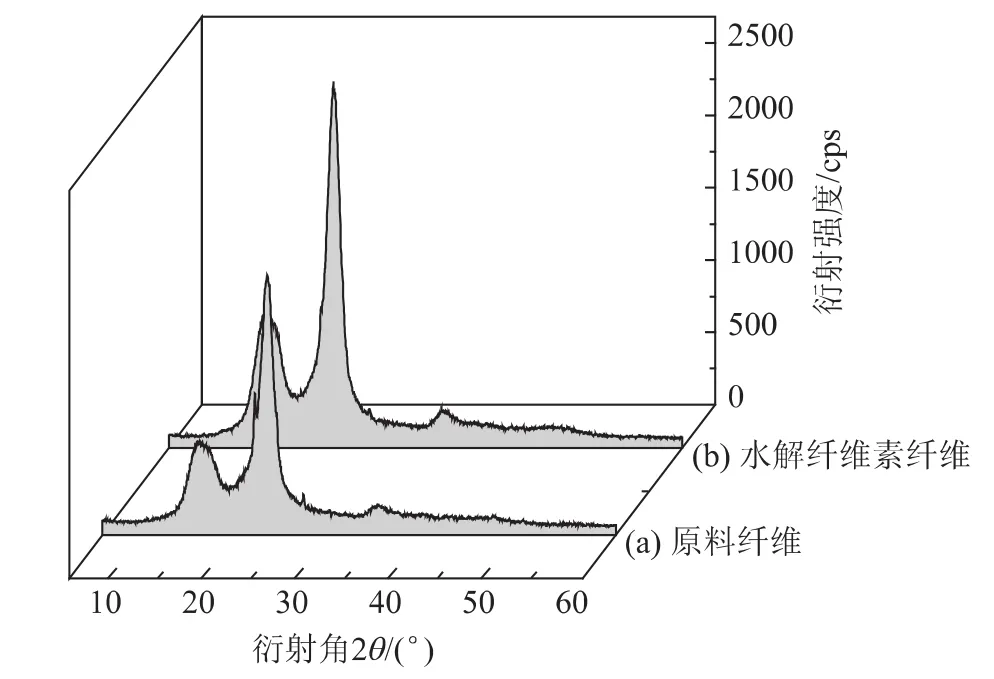
图6 原料纤维和水解纤维素纤维的XRD衍射图
结晶度是衡量MCC性能指标的重要因素之一,利用XRD分析酸水解前后纤维素晶型和结晶度变化情况,分析结果见图6。由图6可知,两种条件下水解纤维素和原料的XRD特征吸收峰的2θ角位置基本一致,只是衍射强度发生变化,这证明了纤维素酸水解后晶型和原料的一致性,均以纤维素Ⅰ的晶型存在[17]。根据纤维素的聚集态结构即所谓超分子结构,由于纤维素结晶区中存在大量分子间和分子内氢键结合,形成微晶体,导致结构致密,严重阻碍了化学试剂或生物酶对该区域的可及性,表现出一定的稳定性[18];相反地,无定形区氢键较少,分子排列疏松,化学试剂或生物酶对此可及性强,导致无定形区相对容易破坏[19]。实验结果表明,Fe3+催化酸水解作用下水解纤维素具有更高的结晶度,更有利于纤维素无定形区的选择性降解。采用晶区面积法对样品结晶度按式 (2)进行计算。

式中,Crl为结晶度 (%);FK为结晶区面积(m2);FA为无定形区的面积 (m2)。
在纤维素的XRD衍射图中,{002}面衍射强度代表了结晶区的强度,因此晶区面积FK={002}峰的峰面积,结果得到的水解纤维素结晶度与原料相比由54.8%提高到73.0%。
3 结论
以溶解浆为原料,以Fe3+作为催化剂酸水解、分离、纯化制备微晶纤维素 (MCC)粗产品。
3.1 实验结果表明,Fe3+催化酸水解制备MCC的工艺参数为:HCl浓度2.0 mol/L、Fe3+浓度0.3 mol/L、水解温度80℃、水解时间60 min。
3.2 利用Fe3+催化HCl水解、分离制得MCC的性能为:结晶度73.0%,与原料纤维素结晶度相比增加了18.2个百分点,极限聚合度在100左右;在整个制备过程中纤维素分子晶型结构没有发生变化,仍为纤维素Ⅰ型,表明添加Fe3+有助于促进纤维素无定形区的选择性酸水解。
3.3 MCC制备过程中酸水解废液还原糖含量为0.156 g/L,得率为1.56%;经后期中和、蒸发浓缩后可用于发酵制备生物乙醇,实现纤维素的全结构高值化利用。
[1] YU Jian-ren,ZHANG Zeng,CHI Cong-cong.Prospects for the Combination of Biorefinery with Pulp and Paper Industry[J].Transactions of China Pulp and Paper,2008,23(1):80.于建仁,张 曾,迟聪聪.生物质精炼与制浆造纸工业相结合的研究[J].中国造纸学报,2008,23(1):80.
[2] DONG Feng-xia,LIU Wen,LIU Hong-feng.Preparation and Application of Nanocellulose[J].China Pulp & Paper,2012,31(6):68.董凤霞,刘 文,刘红峰.纳米纤维素的制备及应用[J].中国造纸,2012,31(6):68.
[3] GAO Shanming,QIAO Qingan,XU Pu,et al.Preparation and properties of microcrystalline cellulose[J].Journal of Functional Materials,2007,38(Supplement):2891.高善民,乔青安,许 璞,等.微晶纤维素的制备及性质研究[J].功能材料,2007,38(增刊):2891.
[4] Li Xiaofang,Ding Enyong,Li Guokang.Rod-like nano-crystalline cellulose:structure and thermal properties[J].Journal of Cellulose Science and Technology,2001,9(2):29.李小芳,丁恩勇,黎国康.一种棒状纳米微晶纤维素的物性研究[J].纤维素科学与技术,2001,9(2):29.
[5] LI Xiaofang,DING Enyong,LI Guokang,A method of preparing spherical nano-crystal cellulose with mixed crystalline forms of celluloseⅠ andⅡ[J].Chinese Journal of Polymer Science,2001,3:291.
[6] DONG Feng-xia,LIU Wen,LIU Hong-feng,et al.Preparation of Cellulose Nanocrystal from Cotton Pulp with Different Pretreatments[J].China Pulp & Paper,2012,31(12):1.董凤霞,刘 文,刘红峰,等.棉浆不同预处理方法制备纤维素纳晶的研究[J].中国造纸,2012,31(12):1.
[7] WANG Zongde,HU Qingguo.The characteristics of microcrystalline cellulose[J].Jiangxi Forestry Science And Technology,2000(1):26.王宗德,胡庆国.微晶纤维素的特性及其应用[J].江西林业科技,2000(1):26.
[8] David N S H,Nobuo S.Wood and Cellulose Chemistry[M].New York:Marcel Dekker,1991:55.
[9] Jamshid Iranmahboob,Farhad Nadim,Sharareh Monemi.Optimizing acid-hydrolysis:a critical step for production of ethanol from mixed wood chips[J].Biomass and Bioenergy,2002(22):401.
[10] MAO Chang-bin,NI Yong-hao.Biorefinery:a new revolution in green energy[J].China Pulp & Paper,2008,27(7):63.毛长斌,倪永浩.生物质提炼的研究进展及在造纸工业上的应用[J].中国造纸,2008,27(7):63.
[11] Zhuang Xinshu,Wang Shurong,Luo Zhongyang,et al.Experimental research and products analysis of cellulose hydrolysis under extremely low acids[J].Acta Energiae Solaris Sinica,2006,27(5):521.庄新姝,王树荣,等.纤维素低浓度酸水解实验及产物分析研究[J].太阳能学报,2006,27(5):521.
[12] Zhang Yun.Preparation of microcrystalline cellulose for synthetic leather cellulose form wheat straw decomposed by pollution-free process[D].Xi’an:Shaanxi University of Science and Technology,2011.张 云.麦草纤维素低污染制备合成革用微晶纤维素工艺研究[D].西安:陕西科技大学,2011.
[13] REN Ling-bing,CAO Qing,XIE Xiao-ling.Hydrolysis kinetics of microcrystalline cellulose catalyzed by Fe3+and dilute hydrochloric acid[J]. Chemistry and Industry of Forest Products,2012(4):117.任玲兵,曹 青,解小玲.微晶纤维素在Fe3+和稀盐酸联合催化下的水解动力学研究[J].林产化学与工业,2012(4):117.
[14] Li Jinbao.Research on high valued utilization technology and mechanism of wheat straw based on difference in aggregated structure of cellulose[D].Xi’an:Shaanxi University of Science and Technology,2012.李金宝.基于纤维素聚集态结构差异的麦草高值化利用技术及机理研究[D].西安:陕西科技大学,2012.
[15] DUAN Chao,FENG Wen-ying,ZHANG Yan-ling.Research Progress in Pretreatment Technologies for Woody Biomass Biorefinery[J].China Pulp & Paper,2013,32(1):59.段 超,冯文英,张艳玲.木质生物质精炼预处理技术研究进展[J].中国造纸,2013,32(1):59.
[16] QU Yin-bo,et al.Lignocellulose degradation enzyme and biological refining[M].Chemical Industry Press,2011:188.曲音波,等.木质纤维素降解酶与生物炼制[M].化学工业出版社,2011:188.
[17] CHEN Wenshuai,YU Haipeng,LIU Yixing,et al.A method for isolating cellulose nanofibrils from wood and their morphological characteristics[J].Acta Polymerica Sinica,2010,11:1320.陈文帅,于海鹏,刘一星,等.木质纤维素纳米纤丝制备及形态特征分析[J].高分子学报,2010,11:1320.
[18] Li Jinbao,Xiu Huijuan,Zhang Meiyun,et al.Enhancement of Cellulose Acid Hydrolysis Selectivity Using Metal Ion Catalysts[J].Current Organic Chemistry,2013,17:1617.
[19] Lee SangHyun,Doherty,Thomas V,et al.Ionic liquid-mediated selective extraction of lignin from wood leading to enhanced enzymatic cellulose hydrolysis[J].Biotechnology and Bioengineering,2009,102(5):1368. CPP

