大鼠肝静脉短暂阻断后肝脏的血流动力学变化与再灌注损伤
谭晓宇,陆树桐,刘 军,许文犁,许寅喆,葛新兰,张爱群,李崇辉,董家鸿
1广州军区广州总医院肝胆外科,广州510010
2中国人民解放军总医院肝胆外科全军肝胆外科研究所,北京100853
当今肝切除手术已经迈入精准肝脏外科时代,随着手术难度和复杂程度不断增加,由肝静脉阻断所致的大范围淤血并不少见。这在成人右半肝移植中尤为常见[1-3],在临床实践中,有不少术中发现移植物大范围淤血而紧急进行补救性肝静脉重建的例子[4]。肝静脉短暂阻断后再通能引起肝组织的再灌注损伤[5]。有研究显示淤血再灌注损伤 (congestion/reperfusion injury,CRI)比缺血再灌注损伤 (ischemia/reperfusion injury,IRI)能引起更严重肝损伤,而且能更明显地抑制残余肝脏的术后肝再生[6]。Dirsch等[7]研究显示,当局部肝静脉阻断后,淤血区交界处的“肝窦血管化”连通淤血区与正常区,其指出这是淤血区内血液的流出通道并借此逐步自然恢复。关于淤血区域周围有无正常肝组织接壤及是否对CRI产生影响了解较少。本研究利用大鼠独立的肝叶结构以及出入肝血流的解剖学特点,通过短暂阻断不同肝叶主肝静脉的方式,建立孤立性肝叶 (isolated lobe,IL)淤血再灌注损伤区域和非孤立性肝叶 (non-isolated lobe,NIL)淤血再灌注损伤区域,同时与缺血再灌注损伤区域进行比较,观察不同血流干预区域血流动力学的变化和再灌注损伤的程度。
材料和方法
实验动物 健康雄性成年Sprague-Dawley大鼠,清洁级,体重200~250 g,由军事医学科学院实验动物中心提供。自由饮水,随意进食,12 h照明,适应环境1周后进行实验。
动物模型的建立 术前12 h禁食,不禁水。予实验动物吸入无水乙醚进行麻醉。仰卧位固定后予碘伏消毒腹部,取上腹正中切口进腹,充分显露肝区结构,离断肝周韧带。在同一大鼠肝脏的不同肝叶建立3个不同的区域:(1)NIL淤血再灌注 (congestion/reperfusion,CR)区 (NIL-CR区,即原肝右中叶):分离大鼠肝右中叶肝静脉,并以无损伤血管夹夹闭肝静脉30 min后开放;(2)IL淤血再灌注区 (IL-CR区,即原肝左叶):分离大鼠左肝叶肝静脉,并以无损伤血管夹夹闭肝静脉30 min后开放;(3)缺血再灌注(ischemia/reperfusion,IR)区 (即原肝右上叶):以无损伤血管夹阻断大鼠肝右上叶入肝血流30 min后开放。术后予腹腔中补充5 ml温生理盐水后分层连续缝合关腹。实验动物术后予电热毯保温至苏醒,自由进水。术后12 h予自由进食。
实验数据与标本的收集 成功建立动物模型后,选血流阻断后30 min、复流后1 d、复流后3 d、复流后7 d为观察的4个时相点,每个时相点随机选取8只建模大鼠。将实验大鼠麻醉后开腹,并迅速按下列方法进行检测、留取标本。
肝叶末梢微循环灌注量检测 保持室温稳定于20℃。实验大鼠剖腹后将肝脏充分显露,并置于非接触式MoorFLPI-2全景激光散斑图像分析仪 (Moor公司)摄像头下方25~30 cm,调整焦距至图像清晰,采用高分辨率连续采集模式,采集10 s。利用软件moorFLPI-2 Review V4.0在所采集的散斑血流图上对IL淤血区、NIL淤血区、对照区进行框选,除去最初3 s图像后,自第3秒开始选取相对稳定5 s的时间区间进行图像检测肝组织微循环的流量值 (flux value,FV)。
肝叶末梢微循环氧饱和度检测 在采集完血流灌注数据后,应用MoorVMS-OXY氧饱和度检测仪(Moor公司),迅速通过一次性双面贴膜将血氧检测仪探头依次贴于IL淤血区、NIL淤血区、对照区中叶的肝叶表面,不重压,各肝叶采集15 s数据 (此检测过程中,保持室温稳定于 20℃)。使用 moorVMS-PC V3.1软件对采集的数据进行分析,除去初始3 s,选取相对稳定的5 s区间进行氧饱和度 (oxygen saturation,SO2)测量,取3处测试点的SO2平均值进行统计分析。
肝脏标本的收集及处理 经上述检测处理后处死实验大鼠,分别留取左叶、中叶、右上叶肝脏组织标本,用10%福尔马林溶液浸泡固定,石蜡包埋后进行切片,分别对各组切片进行苏木精-伊红染色 (HE)染色及其后的免疫组织化学检测。依据Suzuki评分标准[8],对病理切片显示的缺血再灌损伤情况进行对比,主要依据肝细胞质内空泡形成情况、肝窦充血情况、肝实质细胞坏死情况,把损伤程度分为0~4级。
统计学处理 采用SPSS 17.0统计软件进行统计学处理,计量资料以均数±标准差表示。多组数据之间比较时,先使用Kolmogorov-Smirnov检验验证正态性,当数据间方差齐同时,选用ANOVA方差分析评估数据总体差异性,然后选用LSD法进行两两比较;如数据间方差不齐,则选用Kruskal-Wallis H检验评估数据总体差异性,并选用Dunnett’s T3方法进行两两比较。P<0.05为差异有统计学意义。
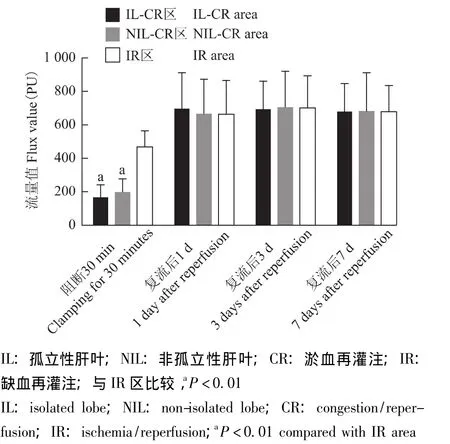
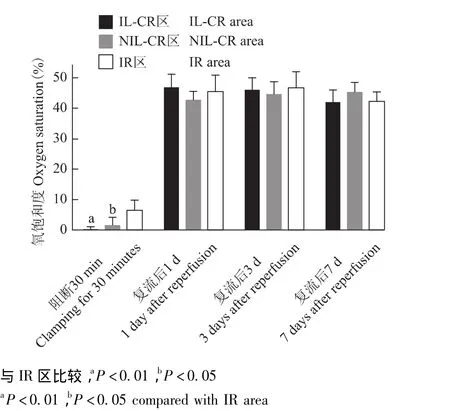
图2 各区域氧饱和度的变化Fig 2 Change of oxygen saturation in different areas
结 果
FV变化 短暂阻断肝血流30 min,未开放血流灌注前,IR区FV(466.60±97.26)PU与IL-CR区(164.96±76)PU、NIL-CR区 (200.91±75.04)PU比较,差异均有统计学意义 (P均<0.01);而IL-CR区与NIL-CR区的FV差异无统计学意义 (P>0.05)。复流后1、3、7 d各不同区组FV之间差异无统计学意义 (P>0.05)(图1)。
SO2变化 短暂夹闭肝静脉30 min,未开放血流灌注前,IR区SO2(6.67±3.25)%与IL-CR区 (0.10±0.12)% (P<0.01)、NIL-CR区 (1.68±2.76)%(P<0.05)差异有统计学意义;而IL-CR区与NILCR区的SO2差异无统计学意义 (P>0.05)。复流后1、3、7 d各不同区组SO2的差异无统计学意义 (P>0.05)(图2)。
病理切片观察结果 在肝静脉阻断30 min后,NIL-CR区与IL-CR区均出现肝窦扩张、重度充血、肝细胞水肿等表现,未见明显肝组织坏死表现;肝静脉开放后,于复流后1 d,NIL-CR区、IL-CR区充血、细胞水肿等情况有所缓解,但随之出现肝组织大片坏死;复流后3 d,NIL-CR区、IL-CR区仍可见轻微的细胞水肿或偶见细小坏死组织团,未见明显充血、片状肝组织坏死;复流后7 d,NIL-CR区、IL-CR区已恢复正常肝组织表现。在入肝血流阻断30 min后,IR对照区可见肝细胞水肿,无明显充血;入肝血流开放后,复流后1 d,IR对照区出现散在片状坏死,肝细胞轻微水肿,无充血表现;复流后3 d,IR对照区可见轻微的细胞水肿或偶见细小坏死组织团,未见明显充血、片状肝组织坏死;复流后7 d,IR对照区恢复正常肝组织表现 (图3)。
肝损伤的组织病理学量化评估 夹闭肝静脉30 min,未开放前,IR区Suzuki评分 (2.66±1.03)分与IL-CR区 (7.83±0.75)分、NIL-CR区 (7.50±0.54)分差异有统计学意义 (P均<0.01);而IL-CR区与NIL-CR区的Suzuki评分差异无统计学意义 (P>0.05)。复流后1 d,各区域内Suzuki评分差异有统计学意义 (P<0.01),除了充血、细胞水肿外,淤血区内的坏死面积大于缺血区,IR区 (4.33±0.81)分与IL-CR区 (6.66±0.51)分、NIL-CR区 (6.50±0.54)分差异有统计学意义 (P均<0.01);而IL-CR区与NIL-CR区的Suzuki评分差异无统计学意义 (P>0.05)。复流后3、7 d各不同区组Suzuki评分差异无统计学意义 (P>0.05)(图4)。
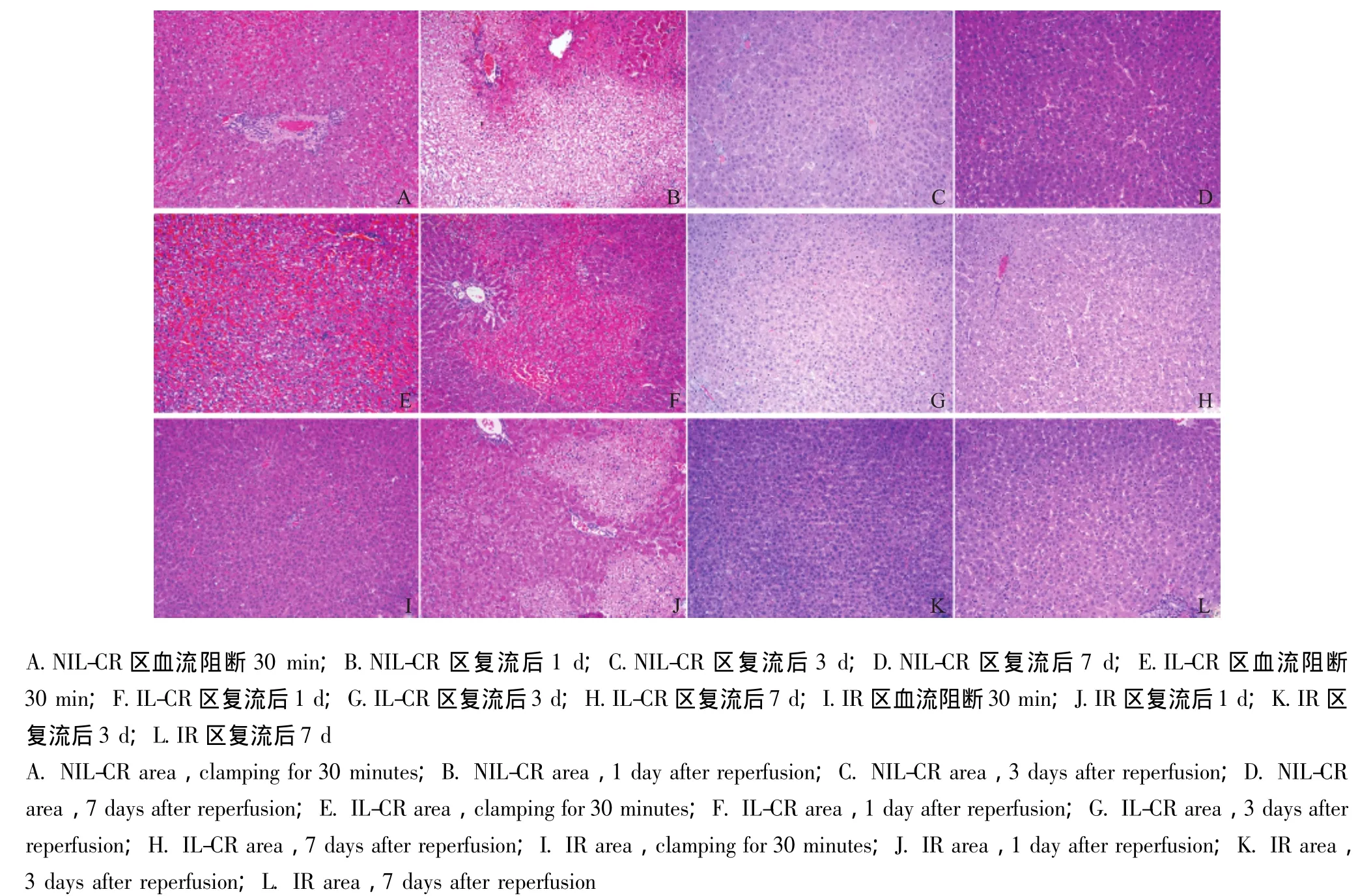
图3 各区域大鼠肝组织的HE染色 (×100)Fig 3 HE staining of rat liver in different areas(×100)
讨 论
本研究的组织病理学检测结果表明,CR亦会引致与IR类似的肝损伤效应[9]。Suzuki评分标准是目前被广泛应用于再灌注损伤的组织病理学量化指标[10-13]。通过Suzuki评分方法对不同区域的肝组织损伤进行量化评估,结果表明在相同时间的血流干扰后,CR区域的肝组织损伤明显重于IR区域,其主要表现是广泛肝窦扩张充血、严重的细胞水肿,而IR区域的肝损伤表现并不明显;复流后1 d,CR区域的肝组织坏死显著比IR区域的严重。Yan等[14]分别对小鼠的肝叶进行淤血、缺血处理,结果显示CRI比IRI更能显著地提高术后2 h的转氨酶指标,同时也与IR一致地加剧肝细胞凋亡。另有研究表明CRI比IRI能更确切地使肝功能指标恶化,同时更明显地抑制肝脏再生[6],这与本研究结果相符。因此判断CRI比IRI能引致更严重的早期肝脏损伤,而淤血区周边的肝组织情况并不影响肝损伤的严重程度。
在对正常大鼠观察中,同一大鼠肝脏各肝叶之间的血流动力学状况差异无统计学意义。因此,在实验组中,同一大鼠肝脏各肝叶之间的血流动力学改变的差异是由不同血流干预形式引起的。本研究在肝静脉急性梗阻时,淤血区域内肝组织的微循环灌注、SO2明显下降。有研究表明急性肝静脉梗阻将导致其引流区域的肝叶出现淤血,该区域将在一段时间内处于无或极低灌注状态[7,15-16]。此外,本研究显示出肝血流阻断区域的相关血流动力学指标远远低于入肝血流阻断区域,即在相同的血流干扰时间内,与缺血区域内的肝组织相比,淤血区域内的肝组织经历了更低灌注量、更低供氧的打击。
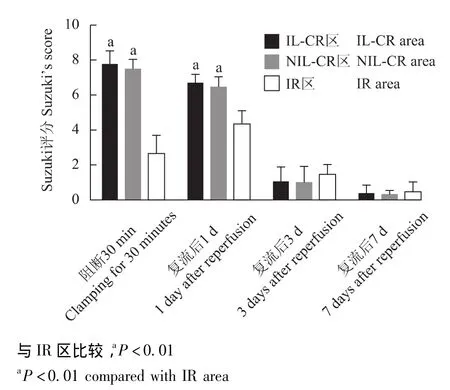
图4 各区域Suzuki评分的变化Fig 4 Change of Suzuki’s score in different areas
在不同的血流干预形式下对肝组织产生的影响并不相同。入肝血流阻断时,虽然缺血的肝叶颜色逐步变为苍白,但肝叶大体观与正常肝脏基本相似;然而,当出肝血流阻断时,淤血的肝叶会逐步变成暗红色,肿胀、张力增大[17-18]。此外,肝淤血还能额外引起窦内压升高、代谢产物堆积等效应。Yan等[14]指出:CRI比IRI更能显著升高再灌注损伤的相关炎性因子和趋化因子,此外,复流后的2 h CR的无灌注肝窦比例高于IR,提示CR的肝组织微循环恢复更慢。Smyrniotis等[19]研究表明在入肝血流阻断时,肝静脉回流的血液能辅助减轻肝组织缺血损伤。Sato等[20]的研究提示在入肝血流阻断情况下,肝静脉的回流血液对肝组织的供氧发挥重要作用。笔者认为这正是本研究中入肝血流阻断肝叶的FV、SO2远远高于出肝血流阻断肝叶的根本原因。肝脏缺血再灌注损伤是由短暂剥夺肝组织的供血及供氧引发,并在血液复流同时产生更严重的再灌注损伤,如氧应激及多种炎症效应因子协同作用并级联放大所导致的肝细胞坏死和炎性浸润[21]。研究表明虽然短时间阻断后随即恢复肝组织血流灌注,但复流后的肝组织内白介素-6、肿瘤坏死因子-α等因子仍不断升高并引起肝损害、肝功能不全[22]。这与本研究结果肝组织血流、血氧与肝损伤指标变化不同步的现象是一致的。
Dirsch等[7]指出大鼠局部肝叶静脉梗阻后,淤血区将通过交界处的“肝窦血管化”途径进行血流动力学重构并形成新的流出道,使区域内的血液流向临近正常区域进行代偿。临床的观察中亦发现了同样的现象,称为 “肝内脉络”,Kaneko等[23]和 Yan等[24]均发现在活体肝移植术后,在剥夺肝中静脉的供体中,肝中静脉支与肝右静脉支之间有“肝内脉络”逐步形成,并指出发现“肝内脉络”形成的移植物功能无恶化倾向。然而,本研究显示淤血区周边是否有正常肝组织接壤的因素并不对CR的损伤程度产生影响,提示“肝窦血管化”形式的血流动力学重构是一缓慢过程,在肝静脉阻断后的一段长时间内,淤血区肝组织并不能形成有效的代偿机制,随着时间推移,肝损伤将不断加重。
综上,肝静脉阻断能更显著地降低肝组织末梢循环的血流灌注和氧饱和度,导致CR比IR产生更显著的肝损伤效应。淤血区周边是否有正常肝组织接壤的因素并不对CR的损伤程度产生影响。提示在临床实践中应提高对肝静脉阻断后重建、淤血再灌注损伤等情况的重视。
[1] Lee SG,Park KM,Hwang S,et al.Adult-to-adult living donor liver transplantation at the Asan Medical Center,Korea[J].Asian J Surg,2002,25(4):277-284.
[2] Kubota T,Togo S,Sekido H,et al.Indications for hepatic vein reconstruction in living donor liver transplantation of right liver grafts[J].Transplant Proc,2004,36(8):2263-2266.
[3] Scatton O,Plasse M,Dondero FA,et al.Impact of localized congestion related to venous deprivation after hepatectomy[J].Surgery,2008,143(4):483-489.
[4] Heaton N,Srinivasan P,Prachalias A,et al.Overcoming the limitations of living donor and split liver transplantation:a proposal for adult recipients(the best of the East in the West)[J].Liver Transpl,2008,14(7):932-934.
[5] Yamashita C,Wakiyama H,Okada M,et al.Hepatic microcirculation during transient hepatic venous occlusion-intravital microscopic observation using hepatic vein clamp model in the mouse [J].Kobe J Med Sci,1998,44(5-6):199-203.
[6] Tan X,Xu W,Ge X,et al.Influences of congestion/reperfusion injury on remnant liver in rats after hepatectomy [J].Nan Fang Yi Ke Da Xue Xue Bao,2013,33(3):332-337.
[7] Dirsch O,Madrahimov N,Chaudri N,et al.Recovery of liver perfusion after focal outflow obstruction and liver resection [J].Transplantation,2008,85(5):748-756.
[8] Suzuki S,Toledo-Pereyra LH,Rodriguez FJ,et al.Neutrophil infiltration as an important factor in liver ischemia and reperfusion injury.Modulating effects of FK506 and cyclosporine[J].Transplantation,1993,55(6):1265-1272.
[9] Zhai Y,Busuttil RW,Kupiec-Weglinski JW.Liver ischemia and reperfusion injury:new insights into mechanisms of innate-adaptive immune-mediated tissue inflammation [J].Am J Transplant,2011,11(8):1563-1569.
[10] Kamo N,Ke BB,Busuttil RW,et al.PTEN-mediated akt/beta-catenin/foxo1 signaling regulates innate immune responses in mouse liver ischemia/reperfusion injury[J].Hepatology,2013,57(1):289-298.
[11] Kuriyama N,Isaji S,Kishiwada M,et al.Dual cytoprotective effects of splenectomy for small-for-size liver transplantation in rats[J].Liver Transpl,2012,18(11):1361-1370.
[12] Shen XD,Ke B,Ji H,et al.Disruption of type-I IFN pathway ameliorates preservation damage in mouse orthotopic liver transplantation via HO-1 dependent mechanism [J].Am J Transplant,2012,12(7):1730-1739.
[13] Ocuin LM,Zeng S,Cavnar MJ,et al.Nilotinib protects the murine liver from ischemia/reperfusion injury[J].J Hepatol,2012,57(4):766-773.
[14] Yan S,Zhou B,Zhang QY,et al.Hepatic venous occlusion causes more impairment after reperfusion compared with portal clamping in a murine model[J].J Surg Res,2011,169(1):117-124.
[15] Okuno A,Kimura F,Nakagawa K,et al.Effects of partial hepatic venous congestion on hepatic hemodynamics and histology[J].Hepatogastroenterology,2010,57(97):127-133.
[16] Subrt Z,Ferko A,Hoffmann P,et al.Temporary liver bloodoutflow occlusion increases effectiveness of radiofrequency ablation:an experimental study on pigs[J].Eur J Surg Oncol,2008,34(3):346-352.
[17] Frulio N,Laumonier H,Balabaud C,et al.Hepatic congestion plays a role in liver stiffness[J].Hepatology,2009,50(5):1674-1675.
[18] Lebray P,Varnous S,Charlotte F,et al.Liver stiffness is an unreliable marker of liver fibrosis in patients with cardiac insufficiency[J].Hepatology,2008,48(6):2089.
[19] Smyrniotis V,Kostopanagiotou G,Lolis E,et al.Effects of hepatovenous back flow on ischemic-reperfusion injuries in liver resections with the pringle maneuver[J].J Am Coll Surg,2003,197(6):949-954.
[20] Sato T,Asanuma Y,Kusano T,et al.Difference in hepatic tissue oxygenation between total vascular exclusion and inflow occlusion of the liver and the possible role of hepatic venous blood under liver ischemia [J].Dig Surg,1998,15(1):15-20.
[21] Walsh KB,Toledo AH,Rivera-Chavez FA,et al.Inflammatory mediators of liver ischemia-reperfusion injury [J].Exp Clin Transplant,2009,7(2):78-93.
[22] de Graaf W,Heger M,Spruijt O,et al.Quantitative assessment of liver function after ischemia-reperfusion injury and partial hepatectomy in rats [J].J Surg Res,2012,172(1):85-94.
[23] Kaneko T,Kaneko K,Sugimoto H,et al.Intrahepatic anastomosis formation between the hepatic veins in the graft liver of the living related liver transplantation:observation by Doppler ultrasonography [J].Transplantation,2000,70(6):982-985.
[24] Yan L,Wu H,Chen Z,et al.Intrahepatic venous collaterals formation following outflow block in adult-to-adult living donor liver transplantation [J].J Surg Res,2008,146(2):172-176.

