Allolaurinterol类倍半萜的分离合成及生物活性研究进展
陈建新,刘腾蛟,王瑾瑾,赵陆洋,索超,卢爱党
(河北工业大学 海洋科学与工程学院,天津300130)
海洋是人类物质资源的天然宝库,已知海洋生物的物种总数占地球生物的80%以上[1]。萜类化合物是海洋生物活性物质的重要组成部分,广泛分布于海洋红树植物、海藻、珊瑚、海绵等海洋生物中[2]。在已发现的化合物中包括萜类、甾体类、多肽、聚醚类、大环内酯类、生物碱、多糖等化合物,约50%具有各种生物活性,超过0.1%的化合物结构新颖,活性显著,极有可能开发成药[3]。近年来对天然产物的提取、分离精制方法新技术的发展,为海洋天然产物有效成分的分离纯化提供了可能[4]。因此,从海洋天然产物中寻找新型活性药物先导已成为当今研究的热点。对国内外近几十年来有关海洋藻类植物中Allolaurinterol及其衍生物的分离、合成及生物活性研究进行总结,旨在为国内同行系统地了解该类化合物并推动其创新研究提供参考。
1 Allolaurinterol分离及生物活性
Allolaurinterol(1,图1)最早由澳大利亚Kazlauskas小组于1976年从澳大利亚南海岸的红藻(Laurenciafiliformisf.heteroclada)中分离得到,该小组通过乙酰化制备出Allolaurinterol acetate(2,图1),同时还首次分离得到新型倍半萜类化合物Filiformin(3,图1)和Filiforminol(4,图1),并 证 实Filiformin(3)可 以 通 过Allolaurinterol(1)在三氟乙酸催化下分子内加成制得[5]。
1977年,美国加州的Wratten小组在红藻门植物Laurenciasubopposita中分离得到Allolaurinterol(1),并 指 出Allolaurinterol(1)为 红 藻 类 植 物 抗 菌 的 活 性 成 分[6]。1988年,Ghisalberti课题组从澳大利亚4个不同的地点(Hamelin Bay,Shoalwater Bay,Cottesloe Beach和Lancelin)收集到的红藻中分离得到Allolaurinterol(1)和Filiformin(3)[7]。1991年,Usmanghani课题组首次从巴基斯坦卡拉奇海岸的红藻门杉海苔科植物巢沙菜(Hypnea pannosaJ.Ag.)中分离得到Filiformin(3)和Filiforminol(4)[8]。
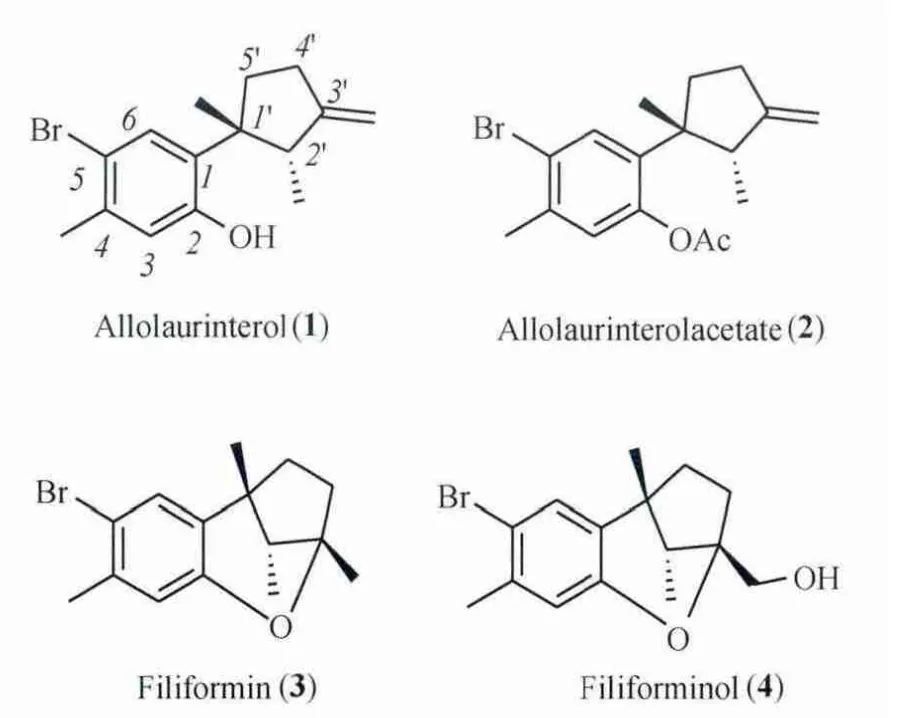
图1 Allolaurinterol、Allolaurinterol acetate、Filiformin和Filiforminol的结构
1997年,德国König小组从产于多米尼加岛的钝形凹顶藻(Laurenciaobtusa)中分离到Allolaurinterol(1),并研究了其抑菌活性。从77.0g冻干的钝形凹顶藻中可以分离到336mg Allolaurinterol(1),生物活性测试分别采用4种真菌:黑粉菌属(Ustilagoviolacea),霉菌属(Mycotypha.microspora),散囊菌属(Eurotium repens),镰刀菌属(Fusariumoxysporum);2种细菌:巨大芽胞杆菌(Bacillusmegaterium)和大肠杆菌;1种小球藻(Chlorellafusca)。结果表明Allolaurinterol(1)具有抗真菌、抗革兰氏阳性菌和抗藻作用,其中对巨大芽胞杆菌和黑粉菌属作用最为显著,对前者的MIC为4μg/mL,对照药苄青霉素为2μg/mL;对后者剂量为2μg/mL时没有出 现 抑 菌 圈,当 剂 量 为3μg/mL、4μg/mL和5μg/mL时产生的抑菌圈直径分别为1mm、2mm和3mm,对照药咪康唑3μg/mL产生的抑菌直径为15mm[9-10]。
2001年,新西兰Copp课题组首次从软体动物海兔(sea hareaplysiadactylomela)中分离到Allolaurinterol(1)和Allolaurinterol acetate(2),同时研究了化合物的抗肿瘤和抗菌活性,Allolaurinterol(1)对 肿瘤细胞系P388和BSC-1表现出中等的抑制活性,但表现出很好的抑制枯草芽孢杆菌(B.subtilis)活性(抑菌圈10mm,剂量120μg/mL)。Allolaurinterol acetate(2)的抗肿瘤和抗菌活性明显下降[11]。
2004年,马来西亚的Vairappan小组从日本和马来西亚的海洋红藻中分离到Allolaurinterol(1),并研究了其抗22种人体病原菌的活性。如表1中数据所示,Allolaurinterol(1)表现出了广谱的杀菌活性,尤其值得一提的是其对人体耐药性菌株仍然表现出很好的抑制活性,为创制作用机制独特的新型广谱杀菌剂提供了新先导[12]。
2008年,巴西Teixeira课题组从红藻门植物Laurenciacaduciramulosa中分离得到Filiformin(3)[13]。
2009年,澳大利亚Dias课题组从澳大利亚南海岸的红藻(Laurenciafiliformisf.heteroclada)中分离得到Allolaurinterol(1),Filiformin(3)和Filiforminol(4),该小组首次研究了Filiformin(3)的单晶结构[14]。
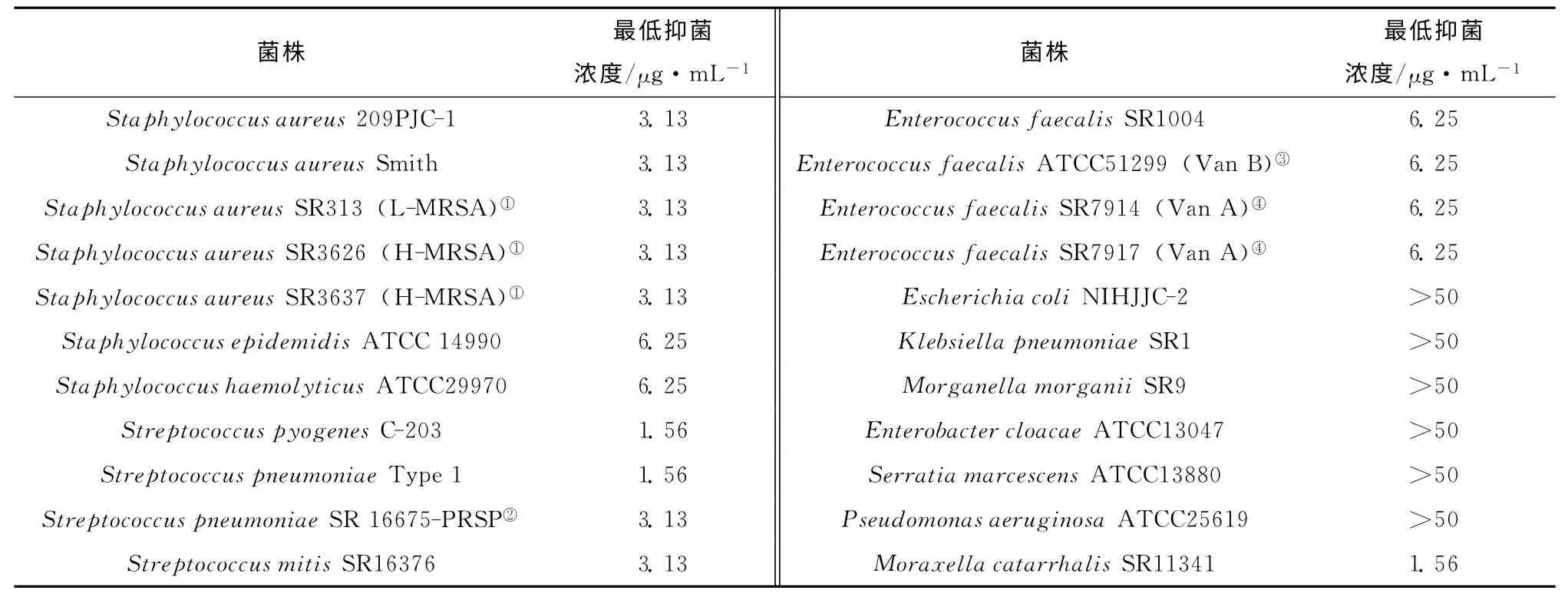
表1 Allolaurinterol(1)抑制22种人体病原菌的活性
2010年,中国科学院上海生命科学研究院药物研究所郭跃伟课题组对采自中国东海的红藻冈村凹顶藻Laurenciaokamurai的化学成分进行研究,分离得到Filiformin(3)[15]。
2012年,中国科学院烟台海岸带研究所的季乃云课题组从中国荣成半岛的红藻Laurencia okamurai中分离到Filiformin(3)。抑菌活性测试发现,Filiformin(3)具有很好的抗菌活性(30μg浓 度 下,抑 菌 圈Escherichiacoli:14mm;Staphylococcusaureus:12mm)[16]。
2 Allolaurinterol及其衍生物的合成
2.1 (±)-Allolaurinterol(1)的合成
目前为止,有关Allolaurinterol(1)的研究主要集中在分离方面,仅有美国华盛顿州立大学的Ronald课题组在1982年报道的一例关于(±)-Allolaurinterol的全合成研究(scheme 1)[17]。该小组由3-甲氧甲氧基甲苯(5)出发,经邻位金属化后与酮加成得氯代物6,碱性条件下关环得7,再经氯化甲基化成功将醇羟基转化为甲基得8,二氧化铂催化氢化得化合物9,强碱条件下脱氢开环得10,叔丁基二甲基硅保护羟基得11,硼氢化氧化引入羟基得12,PCC氧化得酮13,溴化得14,溴化物14经常规的Wittig反应并不能引入双键,经条件优化他们发现在CH2Br2,Zn,TiCl4条件下14以84%的收率转化为15,最后经脱保护得到外消旋体Allolaurinterol,见图2。该路线经13步以0.03%的总收率得到(±)-Allolaurinterol,苛刻的反应条件和极低的反应收率限制了其在研究中的应用。
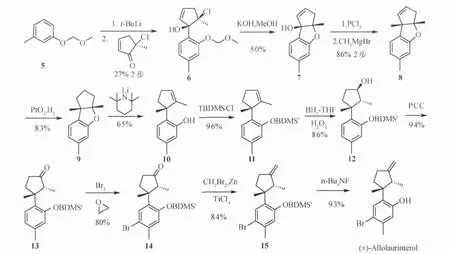
图2 Allolaurinterol(1)的合成路线
2.2 (±)-Allolaurinterol acetate(2)的合成
从(±)-Allolaurinterol(1)出 发,在DABCO作用下将(±)-Allolaurinterol(1)中酚羟基进行酯化,合成类似物(±)-Allolaurinterol acetate(2)[5],具体见图3。
2.3 (±)-Filiformin(3)的合成
(±)-Allolaurinterol(1)在三氟乙酸催化作用下,发生分子内的加成得到(±)-Filiformin(3)[5],具体见图4。
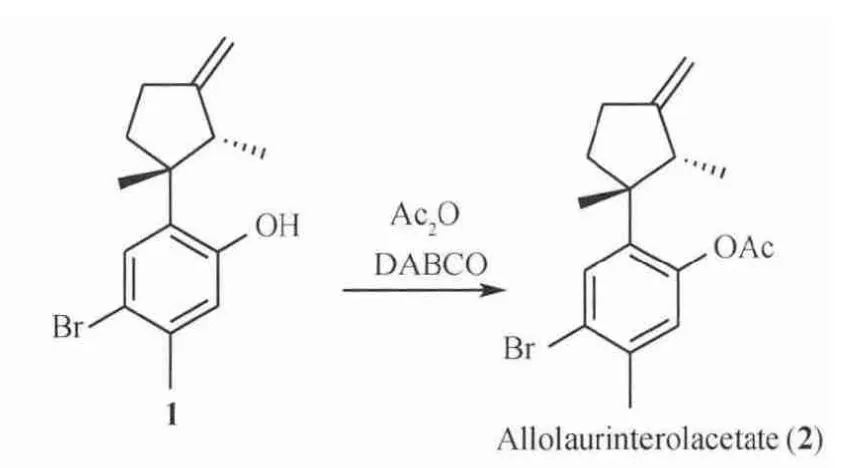
图3 Allolaurinterol acetate(2)的合成
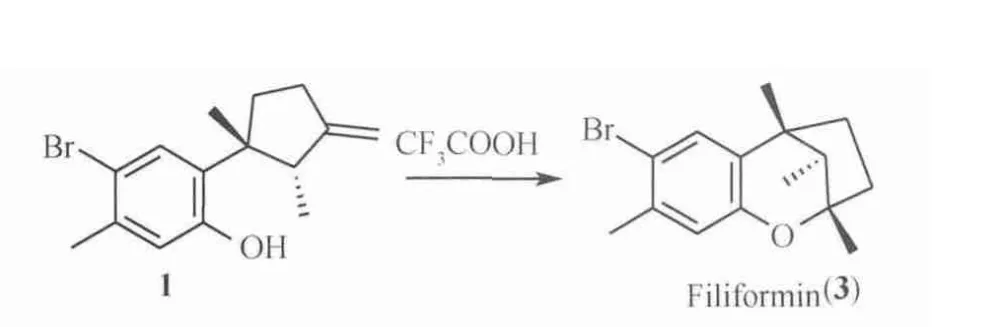
图4 Filiformin(3)的合成
2.4 (±)-Filiforminol(4)的合成
1997年,韩国Yoo课题组报道了(±)-Filiforminol(4)的全合成[18]。该小组由3-甲基环戊-2-烯酮出发,与格式试剂17发生加成反应然后在HMPA作用下对酮的α位进行甲基化得18,化合物18a经Tebbe试剂使羰基亚甲基化可以得到化合物19,19在NaSEt的DMF溶液中回流即可实现酚羟基甲醚键的断裂得到20。化合物20在oxone作用下烯烃发生环氧化,β-环氧化产物21自发的发生环氧开环反应得22,再经溴化得到(±)-Filiforminol(4),具体见图5。
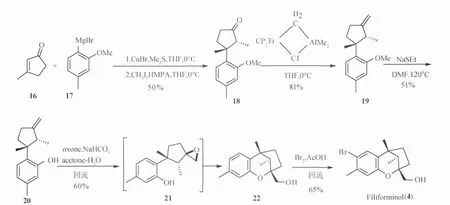
图5 Filiforminol(4)的合成
3 结论与展望
综上所述,通过对倍半萜Allolaurinterol及其衍生物的提取分离及活性方面的综述,不难看出倍半萜Allolaurinterol不仅对多种菌种有很好的抗菌活性,而且还有抗肿瘤、抗藻作用。然而,该类杀菌剂合成路线还不成熟,目前报道的合成路线长,总的收率比较低。这就限制了对其生物活性更深入系统的研究,相信不久的将来,操作简单、成本低、收率高的合成路线将会出现。
[1] Staley A L,Rinehart K L.Spectomycins,new antibacterial compounds produced by Streptomyces spectabilis:Isolation,structures,and biosynthesis[J].J.AntibiotTokyo,1994,47(12):1425-1433.
[2] 付青姐,李明春.海洋萜类化合物及其生物活性研究进展[J].中国海洋药物杂志,2009,28(6):52-58.
[3] 王长云,耿美玉,管华诗.海洋药物研究进展与发展趋势[J].中国新药杂质,2005,14(3):278-282.
[4] 谭天伟.天然产物分离新技术[J].化工进展,2003,22(7):665-668.
[5] Kazlauskas R,Murphy P T,Quinn R J,et al.New Laurene derivatives from Laurencia filiformis[J].Aust.J.Chem.,1976,29:2533-2539.
[6] Wratten S J,Faulkner D J.Metabolites of the red alga Laurencia subopposita[J].J.Org.Chem.,1977,42:3343-3349.
[7] Capon R J,Ghisalberti E L,Mori T A,et al.Sesquiterpenes from Laurencia SPP[J].J.Nat.Prod.,1988,51:1302-1304.
[8] Afaq-Husain S,Shameel M,Usmanghani K,et al.Brominated sesquiterpene metabolites of Hypnea pannosa(Gigartinales,Rhodophyta)[J].J.Appl.Phycol.,1991,3:111-113.
[9] König G M,Wright A D.Sesquiterpene content of the antibacterial dichloromethane extract of the marine red algaLaurenciaobtusae[J].Planta.Med.,1997,63:186-187.
[10] 王宗伟 摘译.Allolaurinterol:钝形凹顶藻中具有抗菌作用的倍半萜成分[J].中国海洋药物,1997,3:36-36.
[11] Appleton D R,Babcock R C,Copp B R.Novel tryptophan-derived dipeptides and bioactive metabolites from the sea hareAplysiadactylomela[J].Tetrahedron,2001,57:10181-10189.
[12] Vairappan C S,Kawamoto T,Miwa H,et al.Potent antibacterial activity of halogenated compounds against antibiotic-resistant bacteria[J].Planta.Med.,2004,70:1087-1090.
[13] Cassano V,De-Paula J C,Fujii M T,et al.Sesquiterpenes from the introduced red seaweedLaurencia caduciramulosa(Rhodomelaceae,Ceramiales)[J].Biochem.Syst.Ecol.,2008,36:223-226.
[14] Dias D A,White J,Urban S.Laurencia filiformis:Phytochemical profiling by conventional and HPLC-NMR approaches[J].Nat.Prod.Commun.,2009,4:157-172.
[15] Mao S C,Guo Y W.Sesquiterpenes from Chinese red algaLaurenciaokamurai[J].Chin.J.Nat.Med.,2010,8:321-325.
[16] Li X D,Miao F P,Li K,et al.Sesquiterpenes and acetogenins from the marine red algaLaurenciaokamurai[J].Fitoterapia,2012,83:518-522.
[17] Gewali M B,Ronald R C.Synthesis of Allolaurinterol[J].J.Org.Chem.,1982,47:2792-2795.
[18] Yoo S,Suh J H,Yi K Y.Total synthesis of(±)-filiforminol and(±)-bromoether A[J].Synthesis,1998(5):771-774.
——青蒿素

