PI3K/Akt/GSK3β信号通路及内质网应激蛋白在大鼠难免性压疮形成中表达变化
崔飞飞,张菊芳,吴海英,宋亚军,蒋美琴,翁玉英,姜丽萍
压疮(又称压迫性溃疡)分浅表性溃疡和深层溃疡,2007年美国压疮顾问小组(National Pressure Ulcer Advisory Panel,NPUAP)将深层溃疡重新定义为深部肌肉组织损伤,临床上称其为“恶性压疮”或“难免性压疮”[1-2]。研究发现,肌肉损伤后其恢复和细胞凋亡是同步进行的,倘若细胞凋亡持续存在,则不利于肌肉的恢复[3]。因此,肌肉细胞凋亡在难免性压疮恢复进程中发挥重要潜在作用。研究发现,内质网介导的细胞损伤在凋亡过程中发挥着重要作用,其中磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinases,PI3K)/蛋白激酶B(protein serine threonine kinase,Akt)/糖原合成激酶3β(glycogen syn-thase kinase3β,GSK3β)信号通路是维持细胞正常生存和功能的重要信号转导途径,在缺血性损伤和再灌注损伤中起明显的保护作用[4]。目前在肿瘤、心、脑缺血-再灌注损伤等领域研究较多,但PI3K/Akt/GSK3β信号通路在难免性压疮中的研究鲜见报道。本研究通过动物模型来观察、探讨PI3K/Akt/GSK3β信号通路和内质网分子伴侣在难免性压疮形成过程中的表达变化及作用。
1 材料和方法
1.1 动物及主要试剂 健康成年雄性SD大鼠54只(上海斯莱克实验动物有限责任公司提供),体质量320~350 g。大鼠自由饮水、进食,室温(25±2)℃,分笼喂养。抗体葡萄糖调节蛋白78(GRP78)、转录因子C/EBP同源蛋白(CHOP)、Akt、P-Akt、GSK3β、P-GSK3β由Santa Cruz Biotechnology提供,天冬氨酸特异性半胱氨酸蛋白酶12(caspase-12)、半胱氨酸天冬氨酸蛋白酶-3(caspase-3)抗体从Abcam公司购买,二抗和内参抗体分别由上海碧云天生物技术研究所和武汉博士德生物工程有限公司提供。
1.2 动物模型制备
1.2.1 难免性压疮(可疑深部组织损伤)判断标准[5]:2007年,NPUAP对压疮深部肌肉组织损伤的诊断标准:皮下软组织受到压力或剪切力的损害,局部皮肤完整但可出现颜色改变如紫色或褐红色,或导致充血的水疱。与周围组织比较,这些受损区域的软组织可能有疼痛、硬块、渗出、潮湿、发热或冰冷(见图1)。
1.2.2 模型制备及分组:参照王艳艳等[6]的方法制备压疮深部组织损伤动物模型,来模拟临床难免性压疮发生的背景。用10%水合氯醛按300 mg/kg腹腔注射麻醉后,将大鼠俯卧于泡沫床垫上,用剪毛刀对其大腿两侧股薄肌部位进行剪毛,暴露施压部位。按照随机数字表法将大鼠分为正常对照组(Con组),1个周期受压组(1c组)、3个周期受压组(3c组)、6个周期受压组(6c组)、9个周期受压组(9c组)和恢复期1 d、3 d、5 d、7 d组,每组各6只。各组大鼠体质量与Con组相比,差异无统计学意义。本实验模拟临床压疮发生的处理为于大鼠两侧大腿股薄肌施加22.47 kPa压力,持续施压2 h,放松0.5 h,即1c组(见图1C-D)。1c组大鼠模拟压疮处理1次;3c组大鼠1 d内模拟压疮处理3次,只处理1 d;6c组大鼠1 d内模拟压疮处理3次,连续处理2 d;9c组大鼠1 d内模拟压疮处理3次,连续处理3 d;恢复期组为大鼠9c组后,解除压力,分别于第1、第3、第5、第7天,观察局部受压组织的变化,Con组大鼠未行施压处理。各组大鼠于施压处理结束后给予安乐处死。
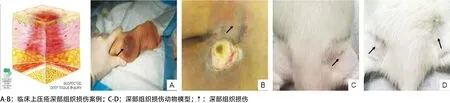
图1 临床和动物深部组织损伤模型及案例
1.3 检测方法 在实验终点,在冰上迅速切取各组受压中心部位肌肉组织,于4 ℃ 0.9%氯化钠溶液中快速洗去血液,用滤纸吸干水分并且剪碎后于 -80 ℃超低温冰箱保存备用。另取相同部位受压肌肉组织(0.5 cm×0.5 cm×0.5 cm),4 ℃ 0.9%氯化钠溶液洗净血液后,4%的多聚甲醛-PBS液固定,脱水,常规石蜡包埋,蜡块连续切片5μm厚,进行组织形态学分析。冻存的所有样品于研究结束时,进行匀浆,离心(4 ℃,12 000 r/min,15 min)收集上清液用于蛋白质免疫印迹(Western blotting)法 检测。
1.3.1 组织形态学观察:组织常规脱蜡,梯度透明,HE染色,用Nikon(TE 2000-U)显微镜观察,NIS Elements图像采集软件采集图像,观察受压组和恢复组在不同阶段局部受压肌肉组织病理学变化。
1.3.2 免疫组织化学法:采用SABC法,常规设立阴性对照。3% H2O2处理后热修复抗原,5% BSA封闭,一抗(1:400)4 ℃过夜,生物素化二抗37 ℃孵育30 min,DAB显色,苏木精复染,中性树胶封片,镜下进行定性观察。每张组织切片在×20物镜下观察4个视野(不重复),计数阳性细胞核数,以每平方毫米的阳性细胞核数(n/mm2)来表示。
1.3.3 Western blotting法:取各组大鼠肌肉组织各200 mg(于冰上进行操作),加入0.5 mL组织蛋白裂解液ZD408,电动匀浆器将组织研碎,4 ℃离心,取上清,按Bradford法测量蛋白浓度。每孔上样20μL,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,恒压转膜,30 V恒压预跑15 min,80 V恒压电泳跑至浓缩胶和分离胶分界线,120 V恒压电泳90 min。再120 V恒压转膜90~120 min。50 g/L脱脂奶粉封闭1 h,加入一抗(GRP78、CHOP、Akt、p-Akt、GSK3β、p-GSK3β的一抗浓度为1:300,caspase-12和 GAPDH的一抗浓度为1:1 000)孵育,4 ℃过夜。Tris-吐温20缓冲液洗涤,加入辣根过氧化物酶标记二抗(GRP78、CHOP的二抗浓度为1:1 000,caspase-12、Akt、p-Akt、GSK3β、p-GSK3β和GAPDH的二抗浓度为1:2 000),室温孵育1 h,洗涤后,暗室中加化学发光显色液显色,X线胶片曝光,常规方法显影、定影。以GAPDH作为内参,采用Quantity One灰度分析软件分析条带的灰度值,结果以目的蛋白GRP78、CHOP、caspase-12与GAPDH内参比值表示,p-Akt、p-GSK3β蛋白含量用p-Akt/Akt,p-GSK3β/GSK3β表示。本实验重复进行3次。
1.4 统计学处理方法 采用SPSS 16.0统计软件进行单因素方差分析,数据以±s表示,两两比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 HE染色观察各组肌肉形态学变化 光镜下HE染色观察受压肌肉组织显示:Con组肌纤维排列紧密,形态正常,结构清晰,骨骼肌横纹清晰,无明显的炎性细胞浸润(见图2A),与Con组相比,随着受压周期的延长,受压组肌肉组织逐步出现退化的病理变化。表现为肌纤维排列紊乱、水肿,肌间隙增宽并出现少量的碎片(见图2B-C),间质区域出现炎症细胞浸润逐渐加重,肌纤维出现溶解、断裂,坏死碎片,空泡变性,玻璃样变性等病理改变(见图2C-E);恢复期1 d组发现在肌纤维溶解、断裂,坏死区域有大量的炎性细胞聚集(见图2F),随后的炎性细胞逐渐减少,但还存在大量的肌纤维紊乱、断裂,坏死碎片等病理变化(见图2G-I)。
2.2 受压肌肉组织中caspase-3蛋白在不同阶段的 表达 免疫组织化学检测结果显示:caspase-3免疫 阳性产物呈棕黄色颗粒,主要位于胞浆。caspase-3蛋白在Con组中呈弱表达,随着时间延长,其蛋白表达逐渐增加,9c组表达显著;恢复期1 d组表达达高峰,随后表达开始下降,见图3。
2.3 Western blotting法检测内质网应激相关蛋白的表达 检测结果显示:与Con组相比,蛋白GRP78、CHOP、caspase-12的表达表现为损伤后呈上升趋势,GRP78在3c组出现第一次峰值(P<0.05),恢复期1 d组表达显著(P<0.05),5 d组出现第二次峰值(P<0.01),7 d组开始下降(P<0.05),但仍高于Con组;CHOP在1c组表达显著(P<0.05),9c组出现第一次高峰(P<0.01),恢复期1 d、3 d组表达下降(P<0.05),5 d组表达又开始上升(P<0.05),7 d组表达达高峰(P<0.01);caspase-12在6c组表达显著(P<0.05),9c组出现第一次峰值(P<0.01),1 d、3 d组持续高表达(P<0.05),之后略有下降(P<0.05),但仍明显高于Con组,见图4。
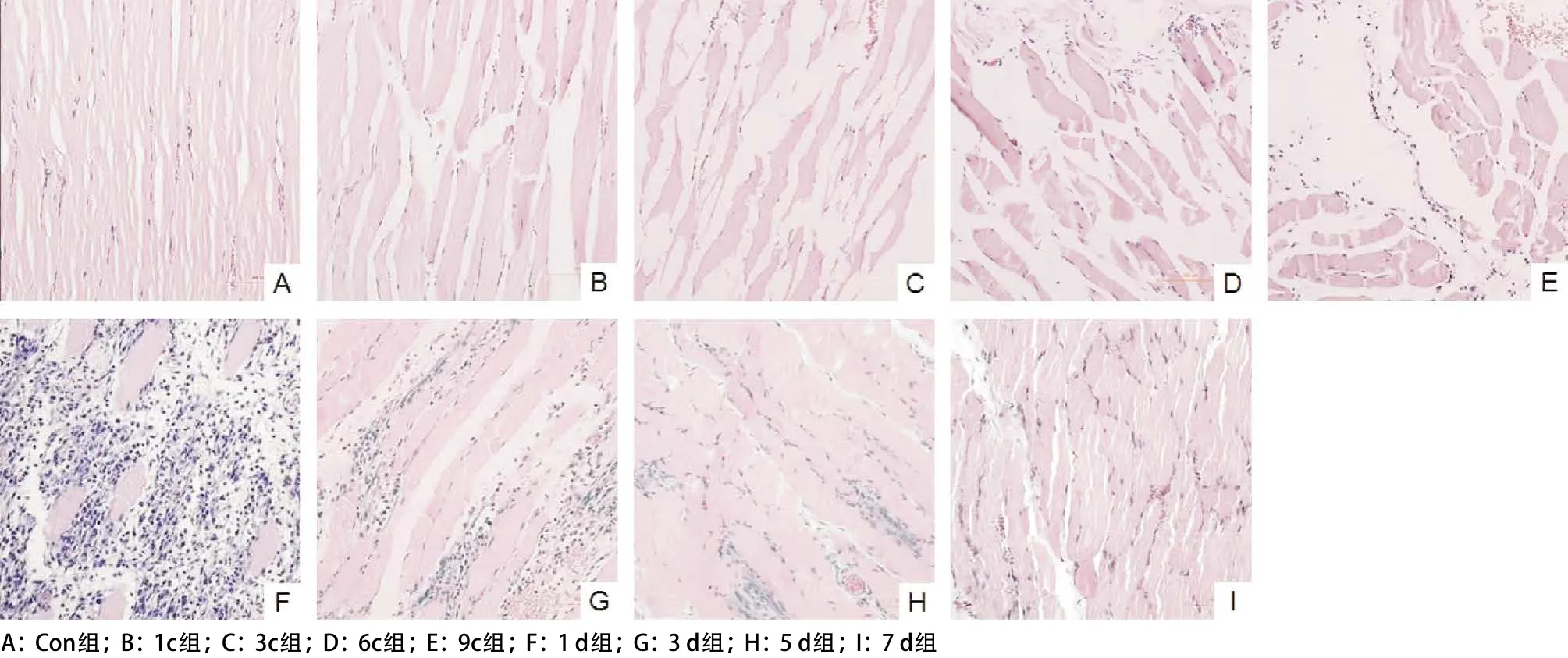
图2 不同组受压肌肉组织的组织改变(HE,×200)
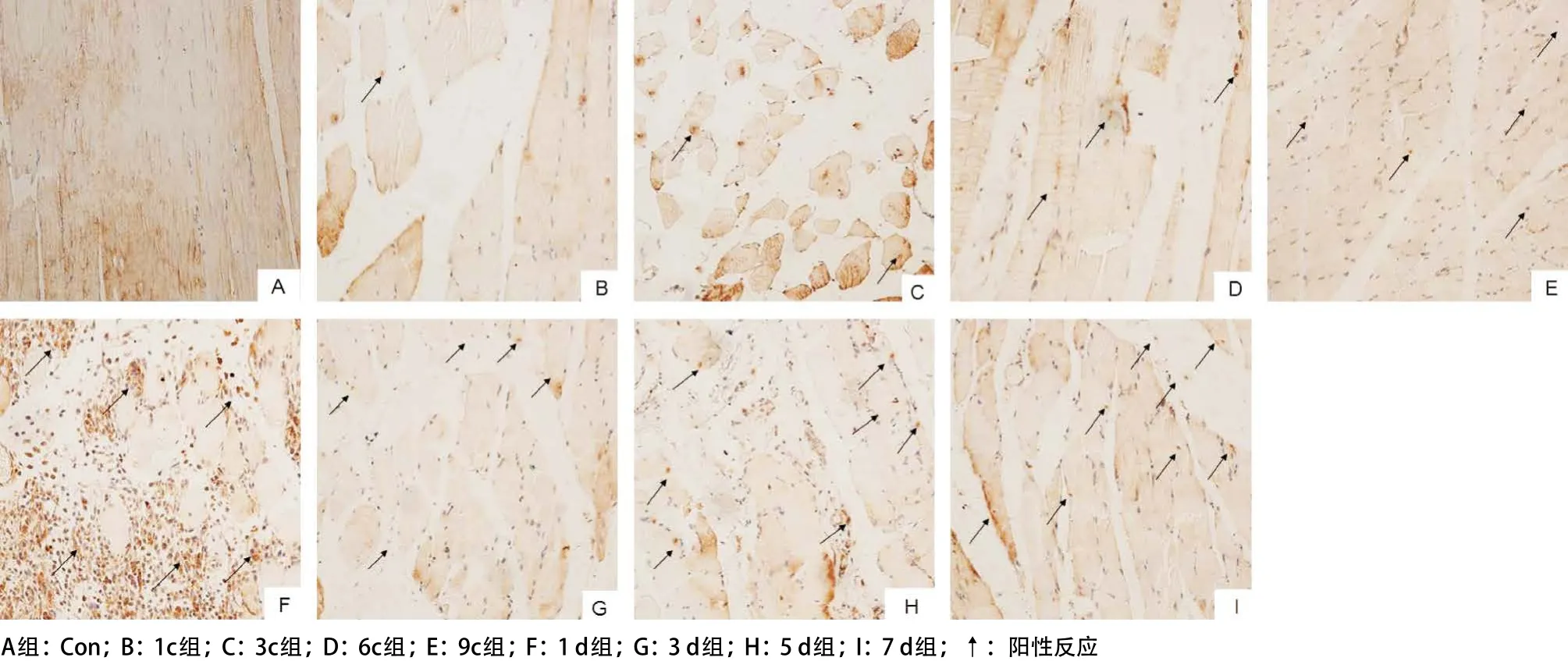
图3 不同组受压肌肉组织中的caspase-3的表达(IHC,×200)
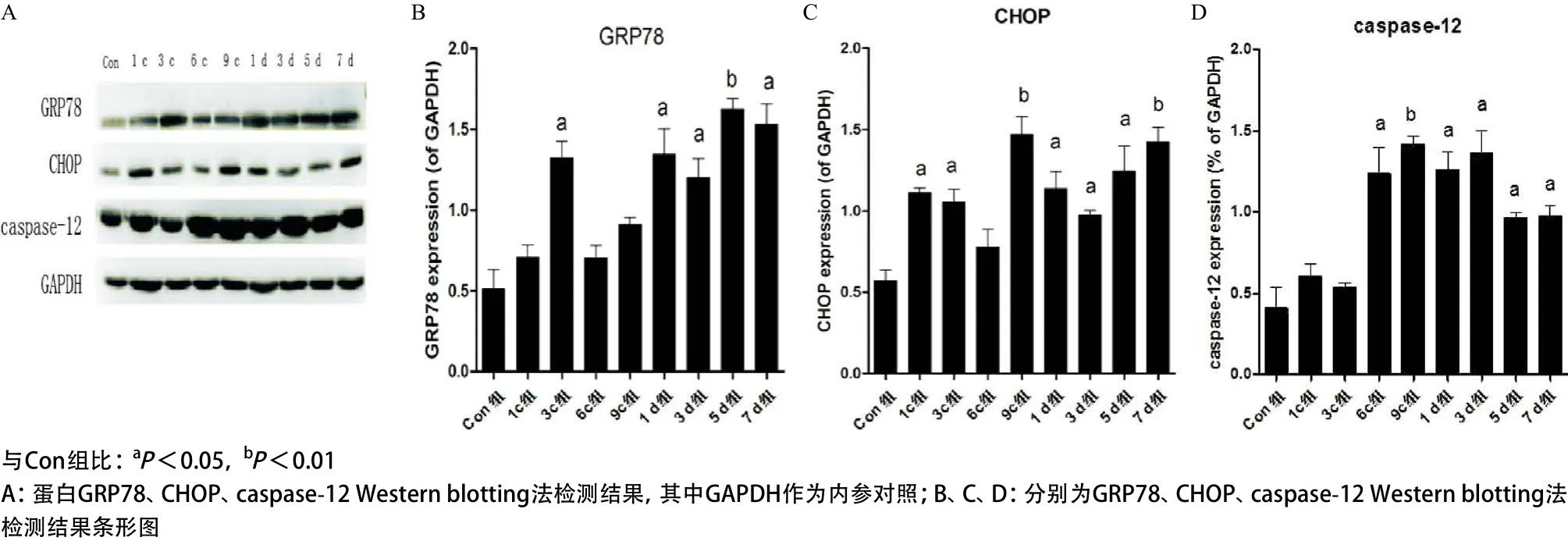
图4 不同组受压肌肉组织中GRP78、CHOP、caspase-12的表达
2.4 Western blotting法检测Akt、GSK3β蛋白及其磷酸化程度 检测结果显示:与Con组相比,受压组和恢复组p-Akt蛋白表达呈先上升后下降的趋势。1c组,p-Akt表达显著(P<0.01),9c组蛋白表达下降最为明显(P<0.001);1 d组表达开始增加(P<0.001),3 d组表达呈现第一次高峰(P<0.001);p-GSK3β蛋白表达呈先上升后下降的趋势,在1c、3c组,表达开始升高(P<0.05),6c组表达开始下降,但差异无统计学意义(P>0.05),9c组蛋白表达下降最为明显(P<0.05);恢复组p-GSK3β蛋白表达呈先下降后上升趋势,表现为与9c组相比,1 d组略有下降(P<0.05),3 d组下降明显(P<0.01),5 d 组表达开始增加(P<0.01),7 d组表达出现高峰,见图5。
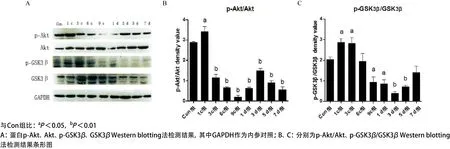
图5 不同组受压肌肉组织中总的Akt、GSK3β及其磷酸化的程度
3 讨论
3.1 探索难免性压疮损伤的细胞信号通路,可为临床预防和治疗提供干预靶点 压疮的发生及发展的细胞分子机制仍不明确,给临床预防和治疗压疮带来了很大的困难。因此,对压疮损伤的细胞信号通路进行研究,寻找治疗的分子靶点,可为临床防治压疮提供新思路、新方法。研究表明,细胞凋亡机制成为组织损伤和修复领域的研究热点之一,尤其在皮肤创伤与愈合,慢性溃疡形成与愈合的研究领域得到了大量的验证。研究发现,ERS诱发的凋亡是一种细胞凋亡新途径。本研究通过观察难免性压疮形成和修复过程中细胞凋亡因子caspase-3、GRP78、CHOP、caspase-12及其Akt、GSK-3β磷酸化程度,观察PI3K/Akt信号通路及其下游分子GSK3β在难免性压疮损伤中的表达变化,探讨细胞凋亡在难免性压疮形成过程中的潜在作用及其细胞发生凋亡的信号通路,以寻找干预压疮的分子靶点。
HE染色结果表明,随着受压周期的延长,由于缺血性损伤作用使受压肌肉组织出现逐步退化病理变化。具体表现为,受压肌肉组织炎症细胞增多,肌间隙增宽,肌纤维出现水肿、溶解、断裂、空泡化、玻璃样改变现象,在恢复组,由于缺血、低氧条件的改善,受压组织炎性细胞浸润程度逐渐减轻,但肌纤维恢复速度较慢,仍然存在肌纤维断裂、坏死片段等病理现象,与臧爽等[7]研究结果一致。
3.2 内质网分子伴侣蛋白在难免性压疮中的表达及作用 ERS介导的细胞存亡具有环境刺激依赖性,应激的强度和持续时间决定了细胞是否能够恢复和维持内质网的稳态。适宜的ERS可诱导GRPs、钙网蛋白(calreticulin,CRT)、蛋白质折叠酶等物质的表达上调,增强细胞耐受应激刺激能力[8],而持续严重的ERS则诱导CHOP、caspase-12等促凋亡因子的表达及活化,触发内质网凋亡信号途径,导致细胞凋亡和组织损伤[9]。
本研究实验组GRP78、CHOP、caspase-12的表达与前期研究结果[10-11]趋势一致,但其在恢复期变化情况却不清楚。本实验发现,免疫组织化学法检测caspase-3表达呈上升趋势,具体表现为9c组出现第一次高峰,恢复期1 d、3 d组出现持续高表达,随后出现下降趋势;恢复组GRP78、CHOP、caspase-12 表达整体上呈上升趋势,具体表现为1 d组GRP78表达显著,CHOP蛋白表达下降,笔者认为,可能与损伤后恢复期间,由于损伤后早期的再灌注损伤,产生大量的自由基,使机体处于氧化应激状态,从而诱导ERS持续存在,起细胞保护作用的GRP78高表达可以处理机体的错误折叠蛋白或未折叠蛋白,使ER内稳态恢复平衡;5 d组GRP78出现第二次峰值, 7 d组出现下降趋势,而CHOP蛋白在5 d组表达下降,7 d组表达出现第二次峰值,笔者认为可能与自由基的连锁反应使机体持续处于氧化应激状态,导致ER腔积聚过多的错误折叠蛋白,超过机体的处理能力,激活下游CHOP蛋白表达,处理过度受损的细胞,这与左群等[12]研究结果趋势一致;而恢复组caspase-12在1 d、3 d组持续高表达,之后出现下降趋势,前期出现持续高表达,可能与其特有的通路有关,后期出现下降趋势,这与免疫组织化学caspase-3的表达趋势一致。
3.3 PI3K/Akt/GSK3β信号通路对细胞的调节作用是否与难免性压疮损伤存在联系 近年来,越来越多的研究[3]报道,肌肉损伤恢复情况与肌细胞凋亡存在密切的关系,但具体的细胞凋亡信号通路仍不清楚。研究表明,PI3K/Akt、GSK-3β通路是调节细胞增殖、分化、凋亡和衰老的关键途径[4]。
Akt是一种丝氨酸/苏氨酸激酶,它是PI3K下游最重要的效应递质,能调节各种细胞内的信号通路。活化的Akt磷酸化后,进一步激活或抑制其下游的靶蛋白,进而发挥其调节细胞增殖、分化,葡萄糖代谢以及迁移等作用。当组织细胞遭受缺血-再灌注损伤时,活化的Akt还可以防止细胞凋亡,促进细胞的存活[13]。
GSK3β是Akt下游的一种活性激酶,主要是通过抑制其活性来调节其功能的。GSK3β不仅能调节糖代谢,而且在细胞增殖、生长及死亡中也发挥了重要作用。当组织面临缺血性损伤和再灌注损伤时,GSK3β活化会促进caspase-3的激活和细胞色素c的释放,促进细胞程序性死亡,加重损伤。
本研究Western blotting法检测发现,随着受压周期次数的延长,p-Akt蛋白表达呈逐渐下降的趋势,p-GSK3β蛋白表达呈先上升后下降的趋势,恢复组p-Akt蛋白表达呈上升趋势,p-GSK3β蛋白表达呈先下降后上升趋势。笔者推测,由于外面施加的机械性压力,激活了PI3/Akt信号通路,致使1c组,p-Akt表达出现第一次高峰,随着受压周期次数的增加,缺血再灌注损伤加重,抑制了Akt活性,使Akt磷酸化程度下降;9c组Akt磷酸化程度下降最为明显,细胞凋亡最为明显,与CHOP、caspase-12、caspase-3的表达成反比;Akt活性被抑制,从而抑制了GSK3β的ser9位点进行磷酸化,表现为p-GSK3β呈下降的趋势,促进了MPTP开放,促进细胞凋亡;恢复组由于解除了外部机械性压力和缺血性损伤的改善,逐渐恢复了Akt的活性,但仍然不能明显改善细胞凋亡的命运,这与Mozaffari等[14]的研究结果一致。
总之,难免性压疮之所以难以恢复可能与PI3K/Akt/GSK3β信号通路和内质网应激介导的细胞凋亡有关,这将为我们接下来的干预实验提供理论依据。

