气态甲基碘的溶解特性研究
周艳民,孙中宁,谷海峰,王军龙
(哈尔滨工程大学 核安全与仿真技术国防重点学科实验室,黑龙江 哈尔滨 150001)
在发生堆芯熔穿压力容器的严重事故时,熔融的堆芯与混凝土底板反应,产生大量不凝结气体,造成安全壳内压力持续升高,并威胁到安全壳的完整性。特别是福岛事故以后,事故后期的安全壳超压问题受到越来越多的关注,目前现役的大部分第二代和第二代改进型核电站正在逐渐增设安全壳过滤排放系统,以主动泄压的方式确保安全壳的完整性,并通过系统的水洗过滤器去除排放气体中携带的气溶胶、碘和甲基碘等放射性物质,相比碘和气溶胶,甲基碘在安全壳内的浓度较低,但由于其较强的挥发性和难以去除的特性在事故后处理中非常重要[1]
水洗过滤单元的核心部件为文丘里管,系统运行时,含有气态甲基碘的高温混合气体在文丘里管内部与水洗溶液充分接触,经物理传质和化学反应作用被水洗溶液吸收[2]。亨利定律是描述气体溶解饱和状态传质特性的重要规律,该定律中的关键参数为溶解度系数,其反映了饱和态时液相甲基碘浓度与气相分压之间的关系。文献[3]中关于甲烷、二氧化硫以及二氧化碳等常见气体溶解度特性的描述已较为完善,但关于甲基碘气体的相关参数说明尚处于空白状态。Adachi等[4]在1977年对甲基碘气体的溶解特性进行了部分研究,验证了常压条件下,温度为15~38 ℃范围内亨利定律对于甲基碘气体的适用性,并测量了几个参数点处的溶解度系数,但对于更高温度以及压力条件下甲基碘的溶解特性则无进一步的研究,这给定量描述高温或压力工况下文丘里管内甲基碘气体的吸收特性带来困难。
本文采用一动态的测量方法,对不同温度和压力条件下甲基碘气体的溶解特性进行研究,验证亨利定律在甲基碘溶解过程中的适用性,获得不同参数条件下的溶解度系数值及其随温度和压力的变化规律,旨为甲基碘气体的物理传质过程以及其他过程的理论计算提供可靠数据。
1 实验装置与实验方法
1.1 实验装置
甲基碘溶解特性研究实验装置(图1)主要由高压钢瓶、减压阀、流量计、不锈钢实验段以及温度控制装置组成。高压钢瓶内装有气态甲基碘和氮气的混合物,用作实验回路气态甲基碘的稳定气源。混合气体流经减压阀、流量计和针型阀进入实验段,混合气体进入实验段前的压力和流量通过减压阀和针型阀进行调节。实验段用内径85 mm、长度1 000 mm的不锈钢管制成,其内部盛装去离子水,水温可通过电加热器和温控器进行调节控制,控制精度为±1.0 ℃。实验段的进出口均设有气体采样点,用于样品气体的采集,出口采样点前装设有冷凝器,用于高温条件下采样前的蒸汽凝结。所采集样品气体中的甲基碘浓度用GC-2010气相色谱仪进行测量,检测器选用FID氢火焰离子检测器,检测限值为0.1 ppm;定量计算方法采用外标法,校准曲线采用浓度为2 ppm和10 ppm的标准气体来制定。

1——高压钢瓶;2,6——截止阀;3,7——减压阀;4——流量计;5——实验段;8——冷凝器;9——通风橱;10——入口测温点;11——溶液温度测点;12——出口测温点;13——入口取样阀;14——出口取样阀;15——出口取样针;16——入口取样针;17——气相色谱仪;18——数据采集系统;19——计算机;20——继电器;21——电加热器;22——压力表
1.2 实验方法与实验步骤
实验开始前,先配制一定浓度的甲基碘混合气体(浓度为50~600 ppm),在实验段内盛装液位高度为850 mm的去离子水,然后通过温度控制装置设定实验段内液体的升温限值,待温度稳定后,打开气瓶阀门,调节进出口减压阀、流量计和针型阀,使入口气体流量稳定在0.2 m3/h,并将实验段内的压力调节至所需值。从气体通入实验管段的时刻开始计时,并按一定时间间隔对实验段进出口甲基碘浓度进行取样测量,记录进出口浓度随时间的变化规律,直至出口甲基碘浓度恒定并与入口气体浓度一致时停止检测。
2 实验结果与分析
2.1 动态测量方法的检验
为检验动态测量方法的准确性,在常压、20 ℃条件下进行实验,并将实验结果与Adachi等的数据进行对比。

图2 出口甲基碘浓度随时间的变化
实验时入口甲基碘浓度保持不变,测得实验段出口混合气体中甲基碘浓度随时间的变化曲线如图2所示。从图2可看出,在实验初始阶段,出口载气中的甲基碘浓度较低,但随时间的延长,出口甲基碘浓度近似呈指数规律增长,这主要是因为在实验初始阶段,液相中的甲基碘浓度很低,气液界面上的甲基碘浓度梯度较大,使甲基碘能较快地从气相转移至液相[5];随着传质过程的进行,液相中甲基碘浓度不断增加,相应的气体传质速率逐渐减缓,出口甲基碘浓度逐渐变大,当液相中甲基碘浓度达到饱和值时,传质过程进入动态平衡状态,出口甲基碘浓度不再随时间变化并与入口甲基碘浓度保持一致。根据质量守恒定律,液相中溶解的甲基碘总量等于实验过程中进出口混合气体中所含甲基碘总量的差值,甲基碘浓度测量单位为质量浓度,则在气液接触时间范围内,液相中溶解的甲基碘总量为:
(1)
式中:n1为液相中溶解的甲基碘物质的量,mol;ρ为混合气体的密度,kg/m3;G为实验段入口混合气体的体积流量,m3/s;MC为甲基碘的摩尔质量,g/mol;C1和C2分别为进出口混合气体中甲基碘的浓度,ppm;t为气液接触时间,s。
当传质过程达到平衡状态时,液相中的甲基碘浓度为:
c(CH3I)=n1/V
(2)
式中:c(CH3I)为饱和状态时液相中的甲基碘浓度,mol/m3;V为实验段内去离子水体积,m3。
在与上述相同的实验条件下,通过改变实验段入口气体浓度,获得饱和状态时气液两相中的甲基碘浓度对应关系,如图3所示。由图3可知,在饱和状态下,气液两相中的甲基碘浓度表现为1条过原点的直线,表明此时液相中的甲基碘浓度与其周围载气中的甲基碘浓度呈正比,由于载气中的甲基碘浓度与其在载气中的气相分压呈正比,因此平衡状态时,液相中的甲基碘浓度与周围载气中的甲基碘气相分压也呈正比。表明在常压、20 ℃条件下,气态甲基碘在水中的物理溶解特性符合亨利定律,即:
c(CH3I)=HpI
(3)
式中:H为甲基碘气体的溶解度系数,mol/(Pa·m3);pI为混合气体中甲基碘的分压,Pa。

图3 常压、20 ℃下气液相甲基碘浓度的关系
根据载气中甲基碘气相分压与甲基碘浓度间的关系,式(3)可变形整理为:
(4)
式中:p0为饱和状态时混合气体的总压力,Pa;MN为氮气的摩尔质量,g/mol。
实验中测得入口甲基碘浓度C1=79.5 ppm,将图3所示的实验结果代入式(4),可计算得到常压、20 ℃条件下,气态甲基碘的溶解度系数H=1.116 mmol/(Pa·m3),该结果与Adachi等通过直接测量气相和液相浓度的方法所获得的数值相一致,表明采用上述动态方法测量饱和状态时溶液中的甲基碘浓度是可行的。
2.2 温度对甲基碘溶解特性的影响
采用上述动态测量方法,在常压条件下改变溶液温度,研究甲基碘气体在不同温度环境下的溶解特性规律。实验中溶液温度的变化区间为20~80 ℃,并以10 ℃作为升温间隔,获得不同温度条件下饱和状态时气液相中甲基碘浓度的关系,结果如图4所示。

图4 不同温度下饱和状态气液相中甲基碘浓度的关系
可看出,在不同温度环境下,饱和状态时气液两相中甲基碘浓度之间均表现为较好的线性关系,表明在常压、不同温度条件下,甲基碘气体在水中的物理溶解特性均满足亨利定律。将图4所示的实验数据代入式(4),计算不同温度条件下的甲基碘溶解度系数,获得其随温度的变化如图5所示。可看出,随温度的升高,甲基碘气体在水中的溶解度系数逐渐降低并近似呈指数规律递减,这与其他常见气体的溶解度特性是一致的[6]。
对图5中的实验数据进行拟合,得到甲基碘溶解度系数随温度变化的计算关系式如式(5)所示,可看出,图5中式(5)的计算结果与实验值之间符合较好,平均相对误差为7.4%。
H=0.001 96exp(-0.024 8T)-5.1×10-5
(5)
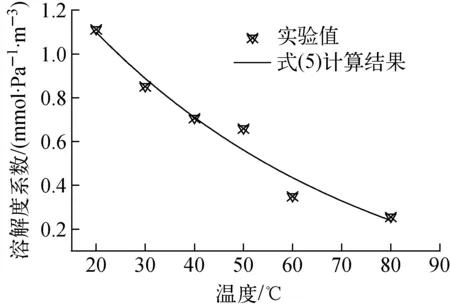
图5 溶解度系数随温度的变化
2.3 压力对甲基碘溶解特性的影响
进一步改变实验段内的压力,研究甲基碘气体在水中的溶解特性随压力的变化规律。实验分别在0.2 MPa和0.3 MPa两个压力点,对不同温度条件下的甲基碘气体溶解特性进行研究。为验证亨利定律在较高温度和压力下的适用性,首先对压力为0.3 MPa、温度为80 ℃的实验工况进行测量,实验中改变实验段入口气体浓度,获得饱和状态时气液相中甲基碘浓度的关系如图6所示。

图6 0.3 MPa、80 ℃下气液相甲基碘浓度的关系
可看出,饱和状态时气液相甲基碘浓度之间为1条过原点的直线,表明在较高压力和温度条件下,甲基碘气体在水中的溶解特性仍满足亨利定律。根据气体的溶解特性规律可推知,在该参数范围内甲基碘的溶解过程均满足亨利定律[7]。将不同压力和温度条件下的实验数据代入式(2)~(4),计算出不同参数下的甲基碘溶解度系数,并获得不同压力条件下溶解度系数随温度的变化关系,如图7所示。
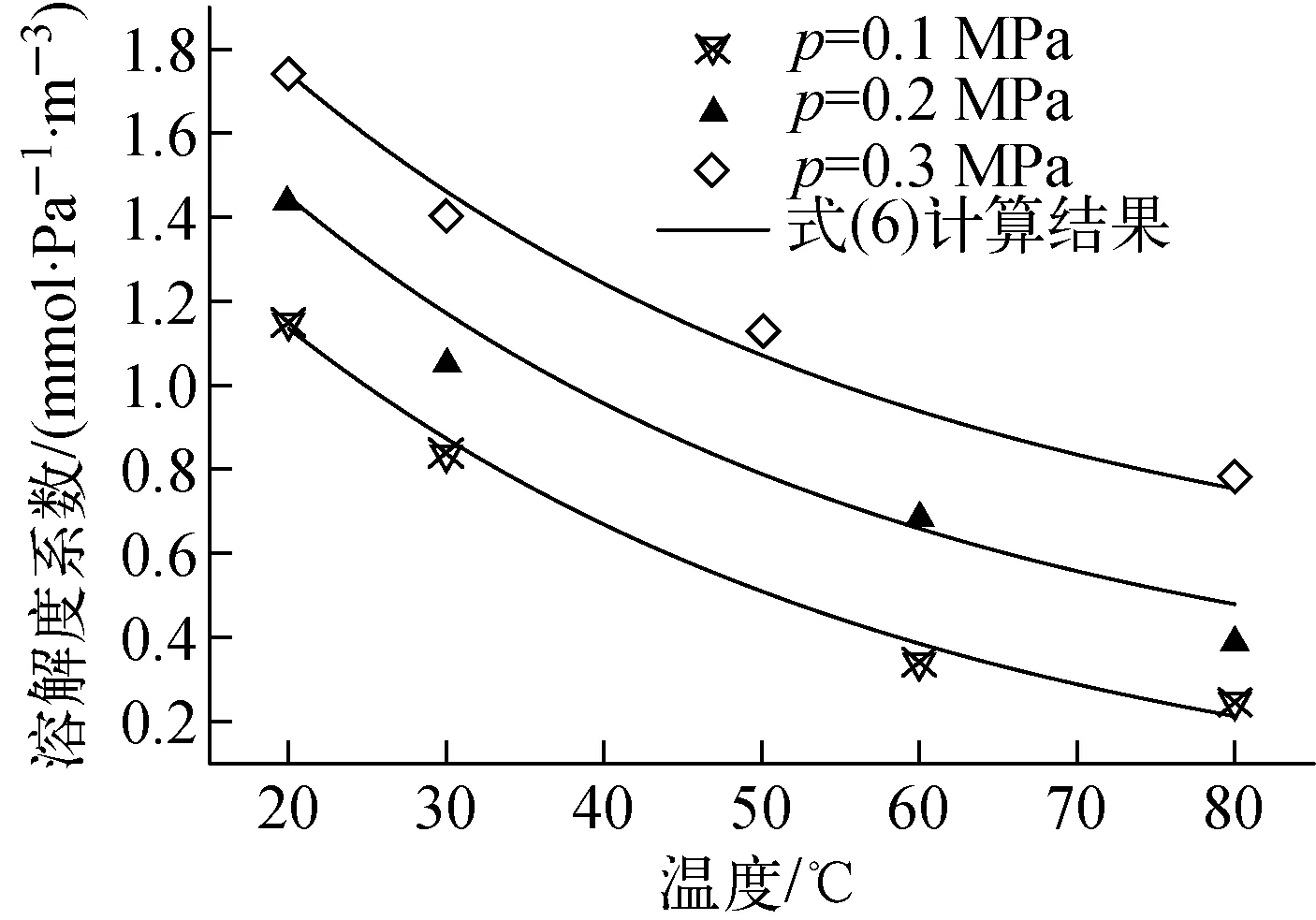
图7 压力对溶解度系数的影响
实验结果表明,在相同温度下,随着实验段内压力的提升,甲基碘气体在水中的溶解度系数明显变大;而同一压力下,溶解度系数随温度的变化关系与常压条件下的变化趋势基本相同,均表现为指数递减规律。进一步的对比分析发现,当压力从0.1 MPa至0.3 MPa按等差数列增加时,相同温度下的溶解度系数随压力也近似等差值增加。根据图7中数据的变化规律,拟合出甲基碘溶解度系数在不同压力和温度条件下的变化关系如下:
H=0.002exp(-0.025T)+
[2.6(10-5p-1)-0.5]×10-4
(6)
将式(6)的计算结果绘于图7中,并与实验值进行对比,可看出,两者之间的平均相对误差为8.1%。该式的适用范围是:压力不高于0.3 MPa,温度不高于80 ℃。
3 结论
1) 在实验参数范围内,甲基碘气体在水中的物理溶解特性满足亨利定律。
2) 不同压力条件下,甲基碘气体的溶解度系数随温度的升高均呈指数规律递减;在相同温度情况下,甲基碘气体的溶解度系数随压力的提升近似呈线性增加。
3) 在压力不高于0.3 MPa、温度不高于80 ℃时,甲基碘气体的溶解度系数可利用式(6)进行较准确的估算;当压力为常压、温度不高于80 ℃时,采用式(5)估算甲基碘气体的溶解度系数较采用式(6)具有更高的精度。
参考文献:
[1] KOLDITZ J. Reactor containment pressure relief and measures against hydrogen energy release in case of severe accidents[J]. Nuclear Engineering and Design, 1995, 157: 299-310.
[3] 汪镇安. 化学工艺设计手册[M]. 上海:化学工业出版社,2003.
[4] ADACHI M, EGUCHI W, HAOKA T. Dissolution of gaseous methyl iodide in aqueous sodium hydroxide solutions[J]. Journal of Nuclear Science and Technology, 1977, 14(5): 370-375.
[5] 成弘,周明,余国琮. 强化气液两相传质的研究进展[J]. 化学进展,2001,13(4):315-321.
CHENG Hong, ZHOU Ming, YU Guocong. Recent development of enhancement of gas-liquid mass transfer[J]. Progress in Chemistry, 2001, 13(4): 315-321(in Chinese).
[6] 武向红. 气体吸收剂的热力学评选方法及其用于CO2和乙烯体系的验证[D]. 北京:北京化工大学,2010.
[7] 李入林. 化工原理[M]. 长沙:国防科技大学出版社,2009.

