长链非编码RNA与糖尿病关系的研究进展*
韩泽平, 何金花, 黎毓光
(番禺区中心医院检验科,广东 广州 511400)
糖尿病是一种因体内胰岛素绝对或者相对不足所导致的一系列临床综合症,可分为4种类型:1型糖尿病、2型糖尿病、其它特殊类型糖尿病和妊娠期糖尿病。根据我国2010年全国糖尿病流行病学调查[1],20岁以上的成年人中有11 390万人患有糖尿病,患病率高达11.6%,前期人群达到50.1%,其中2型糖尿病占90%以上。全世界糖尿病人数正以每年6%的速度递增,估计到2025年,我国患糖尿病人数将达3亿之多[2],严重影响人类的生命健康和社会发展。因此,寻找糖尿病的病因及发病机制成为当今研究的热点。
随着基因组计划的完成,以及人们对糖尿病研究的不断深入,已有大量研究证明微小RNA (microRNA,miRNA)广泛参与糖尿病的发生与发展,然而关于长链非编码RNA(long non-coding RNA,lncRNA)与糖尿病关系的研究却处于接近空白状态。本文就lncRNA在糖尿病发生与发展过程中的研究作一综述。
1 LncRNA概述
LncRNAs是一类转录本长度超过200核苷酸单位(nt)的功能性RNA分子,它们位于细胞核或胞质内,缺乏编码蛋白质的能力,以RNA形式在表观遗传水平、转录水平及转录后水平等多种层面上调控基因的表达,广泛参与机体几乎所有的生理和病理过程,与临床上多种疾病关系密切[3]。虽然目前被发现的lncRNA数量逐渐增多,但对其在生命活动中的具体调控机制及功能模式仍不清楚。据报道,lncRNA在一些复杂疾病(如癌症、神经系统疾病和糖尿病等)的发生过程中异常表达,具有促使或抑制疾病发生的作用[4]。因此,研究lncRNA 对于认识生命体复杂而多层次的调控体系、提高人类预防和治疗疾病的能力以及探索生物进化规律等都具有积极的生物学意义。
1.1LncRNA的结构 目前,对lncRNA的来源存在多种说法,普遍认为:(1)染色质重组的结局;(2)编码蛋白质的基因结构发生中断而转变成lncRNA;(3)非编码基因复制过程中的反移位产物;(4)局部的串联复制子邻近产生;(5)基因组中插入1个转座成分而产生有功能的非编码RNA[5]。根据转录基因与邻近的蛋白编码基因的位置,可将lncRNA分为5种类型:(1)正义lncRNA:其转录方向与邻近蛋白编码基因转录方向相同;(2)反义lncRNA:其转录方向与邻近蛋白编码基因转录方向相反;(3)双向lncRNA:lncRNAs可同时从与邻近的蛋白编码基因转录相同、相反2个方向发生转录;(4)基因内lncRNA:lncRNAs从基因的内含子区转录得到;(5)基因间lncRNA:lncRNAs从2个基因的基因间转录得到[5]。与编码RNA相比,lncRNA的保守性较差,然而在其分子内部,却含有较为保守的序列,且其表达具有重要的生理生化功能。LncRNA像mRNA一样由RNA聚合酶Ⅱ生成,通过计算机分析发现lncRNA只有很少的起始密码子和阅读框,并且lncRNA在结构特点和序列组成方面和编码蛋白质RNA的3’非翻译区域(3’untranslated regions, 3’UTR)相似,其表达具有明显的组织和时空特异性[6]。
1.2LncRNA的作用机制 LncRNA可通过各种分子机制在X染色体失活、基因印迹、染色体修饰、转录、翻译、蛋白质的活性调控以及RNA的可变剪切调控等过程中发挥着重要的调节作用。目前,lncRNA参与各种疾病的作用机制尚未明确,总结近年研究,lncRNA在分子水平上的功能主要有以下几个方面[7],如图1所示:(1)通过在蛋白编码基因上游启动子区(橙色)发生转录,干扰下游基因(蓝色)的表达;(2)通过抑制RNA聚合酶Ⅱ或者介导染色质重构以及组蛋白修饰,影响下游基因(蓝色)表达;(3)通过与蛋白编码基因的转录本形成互补双链(紫色),进而干扰mRNA剪切,从而产生不同的剪切形式;(4)通过与蛋白编码基因的转录本形成互补双链(紫色),进一步在Dicer酶作用下产生内源性siRNA,调控基因的表达水平;(5)通过结合到特定蛋白质上,lncRNA转录本(绿色)能够调节相应蛋白的活性;(6)作为结构组分与蛋白质形成核酸蛋白质复合体;(7)通过结合到特定蛋白上,改变该蛋白的胞质定位;(8)可加工产生小分子RNA(红色),作为小分子RNA如miRNA、Piwi蛋白相作用RNA(Piwi-interacting RNA, piRNA)和肺腺癌转移相关转录本1相关胞浆小RNA(MALAT1-associated small cytoplasmic RNA, mascRNA)的前体分子转录。
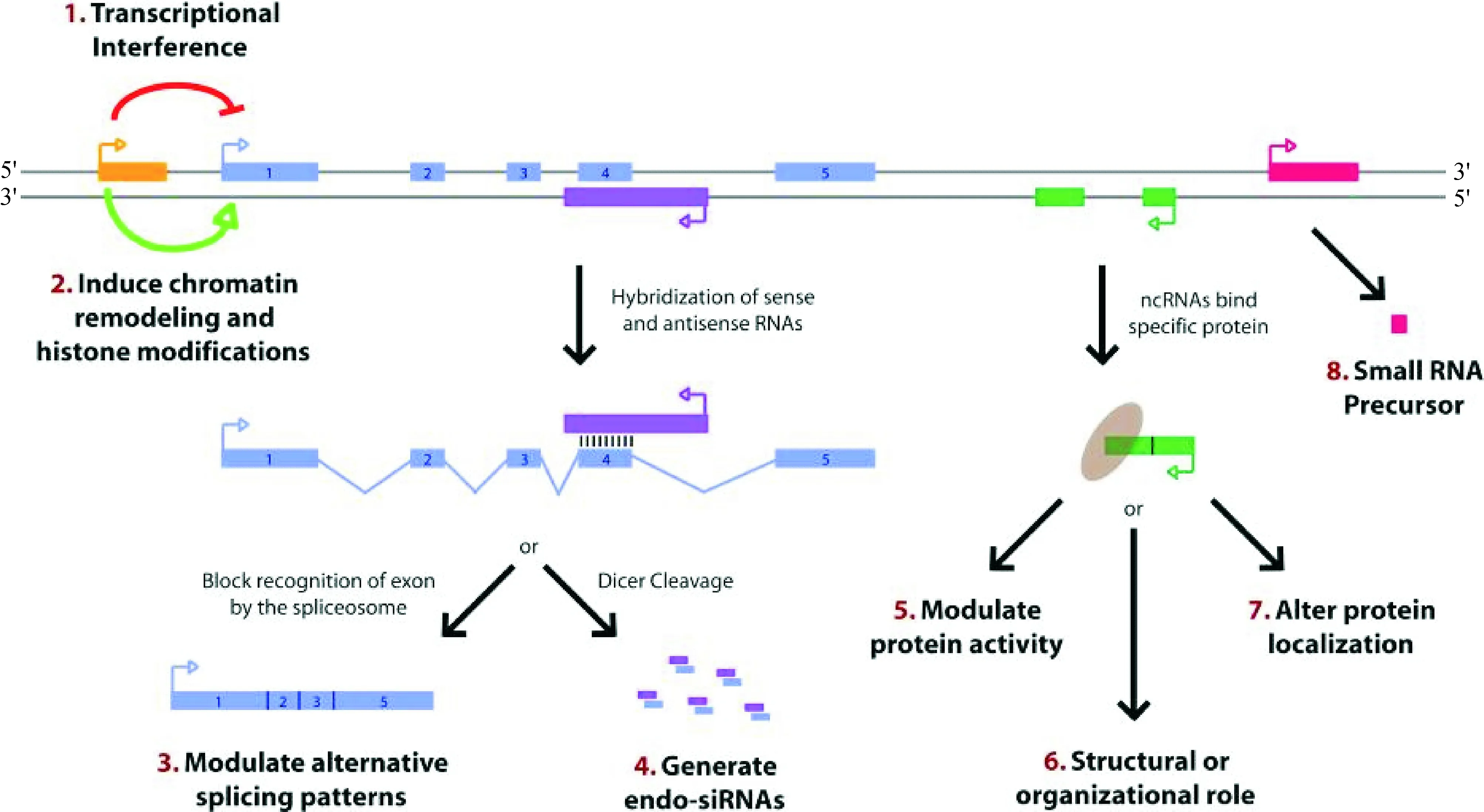
Figure 1. Mechanisms of the effects of lncRNA [Genes Dev, 2009, 23(13): 1494-1504].
1.3LncRNA的组织特异性 有研究证明,78%的lncRNA具有组织特异性,本特征对其在疾病发生中的作用有很重要影响[8]。在疾病的发生和发展中,不同组织之间的lncRNA表达量不同,肺腺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)和肝癌高表达转录本(highly up-regulated in liver cancer,HULC)在正常肝细胞中含量极低,肝癌发生时表达明显上升[9-10]。研究发现,在人体正常组织中,除了前列腺组织可低表达前列腺癌抗原3(prostate cancer antigen 3,PCA3)外,其它组织中均未发现其表达,然而它在前列腺癌组织中却呈高特异性表达状态[11]。因此,PCA3基因的表达具有很高的组织特异性和癌特异性,被认为是目前前列腺癌最特异的基因[12]。Morán等[13]重新排列16例人类非胰岛RNA序列数据集,发现9.4%的参考序列(reference sequence, RefSeq)数据库有注释的基因为胰岛所特有。小岛lncRNAs通常定位于胰岛特异的核染色质区域和编码基因的附近,其中55%的基因间lncRNAs和40%反义胰岛lncRNAs具有胰岛特异性,推测人类的胰岛细胞lncRNA是以高度组织特异模式转录的。
2 LncRNA与糖尿病的关系
失调的lncRNA可通过多种途径在疾病的发生和发展中发挥重要作用。目前,相关研究发现lncRNA细胞周期激酶抑制因子4(INK4)位点的反义编码RNA(antisense non-coding RNA in the INK4 locus, ANRIL)、葡萄胎相关印迹基因(hydatidiform mole associated and imprinted, HYMAI)、胰岛素样生长因子2反义RNA(insulin-like growth factor 2 antisense RNA, IGF-2AS)、母系表达基因3(maternally expressed gene,MEG3)、浆细胞瘤变体易位基因1(plasmacytoma variant translocation 1 gene,PVT1)和HI-LNC25与糖尿病密切相关,这些lncRNAs通过表达的异常、甲基化和基因多态性等多种途径广泛参与糖尿病的发生与发展,见表1。
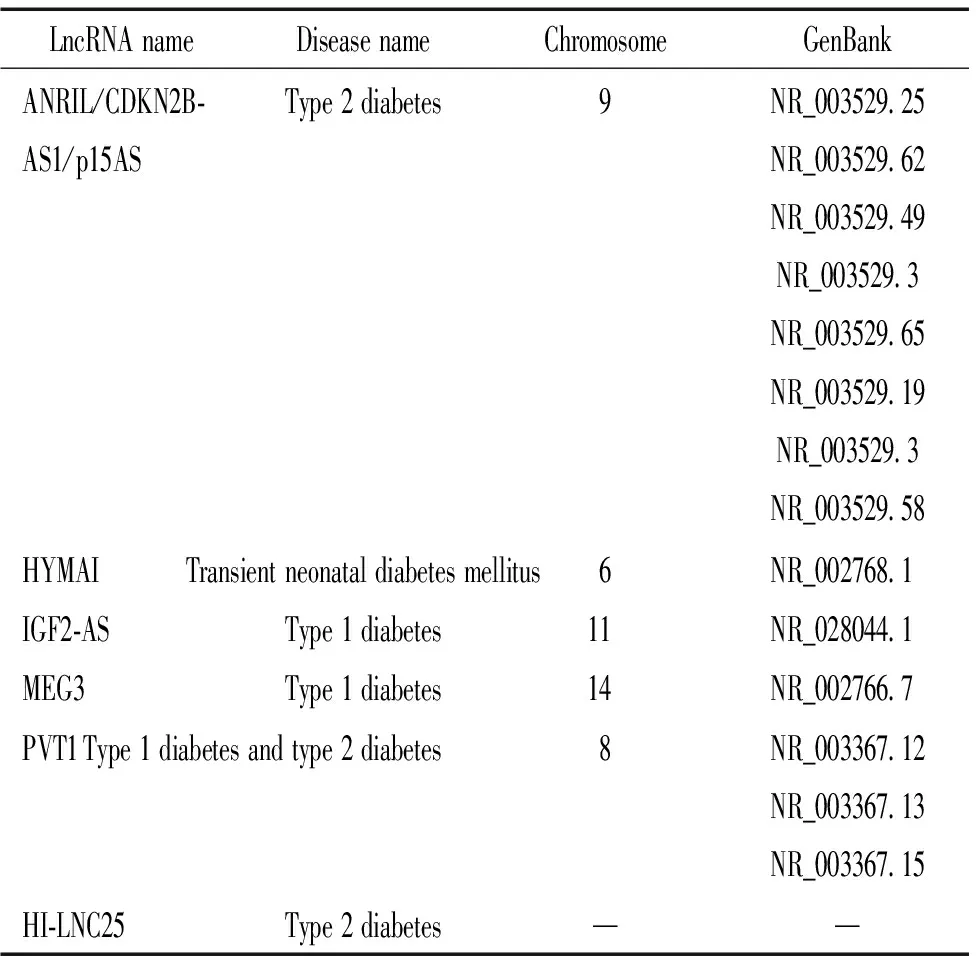
表1 与糖尿病相关的lncRNA
2.1ANRIL ANRIL又称细胞周期依赖激酶抑制剂2B 反义RNA(cyclin-dependent kinase inhibitor 2B antisense RNA,CDKN2BAS)或p15反义RNA (p15 antisense RNA,p15AS)。体外过表达ANRIL可在表观遗传学水平引起p15基因表达沉默。ANRIL的异常表达和单核苷酸多态性与包括糖尿病在内的一些疾病有关。胰岛素依赖性蛋白激酶抑制因子2B(CDKN2B或p15)基因位于9号染色体9q21,编码表达于胰岛细胞中的p15细胞周期激酶抑制因子4b蛋白(p15INK4b)。ANRIL转录物与p15INK4b有很好的相关性,尤其在全血中,ANRIL能够直接影响p15INK4b的表达[14]。p15INK4b是一种周期依赖性激酶抑制剂,通过抑制细胞周期蛋白依赖性激酶4(cyclin-dependent kinase 4,CDK4)阻碍细胞G1进入S期的进程。动物模型研究显示p15INK4b的过表达可引起小鼠胰岛发育不全并出现糖尿病症状[15]。由于ANRIL是CDKN2B的反义RNA,我们猜测ANRIL通过抑制CDKN2B的表达,从而引起p15INK4b低表达而导致糖尿病,但此推理与上述研究不符,可能是因为上述研究是基于表观遗传学上的,而ANRIL与糖尿病的关系可能更复杂,推测与其多态性有关。研究发现,糖尿病风险单核苷酸多态性与ANRIL的等位基因密切相关,CDKN2B基因上游约125 kb的基因组非编码区存在多个2型糖尿病的风险位点[16]。Cunnington等[17]报道,下调ANRIL的表达可导致糖尿病在内的多种人类疾病的发生,证实糖尿病相关风险变体(rs10811661-T和rs2383208-A)与ANRIL表达量的下降相关。另外,他们还发现在基因多态性上,ANRIL与CDKN2B的表达相反,这证明了ANRIL的反义转录物能调控抑制CDKN2B的表达。Zeggini等[18]分析对比糖尿病病人与正常人群的基因,发现糖尿病的易感基因在CDK5调节亚基蛋白1样蛋白1(CDK5 regulatory subunit associated protein 1-like protein 1,CDKAL1)、胰岛素样生长因子2 mRNA结合蛋白2(insulin-like growth factor 2 mRNA binding protein 2,IGF2BP2)和CDKN2A/CDKN2B这3个基因的内部和周围,并认为ANRIL与2型糖尿病确实存在联系,但具体的致病机制尚未明确。
2.2HYMAI 与大多数lncRNAs一样,HYMAI编码非蛋白转录物,但只表达于父源等位基因中,且在两个父母等位基因的相邻CpG岛中显示特异性DNA甲基化[19]。目前其相关功能尚不明确,最近报道认为HYMAI与新生儿糖尿病(neonatal diabetes mellitus, NDM)相关。NDM是出生后6个月内发生的糖尿病,是一种较少见的特殊类型糖尿病,根据临床特点及转归不同,可分为新生儿暂时性糖尿病(transient neonatal diabetes mellitus, TNDM)和新生儿永久性糖尿病(permanent neonatal diabetes mellitus, PNDM)2种类型[20]。遗传学研究表明,TNDM大多与父源性6号染色体上的基因复制和转录过程中发生突变有关,提示6q24有与TNDM密切相关的印迹基因,由于其配子来源不同具有异于其等位基因的表达。研究发现,位于6q24的2个重叠印迹基因锌指蛋白(zinc finger protein which regulates apoptosis and cell cycle arrest,ZAC)和HYMAI的母源性甲基化缺陷与TNDM相关[21]。ZAC是父源印迹基因,广泛编码锌指蛋白,促进细胞凋亡和细胞更新。ZAC过表达可导致TNDM,Du等[22]通过体外过表达ZAC基因,证实了ZAC是β细胞对血糖调节的负性基因,它可通过增加钙离子浓度介导血糖刺激胰岛素分泌功能受损,致使胰岛素的迟发分泌。另外,ZAC也可调节垂体腺苷酸环化酶活化多肽(pituitary adenylate cyclase-activating polypeptide, PACAP)受体1的表达[23]。PACAP是一种非常有效的胰岛素促分泌素,可作用于胰腺PACAP受体1。ZAC的过表达有可能以某种未知的方式改变正常胰岛细胞对PACAP的反应而导致血糖的异常。由于ZAC和HYMAI基因部分重叠,并共用一个母源甲基化CpG岛[24],我们猜测HYMAI导致TNDM的发病机制可能与ZAC相似。人类ZAC/HYMAI位于6q24-q25,TNDM与该区父源复制及ZAC/HYMAICpG岛异常甲基化有关。Gardner等[25]指出ZAC和HYMAI异常表达的TNDM患者都患有甲基化缺陷,他们发现TNDM患者皮肤纤维原细胞的ZAC和HYMAI单等位基因表达松弛。这一现象提示这2个未甲基化等位基因的存在与毗邻基因不适当表达有关。Ma等[24]通过建立动物模型实验发现,人类ZAC和HYMAI都是经由父源传递,在胰腺B细胞和视丘下部等位置表达,具有调节葡萄糖动态平衡的潜在功能。特别是在父源传递基础上遗传得到高拷贝数的转基因引起了血糖和尿糖的增加。但这些遗传学异常与胰岛素分泌细胞功能异常之间的确切联系还需进一步阐明。
2.3IGF-2ASIGF-2AS表达于父源等位基因,广泛存在于各种组织中,是一个IGF-2的反义印迹基因。IGF-2AS由3个外显子组成,其中包含胰岛素样生长因子2(insulin-like growth factor 2,IGF-2)基因的折叠外显子4和3(IGF-2基因共有9个外显子),因此其与IGF-2基因共享某些基因组区域[26]。人类IGF-2AS缺乏一个中心重复序列,但存在一个独特的转录起始位点[27]。据报道,IGF-2和IGF-2AS可作为多种重要疾病的候选基因,包括癌症、肥胖、高血压、冠心病和糖尿病等[27-28]。目前,人们对IGF-2AS的研究多在肿瘤学方面,而对在糖尿病方面的研究甚少。Mutskov 等[28]报道,用高浓度葡萄糖刺激胰岛β细胞,可使IGF-2AS表达量上调,证实了血糖的浓度是影响IGF-2AS基因表达的主要调节因素,但具体机制尚未明确。
2.4MEG3MEG3是一种印迹基因,位于14号染色体14q32区域,只在母源等位基因上表达,受到印迹控制区(imprinting control regions,ICRs)的严格调控。ICRs的基因或表观基因学的改变都会导致正常表达的等位基因的表达沉默,或者激活正常沉默的等位基因,这种现象称为印迹丢失(loss of imprinting, LOI),LOI被认为和人类许多疾病有关。MEG3广泛表达于多种组织中,且在垂体、脑组织、胎盘、肾上腺、卵巢和胰腺中高表达,提示它可能和神经内分泌功能相关[29]。据报道,MEG3在多种肿瘤性疾病中表达水平降低或缺失,异位表达MEG3可抑制不同种类的人类癌细胞系的生长[30],推测MEG3的功能失活与肿瘤的发展相关。然而,目前对MEG3的功能尚不完全清楚,特别是对其在糖尿病中发挥的作用还知之甚少。研究发现,与1型糖尿病相关性最强的敏感位点位于14号染色体14q32.28的一个完整印迹区域,标记为SNP rs941576。SNP rs941576恰恰定位在母系表达的非编码RNA MEG3的第6内含子内[31],提示了MEG3与糖尿病相关。Wallace等[31]建立动物模型实验,在小鼠的差异甲基化区域的下游插入一个转基因,引起了父源染色体上的印迹丢失,小鼠的等位基因MEG3、基因捕获位点2(gene trap locus 2,GTL2)的表达和跨膜蛋白delta-like 1(delta-like 1 homolog,DLK1)的表达量下降,他们认为MEG3这个母系表达SNP可以调节父源性表达的DLK1和逆转录转座子样1(retrotransposon-like 1,RTL1)基因的表达,从而导致1型糖尿病的发生与发展。Zhao等[32]在用去甲基化的药物对这些肿瘤进行治疗后,发现这些细胞中出现了MEG3的表达,说明在MEG3基因功能调节区域的DNA甲基化和MEG3在肿瘤中表达丢失密切相关。已证实,DLK1/MEG3的ICR是基因间差异甲基化区域,即在父源性的相应染色体片段上是被甲基化的[33]。由此,我们推测,MEG3的甲基化可能是1型糖尿病的发病机制之一。阅读相关文献,我们发现与良性人肝细胞相比,在肝癌细胞株中的lncRNAMEG3表达显著下调,并认为这是miR-29a调控MEG3启动子产生超甲基化所引起的[34]。另有研究构建大鼠2型糖尿病模型,发现了miR-29a在3种胰岛素作用组织(肌肉、脂肪、肝组织)中均呈上调状态,高水平的miR-29a导致细胞对胰岛素失敏,和高血糖、高胰岛素引起的胰岛素失敏相仿,证明了miR-29a在胰岛素信号转导途径中起调控作用,miR-29a可作为糖尿病的生物标志物[35]。鉴于上述研究,我们推测,miR-29a可能通过某种调控通路参与lncRNA MEG3的甲基化,从而导致糖尿病的发生与发展。
2.5PVT1 糖尿病肾病(diabetic nephropathy,DN)是在发展中国家引起慢性肾衰竭和导致患糖尿病者预期寿命缩短最常见的原因。近年发现PVT1基因与DN密切相关。PVT1位于人类8号染色体8q24区域,由58个腺嘌呤、116个胞嘧啶、131个鸟嘌呤和55个胸腺嘧啶组成,其表达可促进细胞增殖和抑制细胞凋亡[36]。PVT1在肾脏多种细胞中均呈高表达状态。Hanson等[37]报道O’odham奥哈姆人群中2型糖尿病的全基因组关联分析,研究采用Affymetrix 100K芯片,在105例2型糖尿病患者和102例对照者中,发现位于PVT1内含子8中的rs2648875与DN显著相关,并认为PVT1能提高糖尿病患者罹患终末期肾病(end-stage renal disease,ESRD)的机率。Millis等[38]分析531例终末期肾病印第安人和564例患有糖尿病大于20年且尿蛋白肌酐排泄率小于150 mg/g的印第安人的24个PVT1基因分型,经年龄、患糖尿病时间、吸烟等因素调整后,结果显示DN与1型糖尿病关系密切,其中PVT1 rs13447075和rs2648862与DN所致的ESRD最为相关。Alvarez等[39]发现PVT1可能有助于降低肾脏过滤血液的能力,从而导致肾脏疾病、肾功能衰竭和死亡。在高血糖的状态下,PVT1的表达水平可增高至原来的5倍。他们通过RNA干扰技术敲除肾小球系膜细胞的PVT1基因,并分别运用qPCR和ELISA技术分析纤连蛋白1(fibronectin 1,FN1)、Ⅳ型胶原蛋白α1 (collagen,type Ⅳ,alpha 1,COL4A1)、转化生长因子β1(transforming growth factor beta 1,TGF-β1)和纤溶酶原激活物抑制剂1(plasminogen activator inhibitor-1,PAI-1)的mRNA和蛋白水平。结果显示,对人系膜细胞进行高糖实验,使得PVT1的表达显著上调,与其同时FN1、COL4A1、TGF-β1和PAI-1的水平也上升;最重要的是,PVT1的敲除能显著地降低各种细胞外基质(extracellular matrix,ECM)成分的mRNA和蛋白水平,而ECM在系膜细胞内的过度堆积是糖尿病肾病的标志。与TGF-β1对比,PVT1导致FN1、COL4A1和PAI-1的分泌水平下降更加明显,其作用方式至少部分独立于TGF-β1,表明了PVT1通过ECM的堆积而引起糖尿病肾病的发生和发展。
2.6HI-LNC25 HI-LNC25是一个长约1.6Mb多功能外显子转录物,缺乏蛋白质编码能力但包含胰岛特异性活性染色质簇,研究显示HI-LNC25具有高度的组织特异性。Morán等[13]建立实验模型,基于葡萄糖诱导人β细胞株分泌胰岛素的原理,将表达2种独立的shRNA的慢病毒载体转导入人β细胞中,从而抑制HI-LNC25的表达,同时检测24组胰岛mRNA的表达量。结果显示,GLIS家族锌指3(GLIS family zinc finger 3, GLIS3) mRNA为HI-LNC25的潜在靶向调控基因。GLIS3编码一种胰岛转录因子,它的突变发生在包括2型糖尿病风险变异位点在内的单基因糖尿病中。虽然降低HI-LNC25的表达没有显著地引起β细胞的葡萄糖诱导胰岛素分泌,但与另外5组对照shRNA相比,GLIS3 mRNA的表达均被下调,而对照组基因表达量没有明显变化,提示了反义lncRNA能调控人类胰岛β细胞单基因疾病的蛋白编码基因。
3 问题与展望
LncRNA的发现使得大量遗传信息被认知,至2013年10月10日,已发现197种功能性lncRNAs (http://lncrnadb.com)。但迄今所鉴定的功能性lncRNAs与依据生物信息学手段所推测的数目相比仅仅是冰山一角。LncRNA能够调节与之相关的蛋白编码基因,它们的表达不当可能导致疾病的发生,这一发现开拓了对病因学上lncRNA作用机制研究的新领域。综合上述研究,我们发现,lncRNA可能通过表达的上调或抑制、甲基化、基因多态性等多种途径参与糖尿病的发生与发展,而在此过程中一个lncRNA可能同时经过多种途径起作用,也可能是多个lncRNAs共同作用的结果,总之,lncRNA参与糖尿病发病的机制相当复杂,还有待进一步阐明。目前,对lncRNA的研究仅仅处于起步阶段,关于lncRNA与糖尿病相关联的证据并不多,要想使lncRNA成为一种诊断标志,需要进一步确定lncRNA在正常人中的表达水平,以及具有临床诊断意义的变化程度。通过对lncRNA在疾病中作用机制的研究,可以利用基因敲除、RNA干扰、基因增补、基因灭活等基因手段切断lncRNAs的致病途径,为糖尿病提供一种新的治疗方法。
[参 考 文 献]
[1] Xu Y, Wang L, He Y, et al. Prevalence and control of diabetes in Chinese adults [J]. JAMA, 2013, 310(9):948-959.
[2] Zimmet P, Alberti KG, Shaw J. Global and societal implications of the diabetes epidemic[J]. Nature, 2001, 414(6865): 782-787.
[3] Ørom UA, Derrien T, Beringer M, et al. Long noncoding RNAs with enhancer-like function in human cells[J]. Cell, 2010, 143(1):46-58.
[4] Gibb EA, Brown CJ, Lam WL. The functional role of long non-coding RNA in human carcinomas[J]. Mol Cancer, 2011, 10(1):38-55.
[5] Ponting CP, Oliver PL, Reik W. Evolution and functions of long noncoding RNAs[J]. Cell, 2009, 136(4):629-641.
[6] Niazi F, Valadkhan S. Computational analysis of functional long noncoding RNAs reveals lack of peptide-coding capacity and parallels with 3′ UTRs[J]. RNA, 2012, 18(4):825-843.
[7] Wilusz JE, Sunwoo H, Spector DL. Long noncoding RNAs: functional surprises from the RNA world[J]. Genes Dev, 2009, 23(13):1494-1504.
[8] Cabili MN, Trapnell C, Goff L, et al. Integrative annotation of human large intergenic noncoding RNAs reveals global properties and specific subclasses[J]. Genes Dev, 2011, 25(18):1915-1927.
[9] Lin R, Maeda S, Liu C, et al. A large noncoding RNA is a marker for murine hepatocellular carcinomas and a spectrum of human carcinomas[J]. Oncogene, 2006, 26(6):851-858.
[10] Matouk IJ, Abbasi I, Hochberg A, et al. Highly upregulated in liver cancer noncoding RNA is overexpressed in hepatic colorectal metastasis[J]. Eur J Gastroenterol He-patol, 2009, 21(6):688-692.
[11] Hessels D, Schalken JA. The use ofPCA3 in the diagnosis of prostate cancer[J]. Nat Rev Urol, 2009, 6(5):255-261.
[12] Tao Z, Shen M, Zheng Y, et al. PCA3 gene expression in prostate cancer tissue in a Chinese population: quantification by real-time FQ-RT-PCR based on exon 3 of PCA3[J]. Exp Mol Pathol, 2010, 89(1):58-62.
[13] Morán I, Akerman I, van de Bunt M, et al. Human β cell transcriptome analysis uncovers lncRNAs that are tissue-specific, dynamically regulated, and abnormally expressed in type 2 diabetes[J]. Cell Metab, 2012, 16(4): 435-448.
[14] Jarinova O, Stewart AF, Roberts R, et al. Functional analysis of the chromosome 9p21.3 coronary artery disease risk locus[J]. Arterioscler Thromb Vasc Biol, 2009, 29(10):1671-1677.
[15] Moritani M, Yamasaki S, Kagami M, et al. Hypoplasia of endocrine and exocrine pancreas in homozygous transgenic TGF-β1[J]. Mol Cell Endocrinol, 2005, 229(1-2):175-184.
[16] Steinthorsdottir V, Thorleifsson G, Reynisdottir I, et al. A variant inCDKAL1 influences insulin response and risk of type 2 diabetes[J]. Nat Genet, 2007, 39(6): 770-775.
[17] Cunnington MS, Koref MS, Mayosi BM, et al. Chromosome 9p21 SNPs associated with multiple disease phenotypes correlate with ANRIL expression[J]. PLoS Genet, 2010, 6(4): e1000899.
[18] Zeggini E, Weedon MN, Lindgren CM, et al. Replication of genome-wide association signals in UK samples reveals risk loci for type 2 diabetes[J]. Science, 2007, 316(5829):1336-1341.
[19] Iglesias-Platas I, Martin-Trujillo A, Cirillo D, et al. Characterization of novel paternal ncRNAs at the plagl1 locus, including hymai, predicted to interact with regulators of active chromatin[J]. PLoS One, 2012, 7(6):e38907.
[20] Greeley SA, Tucker SE, Worrell HI, et al. Update in neonatal diabetes[J]. Cur Opin Endocrinol Diabetes Obes, 2010, 17(1):13-19.
[21] Sperling MA. Neonatal diabetes mellitus: from understudy to center stage[J]. Cur Opin Pediatr, 2005, 17(4):512-518.
[22] Du X, Ounissi-Benkalha H, Loder MK, et al. Overexpression of ZAC impairs glucose-stimulated insulin translation and secretion in clonal pancreatic beta-cells[J]. Diabetes Metab Res Rev, 2012, 28(8):645-653.
[23] Temple IK, Shield JP. Transient neonatal diabetes, a disorder of imprinting[J]. J Med Genet, 2002, 39(12):872-875.
[24] Ma D, Shield JP, Dean W, et al. Impaired glucose homeostasis in transgenic mice expressing the human transient neonatal diabetes mellitus locus, TNDM[J]. J Clin Invest, 2004, 114(3):339-348.
[25] Gardner RJ, Mackay DJ, Mungall AJ, et al. An imprinted locus associated with transient neonatal diabetes mellitus[J]. Hum Mol Genet, 2000, 9(4):589-596.
[26] Vu TH, Chuyen NV, Li T, et al. Loss of imprinting ofIGF2 sense and antisense transcripts in Wilms’ tumor[J]. Cancer Res, 2003, 63(8):1900-1905.
[27] Okutsu T, Kuroiwa Y, Kagitani F, et al. Expression and imprinting status of humanPEG8/IGF2AS, a paternally expressed antisense transcript from theIGF2 locus, in Wilms’ tumors[J]. J Biochem, 2000, 127(3): 475-483.
[28] Mutskov V, Felsenfeld G. The human insulin gene is part of a large open chromatin domain specific for human islets[J]. Proc Natl Acad Sci U S A, 2009, 106(41):17419-17424.
[29] Zhang X, Zhou Y, Mehta KR, et al. A pituitary-derivedMEG3 isoform functions as a growth suppressor in tumor cells[J]. J Clin Endocrinol Metab, 2003, 88(11): 5119-5126.
[30] Zhou Y, Zhang X, Klibanski A.MEG3 noncoding RNA: a tumor suppressor[J]. J Mol Endocrinol, 2012, 48(3):R45-R53.
[31] Wallace C, Smyth DJ, Maisuria-Armer M, et al. The imprintedDLK1-MEG3 gene region on chromosome 14q32.2 alters susceptibility to type 1 diabetes[J]. Nat Genet, 2010, 42(1):68-71.
[32] Zhao J, Dahle D, Zhou Y, et al. Hypermethylation of the promoter region is associated with the loss ofMEG3 gene expression in human pituitary tumors[J]. J Clin Endocrinol Metab, 2005, 90(4):2179-2186.
[33] Lin SP, Youngson N, Takada S, et a1. Asymmetric regulation of imprinting on the maternal and paternal chromosomes at theDlkl-Gtl2 imprinted cluster on mouse chromosome 12[J]. Nat Genet, 2003, 35(1):97-102.
[34] Braconi C, Kogure T, Valeri N, et al. microRNA-29 can regulate expression of the long non-coding RNA geneMEG3 in hepatocellular cancer[J]. Oncogene, 2011, 30(47):4750-4756.
[35] Bagge A, Clausen TR, Larsen S, et al. MicroRNA-29a is up-regulated in beta-cells by glucose and decreases glucose-stimulated insulin secretion[J]. Biochem Biophys Res Commun, 2012, 426(2):266-272.
[36] Guan Y, Kuo WL, Stilwell JL, et al. Amplification ofPVT1 contributes to the pathophysiology of ovarian and breast cancer[J]. Clin Cancer Res, 2007, 13(19): 5745-5755.
[37] Hanson RL, Craig DW, Millis MP, et al. Identification ofPVT1 as a candidate gene for end-stage renal disease in type 2 diabetes using a pooling-based genome-wide single nucleotide polymorphism association study[J]. Diabetes, 2007, 56(4):975-983.
[38] Millis MP, Bowen D, Kingsley C, et al. Variants in the plasmacytoma variant translocation gene (PVT1) are associated with end-stage renal disease attributed to type 1 diabetes[J]. Diabetes, 2007, 56(12):3027-3032.
[39] Alvarez ML, DiStefano JK. Functional characterization of the plasmacytoma variant translocation 1 gene (PVT1) in diabetic nephropathy[J]. PLoS One, 2011, 6(4):e18671.

