α7nAChR参与生理浓度糖皮质激素的抗炎作用*
陈依雨, 吕俊华, 张 梅
(1广州医科大学药学院药理教研室,广州 广东 510082; 2暨南大学药学院药理教研室,广州 广东510630)
糖皮质激素(glucocorticoids, GCs)是肾上腺皮质分泌的具有广泛生理效应的固醇类激素。以往认为生理水平的GCs主要参与调节物质代谢,超生理剂量的GCs才具有抗炎、抑制免疫反应等多种药理作用。但近年研究发现生理水平的GCs 同样具有抗炎作用,其抗炎作用是通过GCs-糖皮质激素受体(glucocorticoid receptors, GRs)途径增强核组蛋白脱乙酰酶的活性,从而抑制核因子κB(nuclear factor-κB, NF-κB)和激活蛋白1 (activator protein-1,AP-1) 的转录来实现,这一发现扩充了体液抗炎机制的内涵[1-3]。2002年Tracey等[4]发现了一种新的炎症反应调节机制——胆碱能神经抗炎通路(cholinergic anti-inflammatory pathway, CAP),介导这一通路的是迷走神经,其通过递质乙酰胆碱作用于免疫细胞,抑制炎症因子释放起到抗炎作用。随后研究发现α7烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor, α7nAChR)处于胆碱能抗炎通路的核心,是调控炎症反应的关键分子[5]。作为机体内2个重要的内源性抗炎系统,生理浓度GCs与胆碱能神经抗炎通路在面对炎症挑战时是否存在交叉对话(crosstalk),两者之间关系如何,本研究拟对此进行探讨。
材 料 和 方 法
1 主要试剂
DMEM培养基购自Gibco-BRL;新生牛血清购自杭州四季青生物工程有限公司;胰蛋白酶、HEPES、DMSO、MTT、氢化可的松、甲基牛扁亭碱(methyllycaconitine,MLA)和脂多糖(lipopolysaccharides,LPS) 均购自Sigma。Mouse IL-1 beta ELISA Ready-SET-Go!试剂盒和Mouse TNF-alpha ELISA Ready-SET-Go!试剂盒为eBioscience产品。
2 方法
2.1细胞培养 小胶质细胞BV-2由中国协和医科大学细胞中心提供。于37 ℃、5% CO2的条件下,用含10%新生牛血清的DMEM培养基进行培养,选取对数生长期的细胞进行实验。
2.2药物处理和实验分组 实验分为对照组和实验各组。LPS的最适作用浓度和时间由其诱导产生炎症因子的量效曲线和量时曲线获得,实验中使用0.1 mg/L LPS刺激BV-2细胞6 h用于诱导TNF-α的产生,使用1 mg/L LPS刺激BV-2细胞24 h用于诱导IL-1β的产生。根据BV-2细胞活性测定和GCs抗炎实验,选用300 nmol/L氢化可的松作为生理浓度(正常机体内皮质醇生理浓度为110~520 nmol/L[6])用于实验,LPS刺激之前预先给予氢化可的松孵育30 min,α7nAChR阻断剂MLA(10 nmol/L)则在氢化可的松处理前30 min加入培养液。
2.3MTT法检测细胞存活率 取对数生长期细胞,以5×107/L密度接种于96孔板,100 μL/well,每组设6个平行孔。BV-2细胞在37 ℃、5% CO2条件下培养过夜,给予氢化可的松处理24 h,每孔加5 g/L MTT 20 μL,继续培养4 h,吸出培养液,加DMSO 150 μL/well,待甲臜完全溶解后,用酶联免疫仪在波长570 nm处读取吸光度(A)。细胞存活率(%)=实验孔A均值/对照组A均值×100%。
2.4ELISA法测定细胞上清细胞因子浓度 取对数生长期细胞,以5×108/L密度接种于24孔板,500 μL/well,每组设3个平行孔。在37 ℃、5% CO2条件下培养过夜,加入LPS刺激适宜时间,收集细胞上清。测定方法按照ELISA试剂盒说明书进行。标准曲线制作参照说明书,设定8个浓度梯度。
3 统计学处理
实验数据经SPSS 14.0分析,用均数±标准误(mean±SEM)表示,组间比较用单因素方差分析(One-way ANOVA)检验,用最小显著差异(least significant difference, LSD)法进行均数间的多重比较。以P<0.05为差异有统计学意义。
结 果
1 不同浓度GCs对BV-2细胞活性的影响
给予2 000、1 000、500、250、125、62.5和30 nmol/L氢化可的松分别作用于BV-2细胞24 h,结果表明2 000 nmol/L和1 000 nmol/L氢化可的松可使细胞存活率降低至(76.9±5.5)%和(90.8±7.3)%,而250 nmol/L(生理浓度范围)氢化可的松对细胞存活率影响很小[(96.4±6.8)%],见图1。
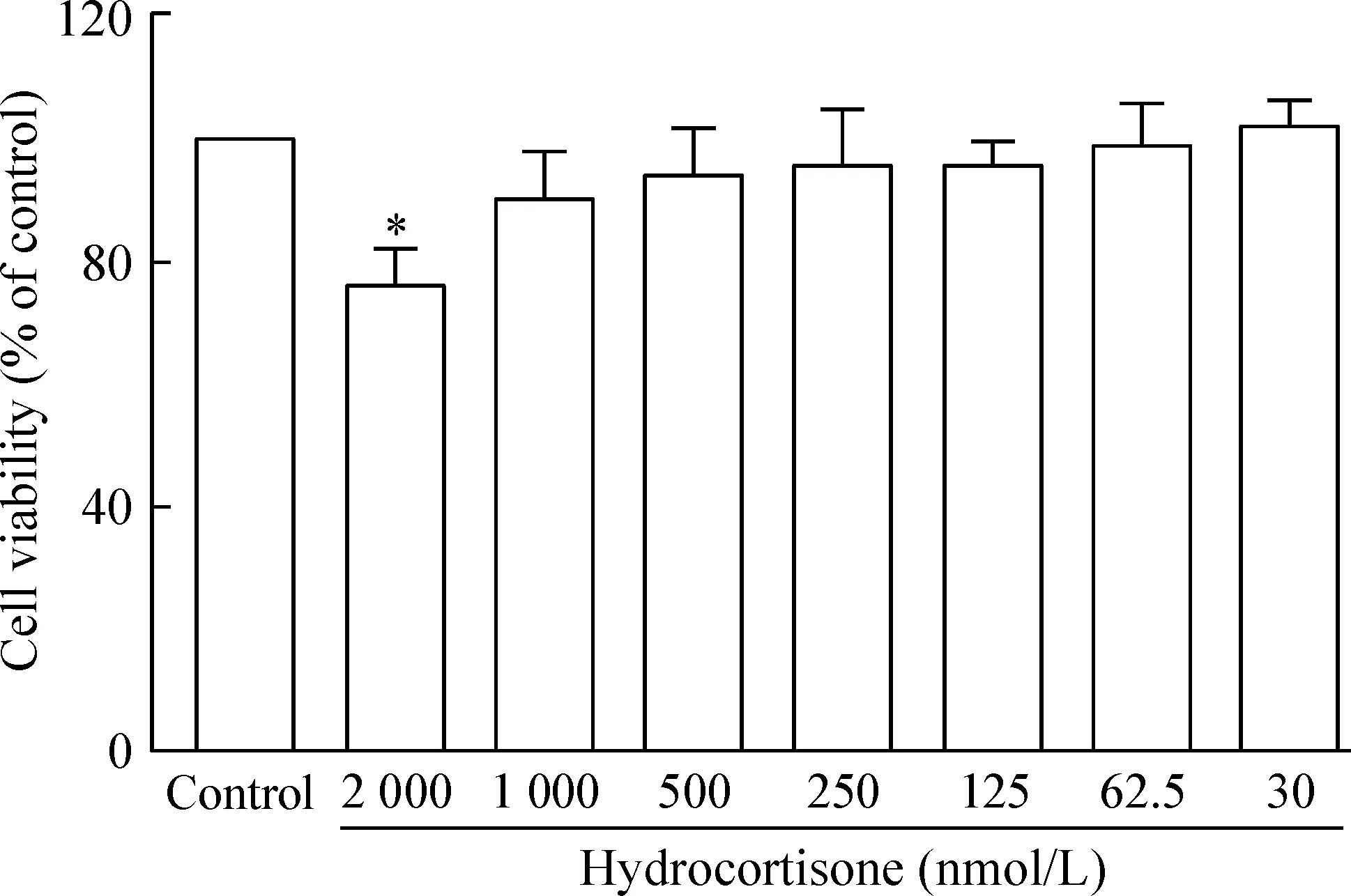
Figure 1. Effects of different concentrations of GCs on the viabi-lity of BV-2 cells.Mean±SEM.n=6.*P<0.05 vs control.
2 LPS刺激BV-2细胞释放炎症因子的时量变化
分别给予0.02、0.1、0.5、1、10 (或0.1、0.5、1、5、10)mg/L LPS刺激BV-2细胞3 h、6 h、12 h和24 h,细胞培养上清中TNF-α和IL-1β的含量随着LPS刺激浓度增加和刺激时间延长逐渐递增,呈现时间和剂量依赖性的关系,见图2。
3 生理浓度GCs对LPS诱导BV-2细胞释放炎症因子的影响
ELISA结果显示,500和250 nmol/L氢化可的松预处理BV-2细胞,均可减少LPS诱导BV-2细胞释放TNF-α和IL-1β,提示生理浓度范围的GCs可以抑制小胶质细胞介导的神经系统炎症,也进一步证实了生理浓度GCs的抗炎作用,见图3。
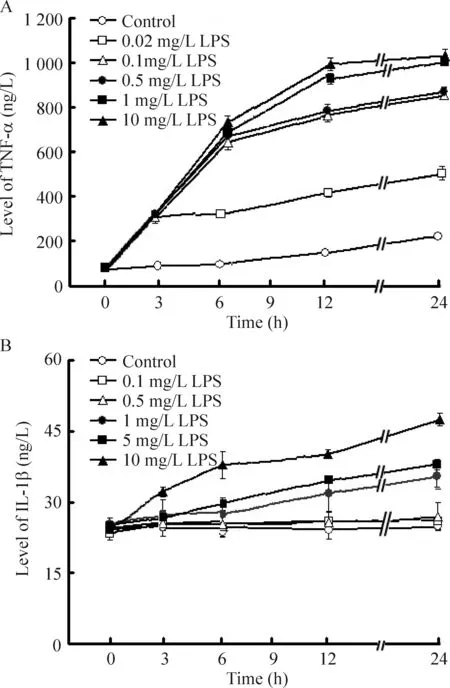
Figure 2. The releases of TNF-α (A) and IL-1β (B) in BV-2 cells stimulated by LPS.Means±SEM.n=3.
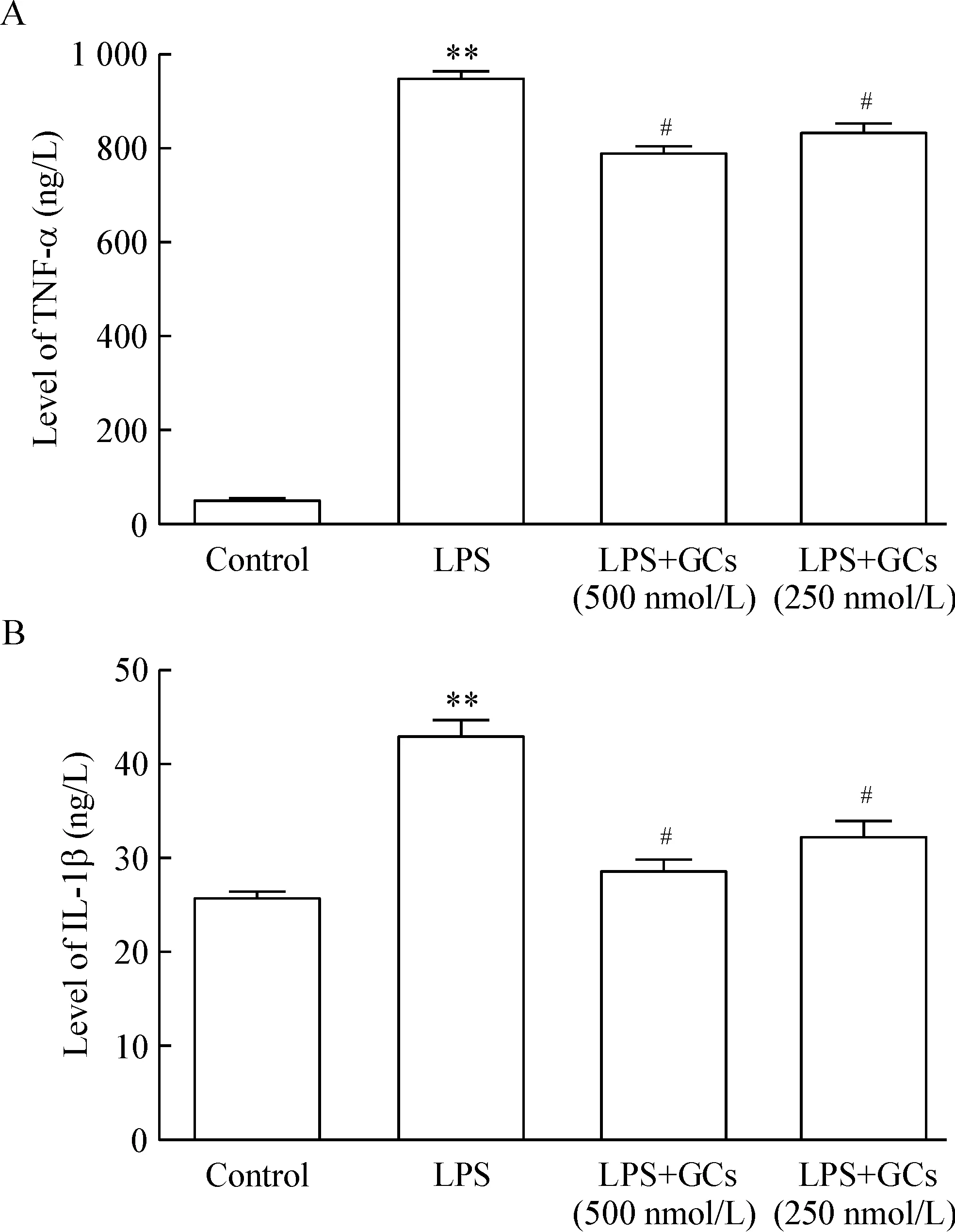
Figure 3. The effects of physiological concentrations of GCs on releases of TNF-α (A) and IL-1β(B) in BV-2 cells stimulated by LPS.Mean±SEM.n=3.**P<0.01 vs control; #P<0.05 vs LPS.
4 MLA对生理浓度GCs抗炎作用的影响
ELISA结果显示,α7nAChR阻断剂MLA(10 nmol/L)预处理BV-2细胞,明显拮抗300 nmol/L氢化可的松对LPS诱导BV-2细胞释放TNF-α和IL-1β的抑制作用,见图4,提示α7nAChR参与并介导了生理浓度GCs的抗炎作用。此外,显微镜下观察可见LPS刺激可诱导小胶质细胞BV-2活化,表现为细胞伪足和突起明显增多;300 nmol/L 氢化可的松可使LPS诱导的小胶质细胞伪足和突起明显减少,显著抑制小胶质细胞活化;而MLA则拮抗氢化可的松这一作用,使BV-2细胞活化增加,见图5。
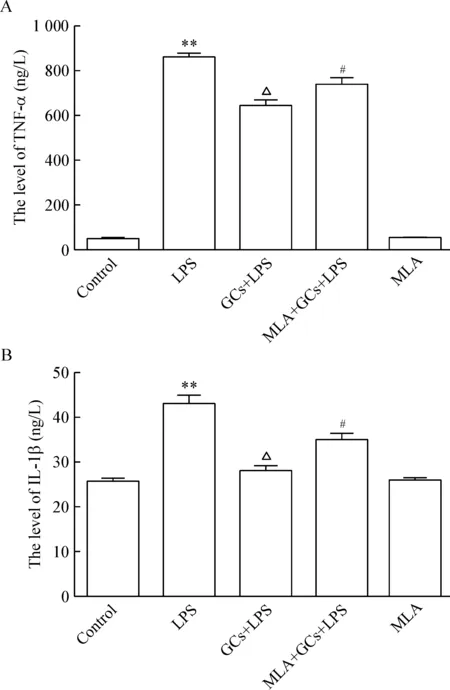
Figure 4. The effects of MLA on releases of TNF-α (A) and IL-1β (B) in BV-2 cells with GCs treatment and LPS stimulation.Means ±SEM.n=3. **P<0.01 vs control;△P<0.05 vs LPS; #P<0.05 vs GCs+LPS.
讨 论
小胶质细胞是中枢神经系统内的巨噬细胞,生理情况下负责清除病原体和异物以维持脑内稳态,但持续激活后产生大量的炎症因子,引起神经元损伤。大量证据表明小胶质细胞激活引起的脑内炎症参与了神经系统退行性疾病的发生和发展,故抑制小胶质细胞活化和控制脑内炎症反应已成为治疗这一类疾病的重要策略[7]。α7nAChR作为胆碱能神经抗炎通路的关键分子,在神经系统退行性疾病中的作用逐渐受到关注。Shytle等[8]首次报道培养的小胶质细胞上大量表达α7nAChR,并且与炎症反应密切相关,尼古丁或乙酰胆碱(α7nAChR激动剂)明显降低LPS 刺激引起的TNF-α等炎症因子产生。近年研究发现小胶质细胞上亦有含量丰富的GRs,这使其成为GCs的直接抗炎靶标[9]。因此,同时表达GRs和α7nAChR的小胶质细胞是连接GCs和胆碱能神经抗炎通路的重要枢纽,直接参与脑内炎症反应的调控。

Figure 5. The effects of MLA on the morphology of BV-2 cells (×20).A: untreated cells (control); B: the cells treated with 0.1 mg/L LPS for 12 h (LPS group); C: the cells were treated with 300 nmol/L hydrocortisone 30 min before LPS (GCs+LPS group); D: pretreatment with 10 nmol/L MLA 30 min before hydrocortisone and LPS (MLA+GCs+LPS group).
传统观点认为只有药理(超生理)剂量的GCs才具有抗炎作用,但我们实验室在心血管系统的研究表明,生理浓度GCs同样发挥抗炎效应[1-3]。虽然啮齿类动物分泌的GCs以皮质酮为主,但本研究是体外实验,故仍然使用皮质醇作为实验药物,研究结果显示高浓度GCs可以降低BV-2细胞存活率,表明超生理剂量GCs具有损伤小胶质细胞的作用,这一结果与高浓度皮质醇可致海马神经元损伤的报道一致,也间接解释了应激可造成机体功能紊乱。实验中使用LPS刺激小胶质细胞,观察GCs对炎症因子TNF-α和IL-1β生成的影响,结果显示生理浓度范围内(250~500 nmol/L)的GCs也明显抑制炎症因子产生,这不仅表明生理浓度GCs可以抑制小胶质细胞介导的神经系统炎症反应,也进一步验证生理浓度GCs的抗炎效应。但在面对炎症挑战时,生理浓度GCs抗炎作用的发挥是否与α7nAChR有关,尚不得而知。本研究发现,α7nAChR的特异性阻断剂MLA预处理小胶质细胞可使生理浓度GCs抑制炎症因子生成的作用减弱,表明MLA拮抗了生理浓度GCs的抗炎作用。
老化是神经系统退行性疾病发生的高危因素。在老化过程中持续慢性应激导致下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal, HPA)轴的功能亢进,引起体内GCs分泌紊乱。研究表明随着年龄增长,动物和人体内GCs水平不断升高。急性和慢性应激都会导致神经系统炎症反应的敏化,在某些情况下升高的GCs甚至展现出促炎效应[10]。因此,生理浓度GCs的抗炎作用可能在神经系统退行性疾病的发生中扮演更为重要的角色。作为机体固有的2个内源性抗炎系统,在神经系统炎症中体液抗炎和胆碱能神经抗炎机制之间存在何种联系是本研究的目的。我们实验中使用的小胶质细胞不仅是介导神经系统炎症的关键环节,也是GCs和胆碱能通路的共同抗炎靶标,研究结果显示α7nAChR阻断剂可以拮抗生理浓度GCs抑制炎症反应的作用,提示α7nAChR参与了生理浓度GCs的抗炎作用。但2条通路之间如何协同发挥抗炎作用,GCs是否通过调节α7nAChR表达,抑或胆碱能神经递质通过影响GCs-GRs通路参与神经系统炎症反应的调节,尚需在进一步的研究工作中深入探讨。
[参 考 文 献]
[1] Zhang HN,He YH, Zhang GS, et al. Endogenous glucocorticoids inhibit myocardial inflammation induced by lipopolysaccharide: involvement of regulation of histone deacetylation[J]. J Cardiovasc Pharmacol, 2012, 60(1):33-41.
[2] He YH, Zhang HN, Zhang GP, et al.A physiological concentration of glucocorticoid inhibits the pro-inflammatory cytokine-induced proliferation of adult rat cardiac fibroblasts: roles of extracellular signal-regulated kinase 1/2 and nuclear factor-κB[J]. Clin Exp Pharmacol Physiol, 2011, 38(11):739-746.
[3] 陈 娟, 罗健东, 李 冰,等. 生理浓度的糖皮质激素对大鼠肺泡上皮细胞炎症因子生成的抑制作用[J].中国药理学通报, 2007, 23(8): 1073-1076.
[4] Tracey KJ. The inflammatory reflex[J]. Nature, 2002, 420(6917): 853-859.
[5] Wang H, Yu M, Ochani M, et al. Nicotinic acetylcholine receptor α7 subunit is an essential regulator of inflammation[J]. Nature, 2003, 421(6921): 384-388.
[6] 姚 泰. 肾上腺皮质的内分泌[M]∥生理学.第6版.北京:人民卫生出版社, 2003: 395-397.
[7] Kaushik DK, Basu A. A friend in need may not be a friend indeed: role of microglia in neurodegenerative diseases[J]. CNS Neurol Disord Drug Targets, 2013, 12(6):726-740.
[8] Shytle RD, Mori T, Townsend K, et al. Cholinergic modulation of microglial activation by α7 nicotinic receptors[J]. J Neurochem, 2004, 89(2):337-343.
[9] Sierra A, Gottfried-Blackmore A, Milner TA, et al. Steroid hormone receptor expression and function in microglia[J]. Glia, 2008, 56(6):659-674.
[10] Frank MG, Miguel ZD, Watkins LR, et al. Prior exposure to glucocorticoids sensitizes the neuroinflammatory and peripheral inflammatory responses toE.colilipopolysaccharide[J]. Brain Behav Immun, 2010, 24(1):19-30.

