沙利度胺抑制TGF-β1诱导的HELF细胞中结缔组织生长因子基因启动子的激活*
王达安, 林逸心, 王 峥, 桑朝磊, 陆大祥, 王华东, 胡巢凤, 魏 伟, 蒋建伟, 付咏梅, 李红梅
(暨南大学医学院 1病理生理学系, 2国家中医药管理局病理生理学重点实验室,3口腔系2010级学生, 4生物化学系,广东 广州 510632)
沙利度胺(thalidomide, THD)目前主要用于麻风病、多发性骨髓瘤等疾病的治疗[1]。最新研究资料显示,沙利度胺也具有良好的抗肺纤维化(pulmonary fibrosis, PF)作用,但确切的药理机制尚未阐明[2-4]。转化生长因子β1(transforming growth factor β1, TGF-β1)诱导肺成纤维细胞等多种细胞的结缔组织生长因子(connective tissue growth factor, CTGF)表达增多被认为是肺纤维化发病的重要环节[5]。本研究利用萤光素酶报告基因系统,观察沙利度胺对TGF-β1诱导的人胚肺成纤维细胞(human embryonic lung fibroblast, HELF)CTGF基因启动子激活作用的影响,为阐明沙利度胺抗肺纤维化的药理机制提供进一步的依据。
材 料 和 方 法
1 材料
人胚肺成纤维细胞系(南京凯基);DMEM细胞培养液(Gibco);小牛血清(浙江天杭);DM2000 DNA ladder、Taq MasterMix试剂盒和感受态大肠杆菌DH5α(广州美津);限制性内切酶HindⅢ和BglⅡ(Toyobo);T4 DNA连接酶(NEB);pGL3-Basic质粒、pRL-SV40质粒和萤光素酶检测试剂盒Dual-Lucife-rase Reporter Assay System(Promega);PCR产物抽提试剂盒和去内素质粒小提试剂盒(Biomiga),GeneFinderTM核酸染料(夏门致善);琼脂糖(无锡NEST);脂质体Polyplus-transfection试剂盒(Bioparc-Bd S. Brant);人类重组TGF-β1(PeproTech);THD(Sigma)。
2 方法
2.1构建荧光素酶报告基因重组质粒pGL3-CTGFP 根据人类CTGF基因启动子序列(GenBank登录号AF316368)设计合成引物(由上海捷瑞合成),上游引物5’-GCCAGATCTTCCCTTTTTCTGGAAACATTGATGG-3’(BglⅡ),下游引物5’-CTGAAGCTTCTGACAGGGCGAGGAGGAGGAC-3’(HindⅢ),以正常人外周血白细胞cDNA为模板,通过PCR扩增获取人CTGF基因启动子片段,PCR产物长度为1026 bp,反应条件:94 ℃预变性2 min,94 ℃ 30 s,60 ℃ 30 s,68 ℃ 1 min,共35个循环。用限制性内切酶BglⅡ和HindⅢ双酶切载体pGL3-Basic,用T4连接酶将PCR目的片段连接到酶切载体上,构成pGL3-CTGFP重组质粒,所构建重组质粒经PCR、双酶切和测序(华大基因)鉴定。
2.2TGF-β1对CTGF基因启动子活性影响的分析 按每孔1×105个细胞将HELF细胞接种于含10%小牛血清的DMEM培养液中,置5% CO2、37 ℃中培养,待细胞生长至融合度约70%时,更换不含小牛血清的DMEM培养液培养24 h,用脂质体Polyplus-transfection(1 μL)将重组质粒pGL3-CTGFP(0.5 μg)转染至培养的HELF细胞中,同时转染含有海肾萤光素酶的pRL-SV40质粒(0.5 μg)作为内参照,培养24 h后,按加入的TGF-β1浓度分组(TGF-β1终浓度分别为0、2.5、5、10和20 μg/L),继续培养24 h后收获细胞检测萤光素酶报告基因活性变化,其中,0 μg/L TGF-β1为对照组(control group),其余为实验组;另外,以同条件培养并转染等量空载体pGL3-Basic和pRL-SV40质粒的HELF细胞(不加TGF-β1)为空白对照组(blank group),以观察TGF-β1对CTGF基因启动子作用的量效关系;为观察TGF-β1对CTGF基因启动子作用的时效关系,按同样方法进行细胞培养、重组质粒pGL3-CTGFP和内参照质粒pRL-SV40转染后24 h,加入5 μg/L TGF-β1,按分组分别培养0 h、12 h、24 h、48 h和72 h后收获细胞,其中,加入TGF-β1后培养0 h的为对照组(control group),其余为实验组;另外,以同条件培养并转染等量空载体pGL3-Basic和pRL-SV40质粒的HELF细胞(不加TGF-β1)为空白对照组(blank group);各组细胞培养至预定时间后收获细胞,按Dual-Luciferase Reporter Assay System试剂盒操作手册,使用MD-SpectraMax M5多光谱微孔板阅读器在560 nm和465 nm波长处检测2种萤光素酶的发光值,以萤火虫萤光素酶发光值/海肾萤光素酶发光值的比值为相对萤光素酶活性,以反映CTGF基因启动子的活性;每次每组3复孔,实验重复3次。
2.3THD对TGF-β1诱导的CTGF基因启动子活性上调的干预作用分析 按2.2的同样方法进行HELF细胞培养、质粒转染;pGL3-CTGFP质粒和pRL-SV40质粒转染24 h后,加入5 μg/L TGF-β1,并同时按分组分别加入不同浓度THD (THD终浓度分别为0、25、50和100 μg/L),继续培养24 h收获细胞,其中,0 μg/L THD为对照组(control group),其余为实验组;另外,以同条件培养并转染等量重组质粒pGL3-CTGFP和pRL-SV40质粒的HELF细胞(不加TGF-β1和THD)为无剌激组(non-treatment group),另一组按前述方法转染pGL3-CTGFP质粒后不加TGF-β1,而只加入50 μg/L的THD为单纯药物组(THD组);培养结束后,按方法2.2所述测定各组相对萤光素酶活性;每次每组3复孔,实验重复3次。
3 统计学处理
应用SPSS 11.0统计学软件处理,数据以均数±标准差(mean±SD)表示,各组间均数比较采用方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
结 果
1 重组质粒鉴定
重组质粒pGL3-CTGFP以前述引物作PCR扩增、用限制性内切酶BglⅡ和HindⅢ作双酶切处理,产物经1% 琼脂糖凝胶电泳后,PCR产物和双酶切产物均在1 000 bp(1 026 bp)左右位置显示清晰条带,与预期的插入片段大小相符,见图1。应用GL2和RV3通用测序引物对pGL3-CTGFP质粒进行双向测序鉴定,测序结果与GenBank上提供的序列完全相同,提示含有人类CTGF基因启动子的萤光素酶报告基因重组质粒pGL3-CTGFP构建成功。

Figure 1. Identification of recombinant plasmid pGL3-CTGFP.Lane 1: PCR product; Lane 2: DNA marker; Lane 3: plasmid pGL3-CTGFP digested by restriction endonuclease.
2 TGF-β1对HELF细胞中CTGF基因启动子活性的影响
从图2、3可见,不加TGF-β1而单纯转染pGL3-CTGFP质粒的对照组的相对萤光素酶活性显著高于仅转染pGL3-Basic空载体的空白对照组(P<0.05),说明静息状态下HELF细胞中CTGF也有一定的基础表达;而转染pGL3-CTGFP质粒并给予不同TGF-β1剌激24 h的各实验组的相对萤光素酶活性均高于对照组(P<0.05),其中以5 μg/L TGF-β1实验组的相对萤光素酶活性最高,其相对萤光素酶活性为对照组的2.16倍,见图2;在观察TGF-β1对CTGF基因启动子作用时效关系的实验中,转染pGL3-CTGFP质粒后加入TGF-β1培养0 h的对照组的相对萤光素酶活性也显著高于空白对照组(P<0.05),而添加TGF-β1后培养不同时间的各实验组相对萤光素酶活性均高于对照组(P<0.05),其中以剌激12 h实验组的相对萤光素酶活性最高,其相对萤光素酶活性为对照组的2.52倍,见图3。以上实验结果表明,TGF-β1能以剂量依赖和时间依赖方式显著上调HELF细胞中CTGF基因启动子的活性。
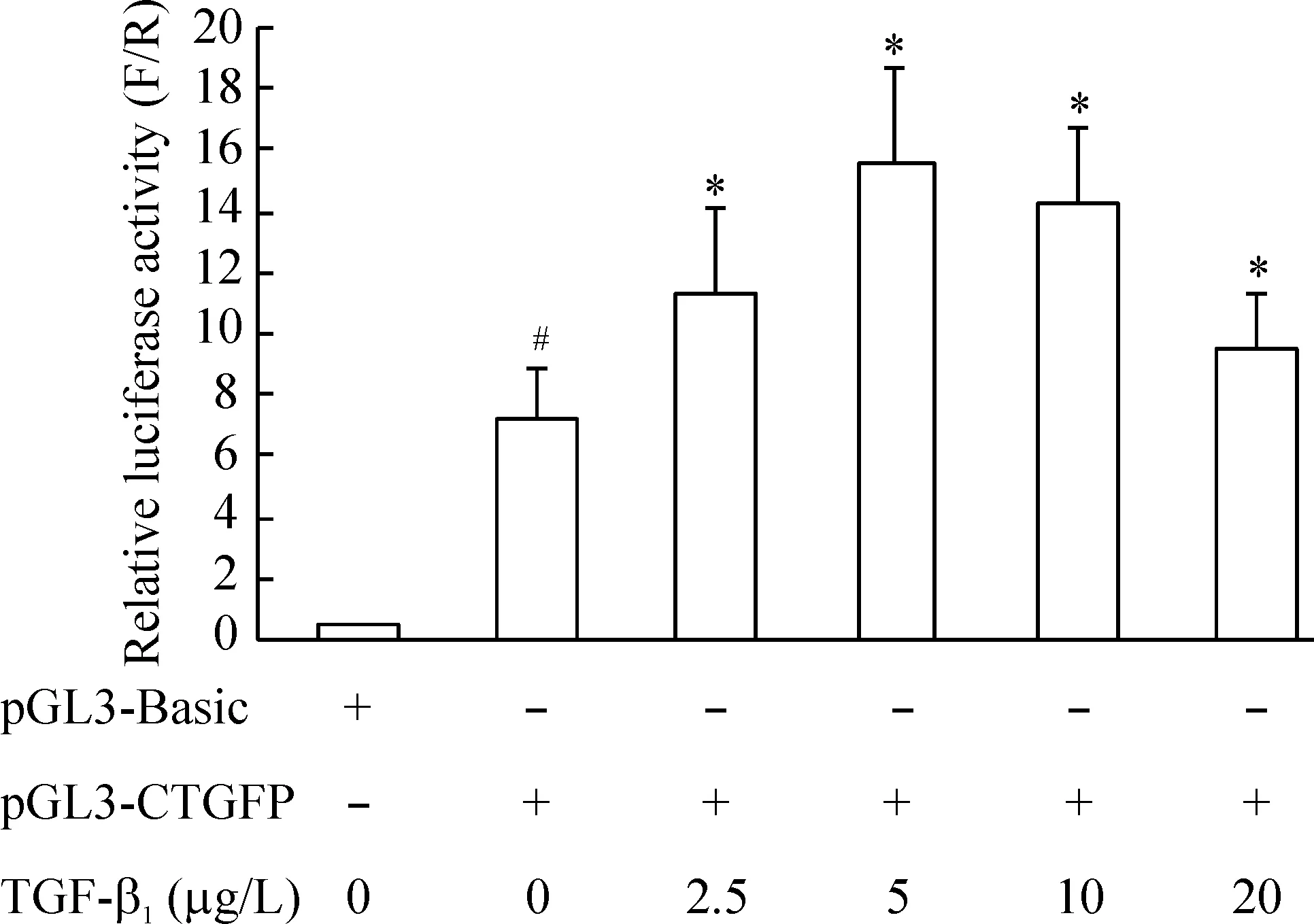
Figure 2. Dose-effect relationship of CTGF gene promoter activation by TGF-β1 in HELF cell line. #P<0.05 vs blank group (with pGL3-Basic alone);*P<0.05 vs control group (with pGL3-CTGFP alone).

Figure 3. Time-effect relationship of aviation of CTGF gene promoter by TGF-β1 in HELF cell line.#P<0.05 vs blank group (with pGL3-Basic alone); *P<0.05 vs control group(with pGL3-CTGFP alone).
3 THD对TGF-β1诱导的HELF细胞中CTGF基因启动子活性上调的影响
从图4可见,转染pGL3-CTGFP质粒并添加TGF-β1的对照组的相对萤光素酶活性显著高于单纯转染pGL3-CTGFP质粒而不加TGF-β1的无剌激组(P<0.05);但pGL3-CTGFP质粒转染后同时加入TGF-β1和不同浓度THD的实验组,其相对萤光素酶活性又均低于对照组(P<0.05),其中以添加50 μg/L THD实验组的相对萤光素酶活性最低,其相对萤光素酶活性仅为对照组的0.61倍。转染pGL3-CTGFP后50 μg/L THD的单纯药物组的相对萤光素酶活性与无剌激组无显著差别(P>0.05)。此实验结果表明,THD能以剂量依赖方式抑制TGF-β1诱导的CTGF基因启动子的激活,而THD对CTGF基因启动子基础活性无明显影响。

Figure 4. Effects of thalidomide (THD) on TGF-β1-induced activation of CTGF gene promoter in HELF cell line. #P<0.05 vs non-treatment group (with pGL3-CTGFP alone);*P<0.05 vs control group (with pGL3-CTGFP and TGF-β1, without THD).
讨 论
CTGF是一种富含半胱氨酸、分子量为36~38 kD的分泌性多肽,属于高度保守的即刻早期基因CCN家族成员,1991年由Bradham等[6]首次在人脐静脉内皮细胞中发现,其广泛存在于人类心脏、肺脏、肝脏、肾脏和结缔组织等多种组织器官中;CTGF具有促有丝分裂、刺激细胞迁移、介导细胞黏附、促进细胞表型转化、促进成纤维细胞增殖和细胞外基质合成,以及促进血管形成等生物学作用;病理情况下,过度表达的CTGF与肺纤维化、肝硬化、糖尿病肾病等器官纤维化发病有密切关系[7]。Lasky等[5]发现,分别给予博莱霉素敏感的C57BL/6小鼠和博莱霉素抵抗的BALB/c小鼠同等剂量的博莱霉素气管内注入后,只有C57BL/6博莱霉素敏感小鼠发生肺纤维化及CTGF mRNA表达的上调,而BALB/c博莱霉素抵抗小鼠CTGF mRNA的表达无明显改变。研究发现,在特发性肺纤维化(idiopathic pulmonary interstitial fibrosis,IPF)患者的肺泡灌洗液和纤维化肺组织中CTGF mRNA和蛋白表达明显上调,纤维化组织中的CTGF主要定位于增生的Ⅱ型肺泡上皮细胞和活化的成纤维细胞中[8-10]。齐曼古力·吾守尔等[11]报道,原位杂交和免疫组化显示IPF患者肺组织的CTGF 的mRNA和蛋白质表达上调,并与反映纤维化程度的纤维连接蛋白(fibronectin,FN)表达水平呈正相关关系,ELISA检测结果表明肺纤维化程度较严重的IPF患者血清中CTGF水平也是升高的。CTGF在器官纤维化发病中的主要作用包括剌激成纤维细胞转分化、增殖和分泌胶原[7];CTGF参与肺成纤维细胞向肌成纤维细胞转化过程,而肌成纤维细胞是肺纤维化时肺间质中胶原纤维的主要来源。刘小菁等[12]报道,CTGF-siRNA能抑制肺成纤维细胞的增殖、表型转化及细胞外基质(extracellular matrix,ECM)合成。
TGF-β1是器官纤维化过程中最重要的致纤维化因子之一,在肝、肺、肾等脏器纤维化模型中均有过度表达;众多研究表明,CTGF很可能是介导TGF-β1促纤维化作用的一个重要的下游因子[13]。体外细胞培养实验表明,肺成纤维细胞不但可以表达CTGF,而且当培养液中加入TGF -β1后能够诱导CTGF表达明显增加[5]。Grotendorst等[14]发现在CTGF启动子-157到-145位有一个TGF-β反应元件(TGF-β response element, TβRE),该区域点突变可致TGF-β1对CTGF的诱导作用完全消除;应用反义CTGF技术可以阻断TGF-β1引起的促纤维化效应[15]。虽然TGF-β1和CTGF在器官纤维化发生机制中属同一信号转导通路中的信号分子,但TGF-β1具有双面作用,正常表达时发挥抑制炎症和细胞过度增殖的正面效应,过度表达时才会引起ECM积聚和组织器官纤维化等负面效应;例如,研究发现,敲除TGF-β1基因的小鼠因为失去对炎症的抑制作用而在出生后很快死于全身性炎症[16],因此限制了拮抗TGF-β1作为靶标的治疗策略的应用。CTGF作为TGF-β1的下游效应介质,只介导TGF-β1的负面效应,TGF-β1的正面效应则由非CTGF途径所介导;在正常情况下CTGF表达水平很低,而且主要在间质细胞表达,其作用也限于结缔组织,拮抗CTGF不会出现阻断TGF-β1后可能产生的有害临床反应。因此,相比TGF-β1来说,通过阻断CTGF达到的抗纤维化作用应该更加特异和安全。
沙利度胺又名反应停,化学名为α-肽胺哌啶酮;沙利度胺在20世纪50年代曾作为镇静剂用于治疗妊娠呕吐, 但其后不久因被发现可引起婴儿的肢畸形及无肢畸形(海豹综合征),使该药迅速撤出市场。20世纪90年代后,由于发现沙利度胺具有抗炎和免疫调节、抗血管生成、抗肿瘤等作用,沙利度胺又被重新以新的适应症开发使用。美国FDA于1998年批准了沙利度胺作为麻风病的治疗用药,2006年又增加其治疗多发性骨髓瘤的适应证[1]。近年临床及动物实验研究表明,沙利度胺对肝、肾、肺等器官纤维化均有一定的治疗作用。临床研究显示,沙利度胺可提高肺间质纤维化老年患者的临床治疗总有效率、胸部CT病变吸收率和肺功能指标[2]。Ye等[17]证实沙利度胺能减少IPF患者肺泡灌洗液中IL-18、IL-8和TNF-α的释放。Tabata等[3]和罗潇等[4]分别报道,沙利度胺能明显抑制博莱霉素诱导的小鼠肺组织I型胶原α1(collagen type I α1,COL1α1)的表达。体外实验证实,沙利度胺对TGF-β1诱导的人胚肺成纤维细胞系HFLF转分化为肌成纤维细胞的过程有抑制作用,可抑制α-SMA和Ⅲ型胶原mRNA的表达[18]。可见,沙度利胺具有较好的抗肺纤维化作用,然而,其确切的作用机制至今尚未清楚。为进一步了解沙利度胺的抗纤维化作用机制,本研究利用萤光素酶报告基因系统,观察了沙利度胺对CTGF基因启动子活性的影响。在本实验研究中,我们首先构建了CTGF启动子驱动的萤光素酶报告基因载体pGL3-CTGFP,并将其转染至HELF细胞,以此作为检测各种测试物对CTGF基因启动子活性影响的细胞模型。实验结果显示,转染pGL3-CTGFP的HELF细胞的萤光素酶活性高于转染空载体pGL3-Basic的细胞,表明CTGF基因在静息状态已有一定水平的表达;而加入TGF-β1后,转染pGL3-CTGFP的HELF细胞的萤光素酶活性明显增强,此作用呈一定量效和时效关系,表明TGF-β1确实是上调CTGF表达的重要因素之一;在此基础上,我们又观察到在加入TGF-β1的同时添加沙利度胺,能使CTGF基因启动子的活性又明显低于单独TGF-β1作用下的水平,并呈一定的剂量依赖关系,这表明沙利度胺对TGF-β1诱导的CTGF启动子激活效应有明显的抑制作用,此作用可能与沙利度胺抗纤维化作用有密切关系,深入探讨其作用的分子机制有可能为抗肺纤维化治疗提供新的思路。
[参 考 文 献]
[1] 臧洪梅,周建平,吕慧侠,等. 沙利度胺的最新研究进展[J]. 药学进展, 2008, 32(1):21-26.
[2] 杨渭临,章 琳,张王刚,等. 沙利度胺治疗老年肺间质纤维化38例分析[J]. 陕西医学杂志, 2011,40(1):91-93.
[3] Tabata C, Tabata R, Kadokawa Y, et al. Thalidomide prevents bleomycin-induced pulmonary fibrosis in mice[J]. J Immunol, 2007, 179(1):708-714.
[4] 罗 潇,刘学军. 沙利度胺通过下调转化生长因子-β1、肿瘤坏死因子-α抑制大鼠肺纤维化 [J]. 中国药物与临床, 2010,10(12): 1346-1349.
[5] Lasky JA, Ortiz LA, Tonthat B, et al. Connective tissue growth factor mRNA expression is upregulated in bleomycin-induced lung fibrosis[J]. AM J Physiol, 1998, 275(2 Pt 1):L365-L371.
[6] Bradham DM, Igarashi A, Potter RL, et al. Connective tissue growth factor: a cysteine-rich mitogen secreted by human vascular endothelial cells is related to the SRC-induced immediate early gene product CEF-10[J]. J Cell Biol, 1991, 114(6):1285-1294.
[7] 杨 敏,黄海长,王海燕. 结缔组织生长因子促纤维化作用及其表达调节的研究进展[J]. 中国病理生理杂志, 2005, 21(1):199-202.
[8] Allen JT, Knight RA, Bloor CA, et al. Enhanced insulin-like growth factor binding protein-related protein 2 (connective tissue growth factor) expression in patients with idiopathic pulmonary fibrosis and pulmonary sarcoidosis[J]. Am J Respir Cell Mol Biol, 1999, 21(6): 693-700.
[9] Pan LH, Yamauchi K, Uzuki M, et al. Type II alveolar epithelial cells and interstitial fibroblasts express connective tissue growth factor in IPF[J]. Eur Respir J,2001,17(6):1220-1227.
[10] 程继荣,齐曼古力·吾守尔,何元兵,等. 特发性肺纤维化患者血清结缔组织生长因子和纤维连接蛋白水平研究[J]. 临床肺科杂志, 2007, 12(2):128-129.
[11] 齐曼古力·吾守尔,程继荣. 结缔组织生长因子在特发性肺纤维化患者肺组织的表达及意义[J]. 华西医学, 2008, 23(2):315-317.
[12] 刘小菁,吴文超,陈槐卿. CTGF基因沉默对肺成纤维细胞增殖及表型转化的影响[J]. 生物医学工程学杂志, 2008, 25(2):407-412.
[13] Leask A, Abraham DJ. TGF-β signaling and the fibrotic response[J]. FASEB J, 2004, 18(7):816-827.
[14] Grotendorst GR. Connective tissue growth factor: a mediator of TGF-β action on fibroblasts[J]. Cytokine Growth Factor Rev, 1997,8(3): 171-179.
[15] Yokoi H, Mukoyama M, Nagae T,et al. Reduction in connective tissue growth factor by antisense treatment ameliorates renal tubulointerstitial fibrosis[J]. J Am Soc Nephrol, 2004, 15(6):1430-1440.
[16] Müller GA, Schettler V, Müller CA, et al. Prevention of progression of renal fibrosis: how far are we?[J]. Kidney Int Suppl, 1996, 49(54):S75-S82.
[17] Ye Q, Chen B, Tong Z, et al. Thalidomide reduces IL-18,IL-8 and TNF-α release from alveolar macrophages in interstitial lung disease[J]. Eur Respir J, 2006, 28(4):824-831.
[18] 王 峙,赵丽丹,张 煊,等. 沙利度胺抑制TGF-β1诱导的人胚肺成纤维细胞系转分化为肌成纤维细胞[J]. 基础医学与临床, 2009, 29(1):59-63.

