神经病理性疼痛大鼠脊髓NF-κB、NR2B和iNOS的表达及意义
叶永贤, 林 洪, 沙 漠, 李招胜, 伍 磊, 冯文龙, 陈智彪, 丁真奇△
(厦门大学附属东南医院 1骨科, 2神经外科,福建 漳州 363000)
国际疼痛研究会将神经病理性疼痛(neuropathic pain, NPP)定义为:由于中枢或外周神经系统的直接损伤和功能紊乱引起的疼痛,它属于一种慢性疼痛,主要表现为痛觉过敏、异常疼痛、感觉异常和自发性疼痛等临床特征[1]。其发病率高,病因复杂,严重影响患者的生活质量,对神经病理性疼痛发生机制的研究已成为医学界的前沿课题,具有重要的医学和社会价值。既往研究表明,NPP与外周和中枢神经系统中复杂的分子机制密切相关。本研究拟通过建立慢性压迫性损伤(chronic constriction injury, CCI)模型,观察CCI大鼠机械痛阈和热痛阈的变化,测定CCI大鼠脊髓核因子κB(nuclear factor-kappa B, NF-κB)、N-甲基D-天冬氨酸受体2B亚基(N-methyl-D-aspartic acid receptor 2B, NR2B)和诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)的表达,旨在探讨神经病理性疼痛的发病机制。
材 料 和 方 法
1 动物和主要试剂
SPF级雄性SD大鼠56只(由厦门大学实验动物中心提供),体重180~220 g,出生8~10周。实验前大鼠适应环境1周,室温22~24 ℃,保证12 h明暗交替光照,自由饮水摄食。根据体重从小到大排列按随机数字表随机分为sham组(n=8)和CCI组(n=48)。
Trizol总RNA提取试剂(Invitrogen)、组织RNA提取试剂盒(Omega)、第1链cDNA合成试剂盒(TaKaRa)和PCR扩增试剂盒(Taq)均购自上海生工生物工程股份有限公司;RIPA裂解液(强)、凝胶配置试剂盒、BCA蛋白浓度测定试剂盒、超敏ECL化学发光试剂盒(Beyontime)和聚偏二氟乙烯膜(polivinylidene fluoride, PVDF)膜(Millipore)购自福州升丰生物技术有限公司;NF-κBⅠ抗、NR2BⅠ抗和iNOSⅠ抗均购自厦门鹭隆生物科技发展有限公司。
2 主要方法
2.1CCI模型的建立 参考Bennett等[2]的方法结扎大鼠左侧坐骨神经。Sham组仅暴露坐骨神经,不结扎;CCI组建立CCI模型。
2.2机械缩爪阈值(mechanical withdrawal threshold MWT;即50%缩爪阈值)测定 各组大鼠分别于术前1 d、术后1 d、4 d、7 d、14 d和21 d以von Frey纤维测定机械痛阈。采用up-and-down的方法测定大鼠50%缩爪阈值。依次使用2.0 g、4.0 g、6.0 g、8.0 g、10.0 g、15.0 g和26.0 g的力度刺激后肢。开始时用4 g的力度刺激,若无缩腿反应,则选择后一个力度6 g刺激后肢;若有缩足反应,则选择前一个力度2 g刺激后趾。依此类推,在出现一次与前一次不同反应(有缩腿反应至无缩腿反应或者无缩腿反应至有缩腿反应)时,继续依序刺激4次,包括以前的2次,一共6次,即可完成50%缩爪阈值的测定。50%缩爪阈值的计算公式:50% threshold (g)= 10logXf+kδ/10 000 (Xf为最后刺激所用力度,k为不同刺激方式的系数,在表中[3-4]查找,δ是指各刺激力度 (log值) 相邻间距的平均数,此处δ=0.186)。
2.3热刺激缩爪潜伏期(paw withdrawal latency,PWL)测定 选用中国医学科学院生物医学工程研究所研制生产的BME-410A型热痛刺激仪,各组大鼠分别于术前1 d、术后1 d、4 d、7 d、14 d和21 d使用以下方法测定热痛阈值:将大鼠置于底为3 mm厚玻璃板的有机玻璃箱中,当大鼠安静后,用热辐射刺激仪(50 W, 20 V)发出5 mm光斑照射大鼠足底,电子秒表记录从照射开始至大鼠出现抬腿回避时间即为PWL,注意照射时间不超过30 s,以免造成组织损伤,最长记为30 s。每只大鼠测量5次,间隔10 min,去掉最小值和最大值,计算3次PWL平均值。
2.4RT-PCR CCI组大鼠于术前1 d、术后1 d、4 d、7 d、14 d和21 d测定痛阈后断头处死(n=4),处死放光血液后取L4~L6脊髓组织于匀浆器中加入液氮研磨后,加入1 mL Trizol进行裂解,使用组织RNA提取试剂盒分离提取总mRNA。初步测定总mRNA浓度后,使用第1链cDNA合成试剂盒合成cDNA模板,以反转录后的cDNA模板进行RT-PCR反应。BandScan软件分析NF-κB、NR2B和iNOS mRNA的表达水平。并将NF-κB、NR2B和iNOS mRNA的表达进行相关性分析。RT-PCR引物序列如表1所示。

表1 引物序列
2.5Western blotting CCI组大鼠于术前1 d、术后1 d、4 d、7 d、14 d和21 d测定痛阈后断头处死(n=4),取L4~L6脊髓组织于细胞裂解缓冲液中匀浆,分离提取总蛋白溶液。初步测定总蛋白浓度后,以40 μg蛋白在SDS-PAGE胶上电泳分离,之后转印到PVDF上。用5%脱脂牛奶封闭2 h,在4 ℃条件下与Ⅰ抗孵育过夜(1∶1 000),洗膜后于室温下置入辣根过氧化物酶标记的Ⅱ抗溶液(1∶10 000)中孵育1 h,最后用超敏ECL化学发光试剂盒显像。Quantity one软件分析NF-κB、NR2B和iNOS条带的平均灰度值。
3 统计学处理
采用SPSS 13.0统计软件分析,数据用均数±标准差(mean±SD)表示。MWT及PWL的数据采用成组t检验。RT-PCR和Western blotting的数据组内比较采用单因素方差分析及LSD法。以P<0.05为差异有统计学意义。
结 果
1 CCI模型的建立
Sham组大鼠CCI术后伤口未见感染,无异常渗出,肢体活动正常,无受限;CCI组大鼠术后自发性抬起左侧肢体,不愿着地负重,患侧出现跛行,有舔足、咬足和甩足现象,无一例发生感染和自噬伤残肢体现象。
2 各组大鼠机械痛阈值变化
与sham组相比,CCI组术侧从术后1 d开始出现MWT值下降(P<0.01),术后7 d降至最低(P<0.01)。术后14 d时仍处于较低水平(P<0.01),见图1。
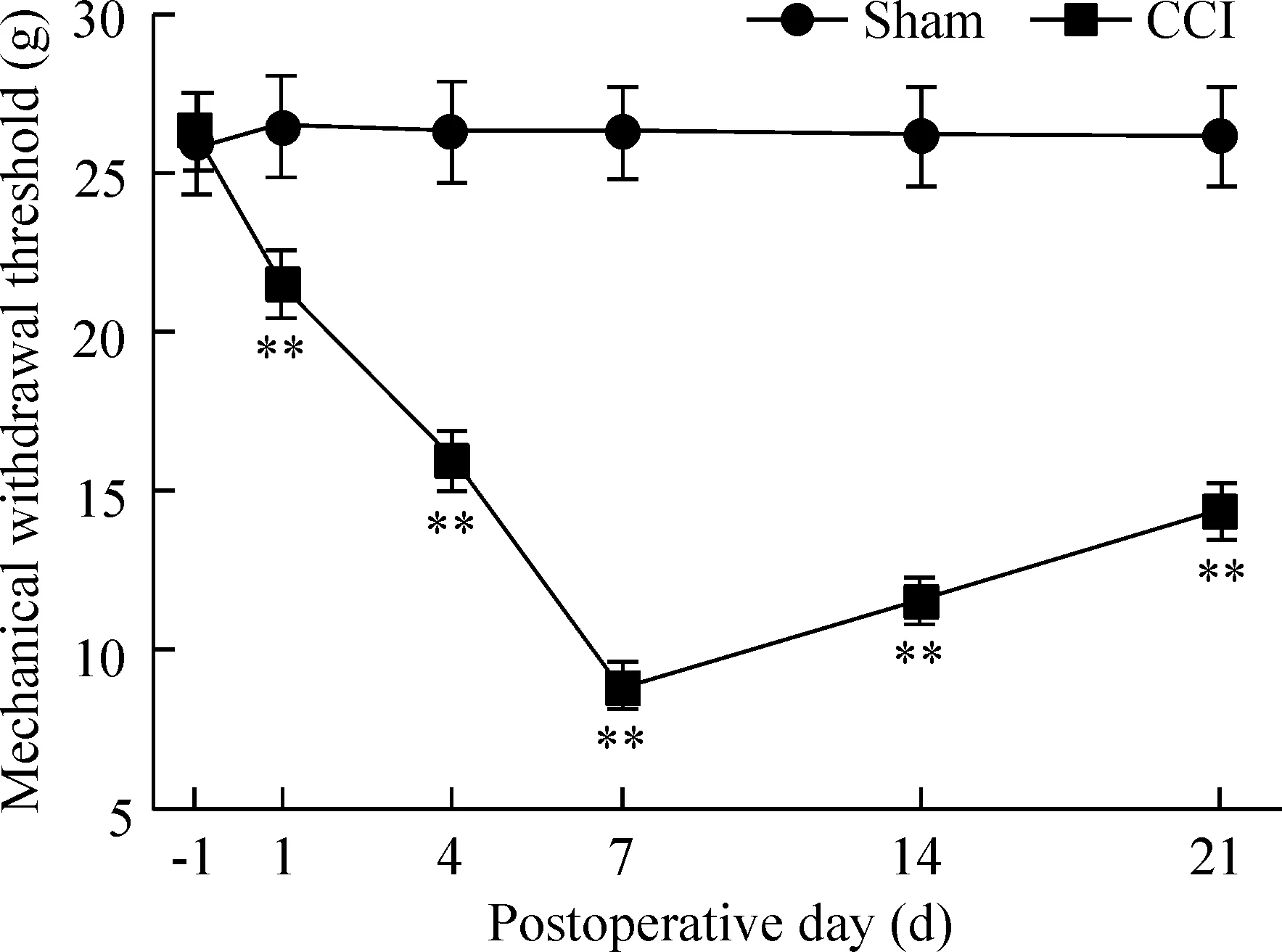
Figure 1. The change of mechanical withdrawal threshold in the rats with CCI of the sciatic nerve.Mean±SD.n=8.**P<0.01 vs sham.
3 各组大鼠热痛阈值变化
与sham组相比,CCI组术侧从术后1 d开始出现PWL值下降(P<0.01),术后7 d降至最低(P<0.01)。术后14 d时仍处于较低水平(P<0.01),见图2。
4 RT-PCR检测脊髓组织中NF-κB、NR2B和iNOS mRNA的表达
脊髓组织中NF-κB和NR2B mRNA的含量于损伤后1 d开始增加(P<0.01);7 d达到高峰,与术前相比有显著差异(P<0.01)。术后14 d虽有所降低,但仍维持在较高水平(P<0.01)。iNOS mRNA的表达于术后1d开始增加(P<0.01),术后14 d达到高峰,显著高于术前(P<0.01),术后21 d时仍保持较高水平表达(P<0.01),见图3和表2。iNOS mRNA与NF-κB mRNA和NR2B mRNA的表达呈显著正相关(r=0.842,P<0.05;r=0.833,P<0.05)。
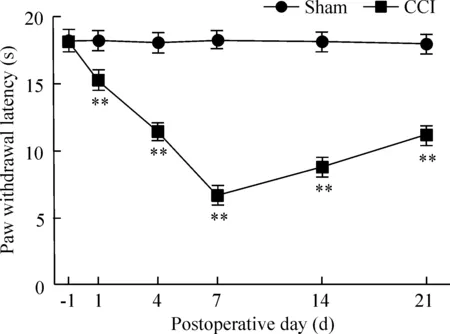
Figure 2. The change of paw withdrawal latency in the rats with CCI of the sciatic nerve.Mean±SD.n=8.**P<0.01 vs sham.
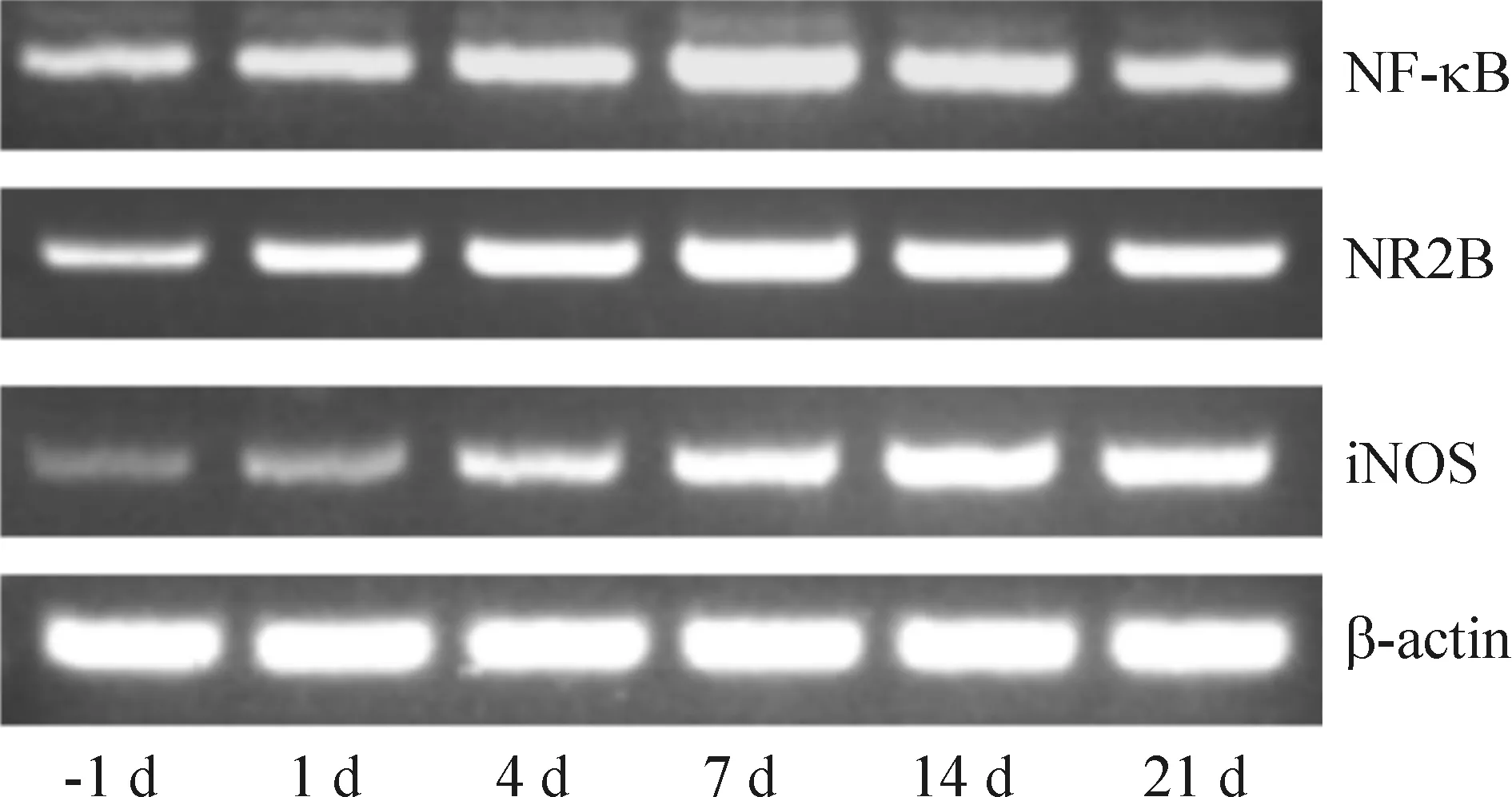
Figure 3. The mRNA expression of NF-κB, NR2B and iNOS in the spinal cord of the rats with CCI of the sciatic nerve detected by RT-PCR.
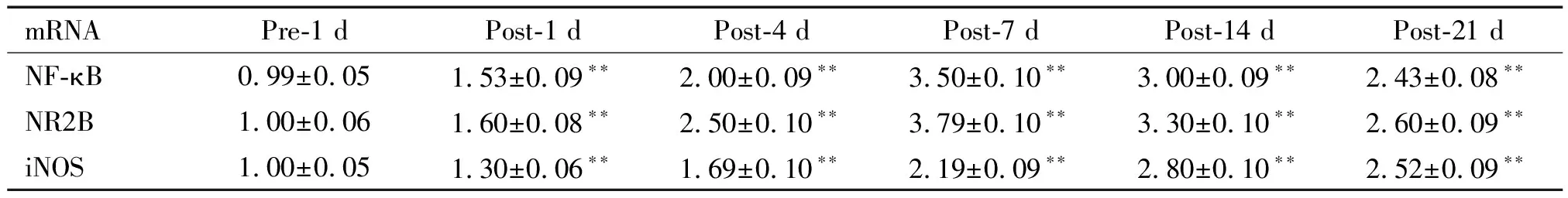
表2 CCI组大鼠术后各时点NF-κB、NR2B和iNOS mRNA的表达
5 Western blotting检测脊髓组织中NF-κB、NR2B和iNOS蛋白的表达
脊髓NF-κB和NR2B 的蛋白含量于损伤后1 d开始增加(P<0.01);7 d达到高峰,与术前1 d相比有显著差异(P<0.01),术后14 d虽有所降低,但仍维持在较高水平(P<0.01)。脊髓iNOS 蛋白表达于术后1 d开始增加(P<0.01),术后14 d达到高峰,显著高于术前(P<0.01),术后21 d时仍保持较高水平表达(P<0.01),见图4。
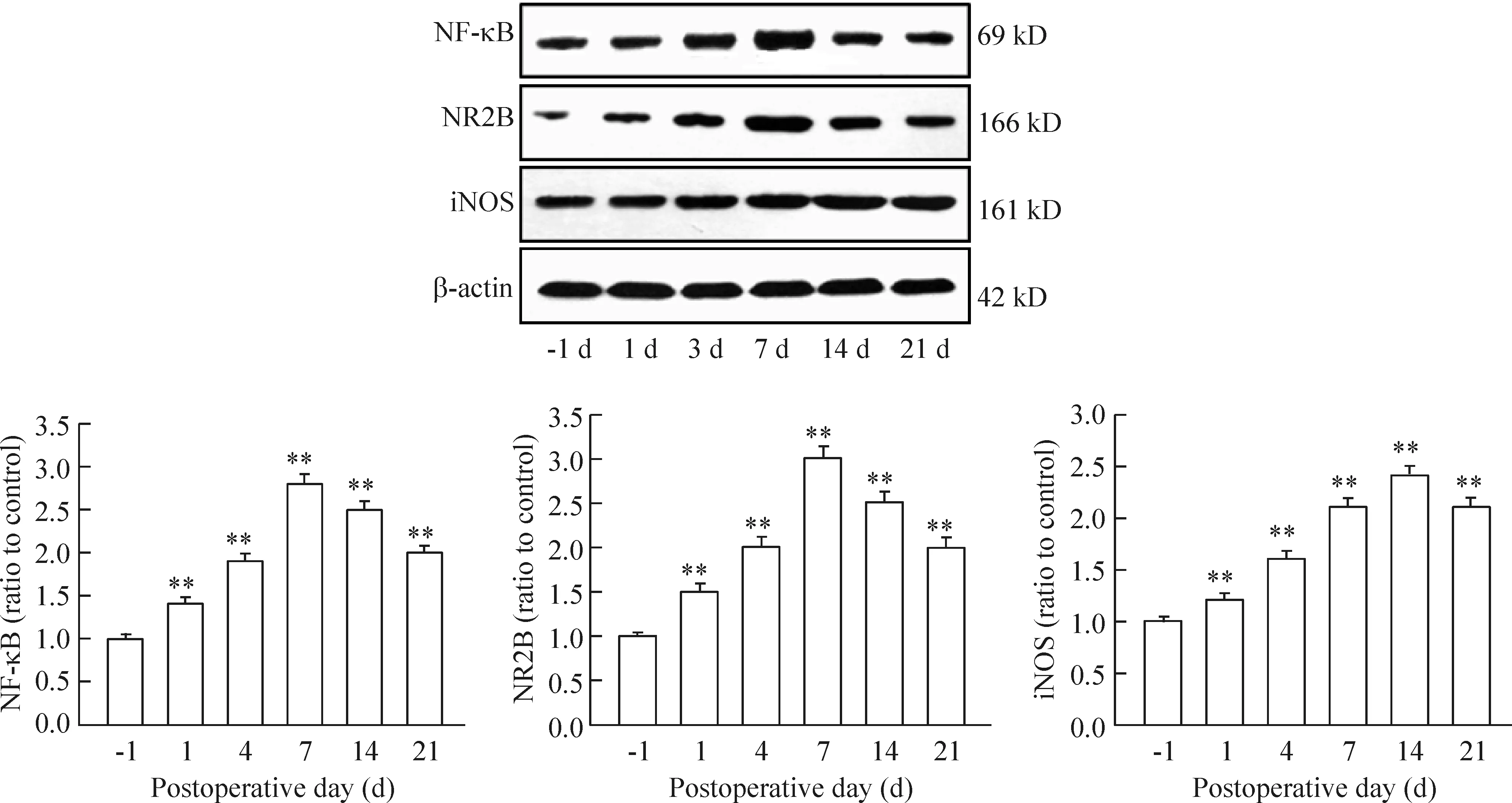
Figure 4. The relative protein levels of NF-κB, NR2B and iNOS in the spinal cord of the rats with CCI of the sciatic nerve detected by Western blotting. Mean±SD. n=4. **P<0.01 vs -1 d.
讨 论
国际疼痛研究学会的神经病理性疼痛专家研究小组(Neuropathic Pain Special Interest Group of the International Association for the Study of Pain, Neu-PSIG)对神经病理性疼痛的最新定义是:躯体感觉系统的疾病或病变直接引起的疼痛[5]。NPP在给患者带来极大的生理和心理折磨的同时,也带来了严重的社会压力。NPP是多因素参与的紧密联系的过程,对诸多参与机制间的相互关系进行研究意义重大,其发生发展过程中分子机制的阐明,有助于开发针对NPP的新的治疗方法。
NPP的主要行为学特征是自发性疼痛、痛觉过敏和异常疼痛。其动物模型构建的方法较多,各有优缺点。本研究采用的是CCI神经病理性疼痛动物模型,其致病机制是大鼠对铬制肠线特异性的免疫反应,引起神经干肿胀,进而出现神经压迫和神经干部分切断,从而导致神经病理性疼痛的表现。实验发现,手术组术侧MWT和PWL显著下降,提示CCI大鼠出现机械痛敏和热痛敏。表明适度的坐骨神经结扎选择性损伤了有髓鞘的粗纤维,保留了大部分传递痛觉的C纤维,标志CCI模型成功建立。
NF-κB是一种重要的核转录因子,位于胞质中以p50/p56异二聚体的形式存在,平时与抑制性蛋白IκB结合而呈现非活性状态。被多种刺激剂激活后,NF-κB与IκB解离后转位入核与靶基因启动子/增强子上的κB位点结合。参与调节多种靶基因包括炎症因子和疼痛介质等的表达,NF-κB与其下游的炎症因子一同参与了神经病理性疼痛的产生[6]。在神经损伤诱导疼痛的大鼠脊髓组织中NF-κB活化并直接参与疼痛发展。
NMDA受体在神经病理性疼痛的神经元机制和胶质-免疫机制的发生发展中承担着调节突触间信号传播,加速神经元变性和参与神经元-胶质细胞间信息通讯等重要作用。NR2B作为NMDA受体的调节性亚基,决定着NMDA受体的一系列重要特性。研究表明,神经病理性疼痛时,痛觉传入神经元末梢在脊髓中释放大量的谷氨酸,通过激活NMDA受体,提高痛觉传递神经元的兴奋性;与此同时,经NMDA受体内流的Ca2+激活邻近的NOS,NOS合成的一氧化氮(nitric oxide, NO)可透过细胞膜弥散至突触前膜加速谷氨酸的释放,促进疼痛的产生。
NO作为一种多功能的信使分子最早被认为具有血管内皮舒张作用。在机体内发挥着诸如调节免疫和炎症反应、阿片耐受和神经传导等作用[7]。受损神经相应脊髓节段的NOS在疼痛的调节中发挥着重要作用。既往研究表明,在中枢神经系统中,NO的合成主要是由NMDA受体的激活而触发的。同时亦有文献表明,iNOS启动子上有NF-κB结合位点,iNOS的表达受NF-κB在转录上调控。
实验发现,CCI组MWT和PWL于术后1 d开始下降,在7 d时达到高峰;与术前相比,NF-κB于术后1 d开始增加,7 d时达到高峰,14 d和21 d时仍维持较高表达。其变化与CCI大鼠痛觉过敏程度关系密切,证实NF-κB在神经病理性疼痛的发生和发展中有重要的作用。NR2B参与体内许多复杂的生理和病理过程,不仅包括长时程增强、学习记忆、细胞坏死和凋亡等[8],而且还在痛敏的产生和维持方面起关键作用[9]。本实验采用CCI模型,术后7 d和14 d大鼠痛阈明显低于sham组,并且RT-PCR和Western blotting发现的脊髓NR2B表达增加。疼痛行为、痛阈值下降和脊髓NR2B表达增加具有统一性。说明外周伤害性刺激可引起脊髓NR2B表达增加,是导致CCI大鼠神经病理性疼痛的重要因素之一。与sham组相比,CCI组iNOS mRNA水平于术后14 d达到高峰,在21 d时仍维持较高水平。iNOS的表达高峰较NF-κB、NR2B及疼痛高峰的延迟现象,提示iNOS可能不参与慢性疼痛的触发和启动,而与慢性疼痛的长期维持有关。通过对RT-PCR和Western blotting结果进行相关性分析也表明,iNOS的表达与NF-κB和NR2B的表达呈正相关。CCI大鼠痛觉过敏在术后14 d以后仍维持在较高水平,与脊髓iNOS大量表达有关,可能是激活的NF-κB上调iNOS表达,参与神经元细胞的Ca2+过载引起神经元细胞的凋亡。同时可能包括了NR2B-NOS信号通路[10]的协同作用。
综上所述,CCI术后大鼠脊髓中NF-κB、NR2B及下游iNOS表达增加,可能与神经病理性疼痛的产生和维持有关。
[参 考 文 献]
[1] Attal N, Bouhassira D. Neuropathic pain: experimental advances and clinical applications [J]. Revue Neurologique, 2004, 160(2):199-203.
[2] Bennett GJ, Xie YK. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man [J]. Pain, 1988, 33(1):87-107.
[3] Dixon WJ. Efficient analysis of experimental observations [J]. Annu Rev Pharmacol Toxicol, 1980, 20:441-462.
[4] Chaplan SR, Bach FW, Pogrel JW, et al. Quantitative assessment of tactile allodynia in the rat paw [J]. J Neurosci Methods, 1994, 53(1):55-63.
[5] Geber C, Baumgartner U, Schwab R, et al. Revised definition of neuropathic pain and its grading system: an open case series illustrating its use in clinic practice [J]. Am J Med, 2009, 122(10 Suppl):S3-S12.
[6] Sun T, Luo J, Jia M, et al. Small interfering RNA-mediated knockdown of NF-κBp65 attenuates neuropathic pain following peripheral nerve injury in rats[J]. Eur J Pharmacol, 2012, 682(1-3):79-85.
[7] Tulic MK, Wale JL, Holt PG, et al. Differential effects of nitric oxide synthase inhibitors in aninvivoallergic rat model[J]. Eur Respir J, 2000, 15(5):870-877.
[8] Kloda A, Martinac B, Adams DJ. Polymodal regulation of NMDA receptor channels[J]. Channels(Austin), 2007, 1(5):334-443.
[9] Leem JW, Kim HK, Hulsebosch CE, et al. Ionotropic glutamate receptors contribute to maintained neuronal hyperexcitability following spinal cord injury in rats[J]. Exp Neurol, 2010, 224(1):321-324.
[10] Wang W, Mei XP, Wei YY, et al. Neuronal NR2B-containing NMDA receptor mediates spinal astrocytic c-Jun N-terminal kinase activation in a rat model of neuropathic pain[J]. Brain Behav Immun, 2011, 25(7):1355-1366.

