R-苯乙醇高产菌株的筛选及分子生物学鉴定
王 丹, 曾顺泽, 彭 果, 姜青贵, 何 浪
(成都医学院生物医学系,四川成都610083)
手性苯乙醇及其衍生物是合成多种手性药物如R-地诺帕明、R-托莫西汀、S-氟西汀、R-沙丁胺醇等的重要中间体[1].为获得光学活性纯的苯乙醇,应用最广的是化学催化不对称合成法[2-4].近年来,生物催化因反应条件温和、产物立体选择性高、对环境友好等优点成为获得光学活性产物的另一种有效途径[5-8].目前,生物法不对称还原前手性芳香酮的相关报道较多[9-11],但仍然无法实现工业化生产的原因之一就是生产菌株催化活性不稳定、产物积累量不高及立体选择性较差.并且,筛选到的菌株催化产物大多为S-构型[12-14],R-构型较少.为获得光学活性苯乙醇的高产菌株,我们将薄层色谱TLC分析法应用到苯乙醇产生菌株的筛选工作中,成功筛选到一株可将苯乙酮不对称还原合成R-苯乙醇的菌株cmq6-8,根据该菌株的26SrDNADl/D2区域分析的结果,并结合菌株cmq6-8的部分生理生化特征,初步鉴定cmq6-8为解脂耶氏酵母菌,为下一步的发酵条件和转化条件的优化,以及生物催化不对称合成R-苯乙醇及其衍生物的工业化生产提供理论及技术支持.
1 材料与方法
1.1 样品成都某手性化工厂污水处理池附近采集的土壤样品及本实验室保存菌株.
1.2 菌株的分离与纯化首先将采集的土壤样品配制成悬液,适当稀释后涂布于筛选培养基,30℃,培养3~5 d后挑取形态各异的单菌落转接于PDA斜面上,30℃,培养3~5 d后于4℃保存,备用.
1.3 菌体培养用无菌牙签从PDA斜面上挑取少量菌苔接种于20 mL种子培养基中,30℃,170 r/min,摇床(上海智城分析仪器制造有限公司,ZHWY-211C型)培养24 h后再按5%的接种量接入50 mL发酵培养基中,30℃,170 r/min,摇床培养48 h,备用.
1.4 生物转化收集发酵液,于6 000 r/min、4℃、离心10 min.将菌体沉淀用pH 6.8的磷酸盐缓冲溶液洗1~2次后,将5 g湿菌体转接入20 mL pH 6.8的磷酸盐缓冲溶液中,按体积分数2%和终浓度108 mmol/L加入葡萄糖和底物苯乙酮,30℃、170 r/min转化48 h.转化结束后,按体积比1∶1的量向转化体系中加入乙酸乙酯,充分震荡后,静止2~3 min,于6 000 r/min,4℃,离心10 min,取上清液进行TLC检测.
1.5 TLC分析(初筛)将铺好的硅胶薄层板放在烘箱中,按照50℃、30 min;80℃、30 min;110℃、1 h的步骤进行活化.活化后放于干燥器中冷却,备用.在距离薄层板底部边沿约3 cm处,用铅笔轻轻划一条直线为点样线,并用铅笔标识点样点,点样量为0.2 mL.展开剂为甲苯和乙酸乙酯的混合液(体积比V甲苯∶V乙酸乙酯=4∶1),展开时间为8 min,之后用254 nm UV照射及碘蒸气熏蚀2种方法显现底物苯乙酮及产物苯乙醇所产生的斑点.最后根据斑点的大小和显色的深浅对菌种的转化能力进行初步判断.
1.6 GC分析(复筛)选取出现产物苯乙醇斑点且斑点较大、颜色较深的菌株进入复筛.菌体培养及生物转化过程同上.转化还原反应结束后,反应液用乙酸乙酯萃取(1∶1,体积比),再用无水Mg-SO4干燥后进行GC分析.使用GC-960气相色谱仪,HP Chiral 10%3-Cyclodextrin手性色谱柱(30 m×0.32 mm×0.25 μm);检测条件:载气为氮气,进样器、色谱柱和FID检测器温度分别为220、110和200℃;分流比为1∶100;进样量为0.1 mL.分别以底物的转化率和产物的对映体过量值表示反应的转化程度和立体选择性,其表达式为

其中,c0为底物的初始浓度,c苯乙醇为反应终止时的产物浓度,cR和cS分别为R-型和S-型产物的浓度.
1.7 催化活性稳定性实验将菌株连续传代20次,在0~4℃的冰箱中保存.再从每一代的斜面培养基上刮1满环菌苔于种子培养基中培养及转化,过程同上.再通过GC检测其底物的转化率及产物的对映体过量值.
1.8 菌落形态及生理特征分析利用肉眼及显微镜观察固体平板上的菌落形态及细胞,并根据《酵母菌的特征与鉴定手册》[15]所列的酵母菌种鉴定方法进行生化特征分析.
1.9 分子生物学鉴定
1.9.1 酵母基因组DNA提取 参考《酵母基因组提取试剂盒》的操作说明,提取酵母基因组DNA.
1.9.2 26SrDNAD1/D2区域的PCR扩增26SrDNAD1/D2区域的PCR扩增采用通用引物对NL1(5′-GCAT CAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)PCR 反应体系(50 μL):10×PCR 缓冲液,5 μL;Mg2+(5 mmol/L),3 μL;dNTP(各 2.5 mmol/L),4 μL;引物(10 μmol/L)各 1 μL;TaqDNA 聚合酶 0.5 μL;模板DNA 2.0 μL;去离子水33.5 μL.扩增程序为:94 ℃、10 min,94℃、1 min,50℃、1 min,72 ℃、1 min;35个循环后72℃、10 min.取5 μL产物于1%的琼脂糖凝胶(含GV染料)电泳,紫外灯下观测结果.
1.9.3 序列分析和系统树的构建 将扩增出的PCR产物40 μL,送华大基因公司(北京)完成测序工作.根据供试菌株的26SrDNA序列,运用Blast程序在GenBank数据库中分别进行同源序列搜索.根据同源序列搜索的结果,下载相关菌种的26SrDNA序列,与供试菌株的序列一同用Clustal X 1.83软件进行多序列比对,结果采用MEGA3.1中的邻接法进行系统树的构建,并用Bootstrap对进化树进行1 000次可信度分析.
1.10 各种培养基筛选用培养基(底物诱导):苯乙酮1 g/L,蛋白胨 1 g/L,(NH4)2SO41 g/L,琼脂粉17 g/L,蒸馏水1000 mL,pH自然;斜面培养基(PDA):马铃薯200 g/L,葡萄糖 20 g/L,琼脂粉17 g/L,蒸馏水 1 000 mL,pH自然;种子培养基(YPD):葡萄糖 10 g/L,酵母膏 5 g,蒸馏水1 000 mL,pH 7;发酵培养基:蛋白胨 10 g/L,酵母膏5 g/L,葡萄糖20 g/L,(NH4)2SO4g/L,KH2PO42 g/L,蒸馏水1 000 mL,pH 7.上述培养基的灭菌条件均为115℃、30 min.
1.11 主要试剂与药品苯乙酮、R/S-苯乙醇、硅胶GF254均购自成都蜀都化学试剂公司,纯度为99%;S-苯乙醇、R-苯乙醇标准品购自Sigma-Aldrich,手性选择性≥99%(对映体总和,气象色谱GC);其它试剂均为市售分析纯或生物试剂.
2 结果与分析
2.1 供试菌株筛选分离纯化筛选培养基以苯乙酮作为唯一碳源,获得菌落形态各异的菌株共224株,同本实验保存的34酵母菌一起作为R-苯乙醇高产菌株的供试菌.
2.2 苯乙醇高产菌株筛选应用摇瓶培养配合TLC检测方法,初步挑选在硅胶板上形成的斑点直径大且颜色深的8株菌进行气相色谱分析(图1).其中,菌株cmq6-8的结果最好,GC检测显示,cmq6-8可将苯乙酮不对称合成的R-苯乙醇,底物转化率为49.42%,产物对映体过量值为94.81%.
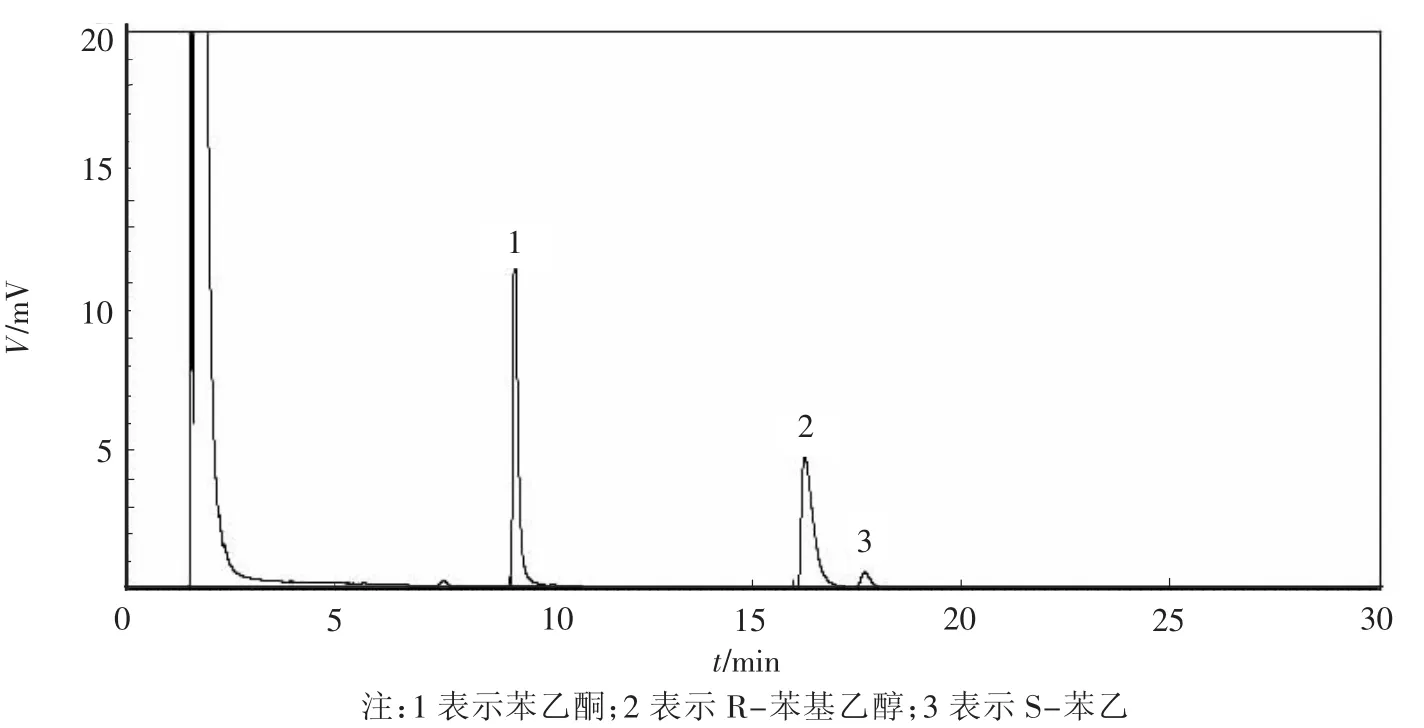
图1 气相色谱检测cmq6-8催化苯乙酮的不对称反应Fig.1 Gas chromatography(GC)of reduction products by cmq6-8
2.2 催化稳定性研究将cmq6-8连续传20代,并分别考察子1代、子5代、子10代、子15代、子20代菌株对底物苯乙酮的不对称催化能力,结果显示底物转化率及产物的对映体过量值变化不大,分别为50% ±1.65%,95% ±0.87%(图2),说明菌株cmq6-8催化活性相对稳定,具有工业化应用的潜力.
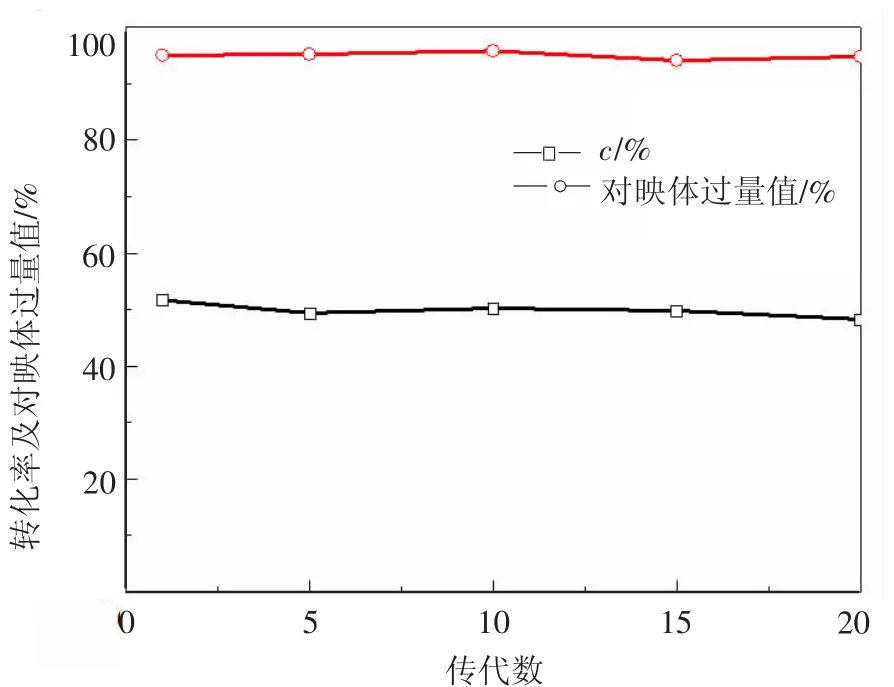
图2 菌株传代次数对cmq6-8不对称还原苯乙酮影响Fig.2 Effects of strain generations on the asymmetric reduction of acetophenone by cmq6-8
2.3 形态学观察及部分生理特征菌株cmq6-8的菌落成圆形、边缘整齐、乳白色、不透明、有光泽、质地软;显微镜下菌体细胞呈卵圆形、无菌丝体、未见出芽,有子囊孢子、有掷孢子产生;糖发酵试验:麦芽糖+,葡萄糖+,乳糖-;碳源同化试验:麦芽糖+,乳糖V,甘露醇V;未形成类淀粉化合物;在葡萄糖浓度为50%时菌体未生长;可以分解尿素.
2.4 26SrDNAD1/D2区域序列分析PCR获得了菌株cmq6-8的26SrDNAD1/D2区域基因的部分片断,利用BLAST软件将该序列与GenBank中收录的DNA序列进行比对,并与相关菌种构建进化树(图3).图中显示cmq6-8与解脂耶氏酵母ATCC 18942(AF335986)聚成一支,序列同源性﹥99.00%,表明两者亲缘关系最近.菌株cmq6-8的26SrDNAD1/D2区域序列长度为593 bp,其在Gen-Bank数据库中的登陆号为JQ689945.
3 讨论
在生物合成手性芳香酮的相关研究中,将底物分子中的羰基不对称还原生产光学活性手性醇是一条有效途径,其中研究最为广泛的底物就是羰基两侧分别具有苯基和烷基的物质,因此苯乙酮被视为最理想的模式底物,是检测还原性生物催化剂的立体化学倾向性底物分子[16].本文以苯乙酮诱导底物,从自然界中筛选可以苯乙酮为唯一碳源,且对有机溶剂耐受的微生物,结果获得一株解脂耶氏酵母cmq6-8,其催化产生的产物为R-苯乙醇.解脂耶氏酵母是非常规酵母菌的典型代表,它的最大特点就是底物范围较广,目前常被用于研究油脂废水的生物防治,而利用解脂耶氏酵母进行不对称催化的相关报道较少.在以菌株cmq6-8全细胞为催化剂,不对称还原苯乙酮合成R-苯乙醇的反应中,当底物苯乙酮的质量分数为108 mmol/L时,静息细胞量为0.25 g/mL,添加的辅助底物葡萄糖质量分数为2%,转化体系初始pH值为7,30℃转化48 h时,底物转化率为49.42%,产物R-苯乙醇的对映体过量值为94.81%.下一步将通过发酵条件和转化条件优化等手段进一步提高底物的转化率及产物的对映体过量值,为该方法的工业化提供理论及技术依据.
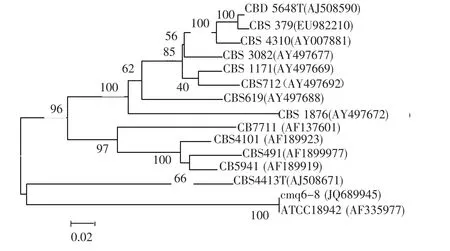
图3 基于26SrDNA D1/D2区域序列和邻接法构建的系统发育树Fig.3 Phylogenetic tree based on 26SrDNA D1/D2 domain sequences constructed with the neighbor-joining method alignment
另外,本实验将薄层色谱TLC引入R-苯乙醇产生菌株的筛选工作中,结果表明TLC检测虽然只是一种定性检测方法,但样品在薄层板上显色的深浅及斑点的大小都与底物的转化率呈正相关.因此,可优先选择硅胶板上直径较大、颜色较深斑点的菌株进行GC色谱检测,这不仅可有效的减少复筛的工作量,而且缩短筛选周期,是一项有益的尝试.
[1]欧志敏,吴坚平,杨立荣,等.微生物法还原羰基化合物生产手性醇的研究-生物法合成手性药物的重要手段[J].山东农业大学学报:自然科学版,2003,34(3):459-462.
[2]张俊芳,杨定乔,龙玉华.铱催化不对称氢化反应的研究进展[J].有机化学,2009,29(6):835-847.
[3]Singh V K.Practical and useful methods for the enantioselective reduction of unsymmetrical ketones[J].Synthesis,1992,7:605-617.
[4]Ruiz D P,Fierrob J L G,Reyes P A.Enantioselective hydrogenation of ethyl pyruvate and 1-phenyl-1,2-propanedione on catalysts prepared by impregnation of colloidal platinum on SiO2[J].J Braz Chem Soc,2010,21(2):262-269.
[5]Soni P,Banerjee U C.Enantioselective reduction of acetophenone and its derivatives with a new yeast isolate Candidatropicalis PBR-2 MTCC 5158[J].Biotechnol J,2006,1(1):80-85.
[6]王丹,张强,李旺,等.酵母静息细胞催化丙酮酸乙酯不对称还原制(S)-乳酸乙酯[J].催化学报,2011,3(6):1035-1039.
[7]王丹,万洁,李维,等.醇腈酶(HNL)cDNA在大肠杆菌中高效表达的初步研究[J].四川师范大学学报:自然科学版,2006,29(3):360-363.
[8]黄晚,郑茂发,黄伟达.利用大肠杆菌工程菌生产2,3-二磷酸甘油酸的研究[J].东北师大学报:自然科学版,2010,42(3):150-155.
[9]娄文勇,郭强,郁惠蕾,等.近平滑假丝酵母细胞催化乙酰基三甲基硅烷不对称还原反应[J].催化学报,2009,30(12):1276-1280.
[10]陈沛然,颜超,张怡.α-氰醇的生物催化合成新进展[J].有机化学,2010,30(5):662-674.
[11]Moore J C,Pollard D J,Kosjek B,et al.Advances in the Enzymatic Reduction of Ketones[J].Acc Chem Res,2007,40(12):1412-1419.
[12]Liu Y Y,Xu J H,Xu Q G,et al.Significant enhancement of lipase enantioselectivity toward(S)-ketoprofen ester at pH2[J].Biotechnology Lett,1999,21:143-146.
[13]Genzel Y,Archelas A,Broxterman Q B,et al.Microbiological transformations part 46:preparation of enantiopure(S)-2-pyridyloxirane via epoxide hydrolase-catalysed kinetic resolution[J].Tetrahedron:Asymmetry,2000,11:3041-3044.
[14]杨忠华,曾嵘,吴高明,等.水-有机溶剂两相体系中面包酵母不对称还原苯乙酮合成手性苯乙醇的研究[J].高校化学工程学报,2009,23(3):450-454.
[15]巴尼特J A,佩恩 R W,亚罗 D.酵母菌的特征与鉴定手册[M].胡瑞卿,译.青岛:青岛海洋大学出版社,1991:364-367.
[16][美]帕特尔R N.立体选择性生物催化[M].方唯硕,译.北京:化学工业出版社,2004:328-329.

