镁合金对骨髓间充质干细胞增殖及成骨分化的影响研究
张 涛,武肖娜,尹庆水,夏 虹,黄华扬,张 余,李 梅,蓝国波
镁合金是新兴可降解金属材料,具有良好的降解性及生物相容性,近年来受到材料学界及医学界的广泛关注。但是作为一种骨科植入材料,镁合金对骨再生的关键细胞——骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的成骨分化过程是否存在影响,目前尚不明确。本研究采用镁合金浸提液培养BMSCs并进行诱导分化,研究其对BMSCs增殖活性及成骨分化性能的初步影响。
1 材料与方法
1.1 主要材料和试剂
DMEM低糖培养基、胎牛血清、2.5 g/L胰酶、PBS缓冲液(美国,Hyclone公司),CCK试剂盒(日本,同仁公司),DMSO(美国,Sigma 公司),Percoll淋巴细胞分离液(密度1.073 g/mL,美国,Gibico公司)。成骨诱导剂:1×10-8mol/L地塞米松、10 mmol/L β-甘油磷酸钠、0.2 mmo1/L L-抗坏血酸(美国,Sigma公司)。PrimeScriptRT reagent Kit Perfect Real Time(逆转录试剂盒)、SYBR Green Premix Ex Taq(荧光定量PCR试剂盒)、DNA上样缓冲液、Trizol裂解液(日本,Takara公司)。
超纯水机(美国,Aquapro公司)、酶联免疫检测仪(美国,Thermo公司)、4000型台式低速离心机(日本,KUBOTA公司)、CO2细胞培养箱(美国,Froma Scientific公司)、PCR仪(日本,TAKARA公司)、DYY-6C型电泳仪(北京六一仪器厂)、LightCycler 480荧光定量PCR仪(德国,Roche公司)、流式细胞仪(美国,BD公司)。
1.2 人BMSCs的分离培养及鉴定
常规无菌条件下从6名捐献骨髓健康志愿者髂后上嵴穿刺抽取骨髓5 mL,再连接已肝素化处理的10 mL注射器针筒,迅速转移至含5 mL Percoll的离心管,采用密度梯度离心法,将界面处一白色薄层(细胞层)吸出,转移至另一离心管中,PBS液洗涤2次,弃去上清液后加入DMEM低糖培养液,轻吹打分散,制成细胞悬液。加入含10%胎牛血清的低糖DMEM培养液2 mL,置于37℃、5%CO2、饱和湿度条件下培养。取第3代细胞用于后续实验。
收集培养细胞,取1×104个细胞用PBS液调整至100 μL,经多聚甲醛固定后用流式细胞仪检测CD34、CD45、CD44、CD73、CD90和CD105的表达情况[1]。
1.3 镁合金浸提液的制备
根据ISO10993[2],按材料表面积/浸提介质为1.25 cm2/mL的比例,向装有镁合金AZ31B(中科院金属所制备提供)的容器中加入含10%胎牛血清的L-DMEM细胞培养液,放于37℃CO2培养箱中孵育,浸泡24 h,提取液置4℃冷藏,24 h之内使用。无涂层镁合金浸提液的pH值较高(8.4~8.8),采用稀盐酸调整其酸碱性能(7.3~7.5),称之为pH-AZ31B组。
同样根据ISO10993[2]材料表面积/浸提介质比例标准,向装有镁合金的容器中分别加入含成骨诱导剂(1×10-8mol/L地塞米松、10 mmol/L β-甘油磷酸钠、0.2 mmo1/L L-抗坏血酸)和10%FBS的L-DMEM培养基的成骨诱导液,置于37℃CO2培养箱中孵育,浸泡24 h,获取具有诱导活性的条件浸提液。
1.4 CCK法检测细胞增殖活性
将人BMSCs用0.25%胰蛋白酶消化,将1×104/L的细胞悬液200 μL接种于96孔板中,培养24 h后将培养液分别换为2组浸提液,对照组加入L-DMEM细胞培养液。每2 d更换1次,分别培养1、3、5、7 d后弃浸提液,PBS清洗后加入CCK-820μL,同样条件下继续培养2 h,用酶联免疫检测仪测定450 nm处的吸光度(optical density,OD)值。按公式计算相对增殖率:相对增殖率=(试验组OD值/对照组OD值)×100%,据此评价材料的细胞毒性分级[2]。
1.5 定量PCR检测
将培养至对数生长期的细胞消化,调整细胞浓度至1×105/L,每孔2 mL种植于6孔板中,每组3个复孔,待细胞贴壁后,对照组更换培养液为含成骨诱导剂(1×10-8mol/L地塞米松、10 mmol/L β-甘油磷酸钠、0.2 mmo1/L L-抗坏血酸)和10%FBS L-DMEM培养基的成骨诱导液,实验组更换为条件培养液进行培养。每2 d换液一次,培养至6、12 d时收集细胞。每孔加入1 mL Trizol裂解液裂解细胞,使用Trizol试剂提取细胞总RNA,合成cDNA,设置内参基因(β-actin基因),进行定量PCR检测。于成骨分化诱导后6、12 d检测各组ALP、COLⅠ和OPN基因的表达情况。
1.6 统计学分析
应用SPSS 17.0软件进行统计学分析,所有数据采用均数±标准差(±s)表示。各组间数据采用析因设计方差分析,多重比较应用LSD法,方差不齐时采用Dunnetts T3比较。P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs鉴定
流式细胞仪检测结果提示CD34(—)、CD45(—)、CD44(+)、CD73(+)、CD90(+)、CD105(+)。
2.2 BMSCs细胞增殖活性
如图1所示,AZ31B组细胞增殖能力显著低于对照组(P<0.05),pH-AZ31B组细胞增殖能力与对照组无明显差异(P>0.05)。
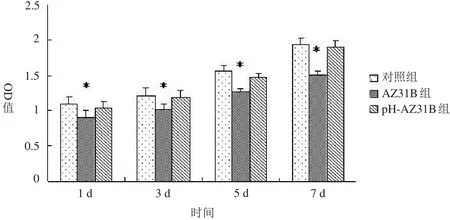
图1 骨髓间充质干细胞增殖活性
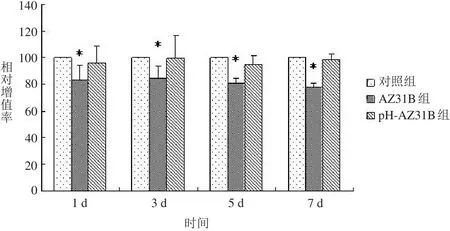
图2 骨髓间充质干细胞相对增殖率
如图2所示,AZ31B组相对增殖率在培养7 d时<80%,说明镁合金有一定毒性,毒性评级为2级[2];pH-AZ31B组细胞增殖活力在4个时间点均>80%,毒性分级为1级[2]。AZ31B组细胞增殖率显著低于对照组,两组比较,差异有统计学意义(P<0.05);pH-AZ31B组细胞增殖率与对照组比较,差异无统计学意义(P>0.05)。
2.3 定量PCR检测各基因表达量
2.3.1 COLⅠ基因表达情况 如图3所示,随着培养时间的延长,两组COLⅠ基因表达逐渐增加;与BMSCs共培养6、12 d,AZ31B组COLⅠ基因表达量与对照组比较,差异无统计学意义(P>0.05)。
2.3.2 ALP基因 如图4所示,与BMSCs共培养6、12 d,pH-AZ31B组ALP表达量与对照组比较,差异无统计学差异(P>0.05);但未调整pH值的AZ31组ALP表达明显低于对照组和pH-AZ31B组(P<0.05)。结果提示pH值可能是镁合金影响ALP基因表达的因素之一。
2.3.3 OPN基因 如图5所示,与BMSCs共培养6、12 d,pH-AZ31B组OPN基因表达量与对照组比较,差异无统计学意义(P>0.05);但未调整pH值的AZ31组OPN表达明显高于对照组和pH-AZ31B组(P<0.05)。结果提示pH值可能是镁合金影响OPN基因表达的因素之一。
3 讨论
3.1 BMSCs的鉴定
骨髓中的BMSCs含量很少,实际应用时需要进行分离纯化和体外扩增。目前用于分离BMSCs的方法主要有全骨髓贴壁法、密度梯度离心法、流式细胞仪法和免疫磁珠法等,其中较为常用的是全骨髓贴壁法和密度梯度离心法。本研究采用密度梯度离心法进行BMSCs的分离,然后行细胞培养,最终经过鉴定来明确细胞的类型。
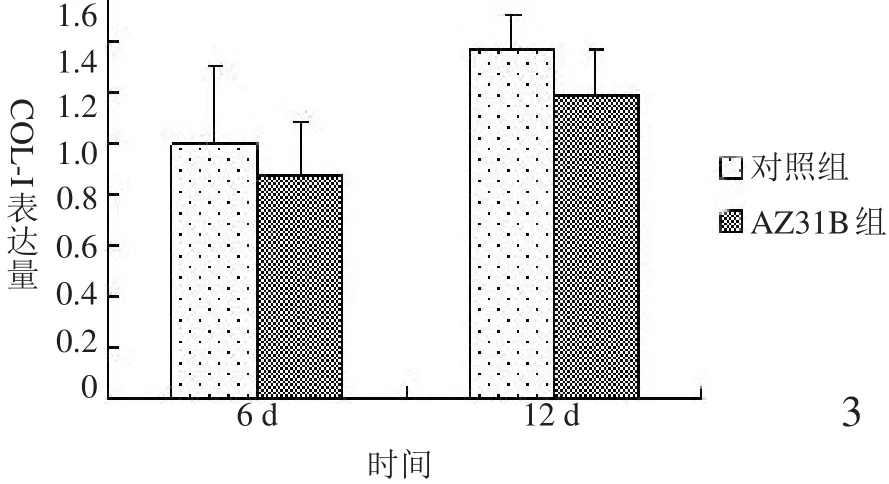
图3 COLⅠ基因表达情况
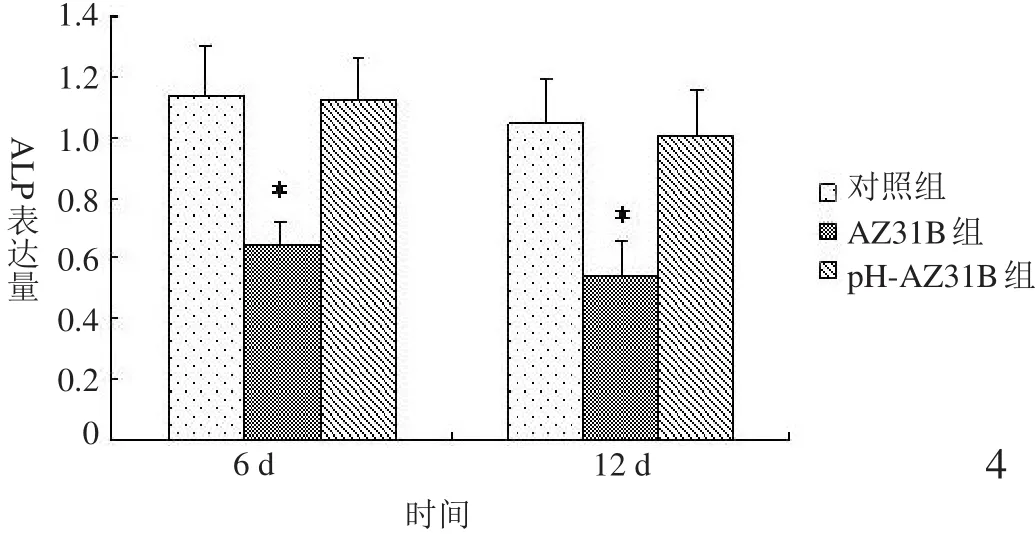
图4 ALP基因表达情况
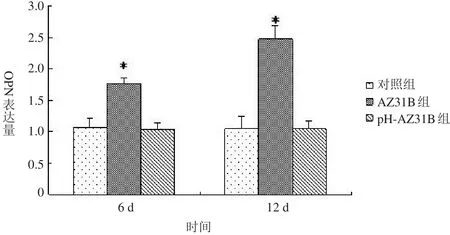
图5 OPN基因表达情况
常用的鉴定方法主要包括细胞形态鉴定、多向诱导分化鉴定、干细胞表面标记物鉴定等,其中表面标记物鉴定具有非专一性和种属特异性,临床应用较为广泛。MSCs可以表达多种细胞的表面标志,以及多种细胞因子、黏附分子和生长因子的受体[3]。人MSCs与造血干细胞共同存在于骨髓中,但MSCs不表达典型造血细胞表面抗原,如造血干细胞标志抗原CD34、白细胞标志抗原CD45 等[4],仅 表 达 CD29、CD44、CD90、CD105、CD166等基质细胞和间质细胞的特异性表面标志[5],还有文献报道,CD105+、CD73+、CD90+和CD45-、CD34-、CD14-这一细胞表型的细胞可提示为MSCs[6]。
本实验中CD34表达量极小,提示不表达造血细胞的表面标志;CD45是泛白细胞标志物,又称白细胞共同抗原,其在MSCs表达较低,且在人工培养下很快失去阳性表达[6],本实验第3代MSCs显示CD45为阴性,与文献报道一致。CD44为一种黏附分子,是骨桥蛋白和透明质酸的受体,在骨髓组成中起重要作用,本实验CD44在MSCs表达呈强阳性,也证实其表型特异性[7];CD105又称转化生长因子-β受体,是构成细胞膜整体所必需的蛋白质;CD73存在于淋巴细胞B细胞亚群和T细胞亚群、滤泡树突细胞、上皮细胞等,可能是淋巴细胞的成熟标志;CD90同时表达于脑和淋巴组织。本实验此4种抗原均呈强阳性表达,具有一定程度的特异性,证实所获取BMSCs纯度较高。
3.2 镁合金对BMSCs增殖的影响
作为具有成骨作用的主要细胞之一,BMSCs主要应用于成骨分化及评估材料的成骨性能[8-9]。镁合金是近年来受到广泛关注的一种新型金属材料,对其生物相容性的评估目前主要采用成纤维细胞。随着研究的逐步深入,学者们发现镁合金可用作骨科植入材料及心脑血管支架材料,因此开始采用成骨细胞及内皮细胞进行生物相容性评价。但镁合金对BMSCs生物学行为是否造成影响,目前相关报道不多。有学者采用BMSCs研究镁合金表面的黏附性能[10],Zhang等[11]应用BMSCs进行镁合金的细胞毒性研究,结果显示镁合金浸提液对BMSCs具有细胞毒性作用,但经过微弧氧化表面改性后,其生物相容性能改善明显。上海交通大学的Yang等[12]采用人BMSCs进行3种镁合金材料的生物学性能研究,结果提示3种镁合金均存在部分细胞毒性,但对其浸提液进行pH值调整后,即表现出良好的增殖活性。
本研究镁合金细胞增殖实验结果与文献报道相似[11-12],共培养7 d时存在2级细胞毒性,结合文献及前期研究结果,我们设置调整pH值组,结果发现调整pH值的镁合金浸提液细胞毒性为1级,具有良好的生物相容性。
3.3 镁合金对BMSCs成骨分化的影响
基因表达检测结果提示,镁合金组ALP基因表达量显著降低,OPN基因表达量显著增高;但消除浸提液酸碱性影响后的调整pH值浸提液组ALP和OPN基因表达量与对照组无显著差异,提示浸提液的酸碱性能可能是影响成骨分化基因表达的重要因素。至于镁合金对其他成骨分化基因及成骨作用是否造成影响,还有待于进一步深入的研究。
综上所述,BMSCs在镁合金浸提液中具有较好的增殖活性,细胞毒性为2级;调整pH值后的镁合金浸提液具有良好的生物相容性。提示镁合金对于BMSCs成骨分化过程无不良影响,其产生的部分改变可能是镁合金浸提液pH值影响所致。
[1]Fang B,WanYZ,Tang TT,etal.Proliferation and osteoblastic differentiation of human bone marrow stromal cells on hydroxyapatite/bacterialcellulose nanocomposite scaffolds[J].Tissue Eng Part A,2009,15(5):1091-1098.
[2]由少华,王听,黄经春,等.GB-T 16886.5-2003医疗器械生物学评价:第5部分体外细胞毒性试验.
[3]Delorme B,Chateauvieux S,Charbord P.The concept of mesenchymal stem cells[J].Regen Med,2006,1(4):497-509.
[4]Baddoo M,Hill K,Wilkinson R,et al.Characterization of mesenchymal stem cells isolated from murine bone marrow by negative selection [J].J Cell Biochem,2003,89(6):1235-1249.
[5]Tondreau T,Lagneaux L,Dejeneffe M,et al.Isolation of BM mesenchymal stem cells by plastic adhesion or negative selection:phenotype,proliferation kinetics and differentiation potential[J].Cytotherapy,2004,6(4):372-379.
[6]Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells:the International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8(4):315-317.
[7]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potentialofadulthuman mesenchymalstem cells[J].Science,1999,284(5411):143-147.
[8]Sun H,Wu C,Dai K,et al.Proliferation and osteoblastic differentiation of human bone marrow-derived stromal cells on akermanite-bioactive ceramics[J].Biomaterials,2006,27(33):5651-5657.
[9]Huang Y,Jin X,Zhang X,et al.In vitro and in vivo evaluation of akermanite bioceramics for bone regeneration[J].Biomaterials,2009,30(28):5041-5048.
[10]Johnson I,Perchy D,Liu H.In vitro evaluation of the surface effects on magnesium-yttrium alloy degradation and mesenchymal stem cell adhesion[J].J Biomed Mater Res A,2012,100(2):477-485.
[11]Zhang BP,Qiu H,Wang DW,et al.Improved blood compatibility of Mg-1.0Zn-1.0Ca alloy by micro-arc oxidation[J].J Biomed Mater Res A,2011,99(2):166-172.
[12]Yang C,Yuan G,Zhang J,et al.Effects of magnesium alloys extracts on adult human bone marrow-derived stromal cell viability and osteogenic differentiation[J].Biomed Mater,2010,5(4):045005.

