兔模型钛基纳米棒成骨生物学性能的初步实验研究
林 曦,阮 征,何 鹏,姚子龙,张 余,尹庆水
兔模型钛基纳米棒成骨生物学性能的初步实验研究
林 曦,阮 征,何 鹏,姚子龙,张 余,尹庆水
目的初步分析纳米表面修饰的钛棒与兔模型骨界面的愈合情况,探讨钛基纳米棒的成骨生物学性能。方法场发射扫描电镜(FESEM)观察纳米钛棒的表面形态,能量分散谱(EDS)分析样品表面的元素组成。在新西兰大白兔左右侧胫骨近端随机植入钛棒和纳米钛棒2种材料,分别于术后4、12周取材后进行Micro-CT影像学评估和力学测试,对比分析2种材料骨-材料界面结合强度及破坏载荷的差异。结果FESEM证实纳米棒结构(100nm Ti),EDS分析显示纳米钛棒表面由100%Ti元素组成。材料植入区域未见组织坏死、化脓,植入材料移位、脱落等现象。Micro-CT影像学结果提示,100 nm Ti植入4、12周后骨-材料界面结合强度均较Ti组优异;生物力学测试结果表明,材料植入4、12周100nm Ti表面的破坏载荷均明显高于Ti组,两组比较,差异有统计学意义(P<0.05)。结论100 nm Ti可提高兔模型骨-材料界面的结合强度,促进骨愈合率。
纳米结构;钛;骨愈合;生物力学;兔
钛(Ti)及钛合金具有耐磨性好、抗腐蚀性强、力学性能和生物相容性好等特点,是一种理想的关节植入材料[1]。但作为生物惰性材料,钛金属生物活性差,缺乏骨诱导作用,假体周围可能形成纤维组织包裹,引起骨溶解[2-3],进而导致假体松动。人们试图通过假体表面设计,赋予钛及钛合金生物活性,达到促进骨生长、提高骨-材料界面强度和骨融合率、延长假体寿命的目的。通过前期细胞学研究,我们发现Ti表面进行纳米棒结构修饰后体外生物相容性良好,其中100 nm Ti表面具有促进间充质干细胞(mesenchymal stem cells,MSCs)早期黏附、增殖、成骨分化和矿化等作用[4],但其植入动物体后的生物相容性及材料-骨界面结合程度如何,目前尚不明确。本研究于新西兰大白兔胫骨近端植入具有100 nm Ti表面的钛棒,并与传统钛棒进行对比,分析其在Micro-CT影像学评估和力学测试结果等方面的差异,初步了解纳米表面修饰钛棒与骨界面的愈合情况及其成骨生物学性能。
1 材料和方法
1.1 植入材料和表征
材料规格:圆柱形钛棒(Ti,光滑表面,3 mm ×8 mm),圆柱形纳米钛棒(Nano Ti,纳米棒表面,3 mm×8 mm)。对纳米钛棒予以表面喷金后。采用Nova Nano SEM 430场发射扫描电子显微镜(field emission scanning electron microscopy,FESEM,德国,ZEISS公司)观察2种材料的表面微细形态,并采用EMAX能量分散谱(energy dispersive spectroscopy,EDS)仪(日本,HORIBA公司)分析样品表面元素组成。
1.2 实验动物
健康新西兰兔18只[广东省实验动物中心,动物质量合格证号(44007600000252)]。体重2.3~3.0 kg,雌雄各半。
1.3 手术步骤
3%戊巴比妥(50 mg/kg)耳缘静脉麻醉,仰卧位固定动物,2%利多卡因于兔胫骨近端局部麻醉(图1A)。手术区域剃毛、碘酒消毒,严格按照无菌技术操作,从皮肤、筋膜、肌肉、骨膜逐层进入胫骨近端内侧。植入位置用直径3 mm的钻头钻孔(图1B),盐水冲洗降温。两组圆柱形材料(Ti和100 nm Ti)随机植入兔左右下肢,每只动物均植入2个3 mm×8 mm圆柱体材料(图1C),左右侧各一,材料仅穿透单侧皮质。材料置入固定后逐层缝合。
1.4 术后处理
术后口服青霉素40 000U/d,共3 d。分别于术后4、12周耳静脉空气注入处死。
1.5 Micro-CT检测
术后4、12周各取4只新西兰兔,处死后去除软组织,清洗取出的股骨,将其切成只余有植入物的小段,于内固定系统中干燥存放,以植入材料周围的松质骨区域,沿种植体轴向半径1.5 mm的圆圈为兴趣区域进行Micro-CT断层扫描(扫描模式:Fast模式;像素:40×40 mm;层厚:80 mm)。
1.6 材料-骨界面结合强度的生物力学测试
术后4、12周各取5只新西兰兔,处死后立即取下胫骨(图1D),用磨钻暴露骨髓腔另一端,使用BOSE3520生物力学测试机(美国,BOSE公司)进行推出实验。距离植入材料上下各1 cm处将胫骨垂直截成小段,修理好的组织块置入大小合适的磨具中,将测试机器压力轴(采用直径同植入材料一致的3 mm金属棒)对准材料中心,以0.5 mm/min的速度垂直加力,记录最大推出载荷,以此测试材料-骨界面的结合强度。
1.7 统计学分析
应用SPSS 13.0统计软件进行分析,计量资料以均数±标准差(x-±s)表示,两组比较采用两独立样本t检验和配对t检验,P<0.05为差异有统计学意义。

图1 手术过程图片 1A局部麻醉 1B暴露胫骨干骺端并钻孔 1C材料植入 1D术后4周取出胫骨
2 结果
2.1 材料的表征
图2为钛基纳米棒的FESEM形态,可观察到钛表面制备出纳米突起,即“纳米棒”结构;采用EDS分析100 nm Ti表面和Ti表面的元素组成及元素比例,结果提示钛纳米棒表面组成相同,均为100%Ti元素(图3)。
2.2 术后一般情况
材料植入新西兰兔胫骨后,所有动物术后活动及进食正常,手术切口愈合良好,未出现伤口感染及炎症、毒性反应。术后4、12周取材,材料植入区域未见组织坏死、化脓等情况,植入材料与骨界面之间结合良好,未见植入材料脱出、松动等现象。
2.3 Micro-CT断层扫描
图4显示Ti和100 nm Ti材料植入术后4、12周Micro-CT横断图像。植入动物体内4周,Ti组材料与骨界面之间存在可见间隙(图4A),12周骨-材料界面结合程度较术后4周明显改善(图4B);100 nm Ti组植入4周材料与骨界面结合强度(图5A)优于Ti组,12周骨-材料界面结合紧密,未见间隙(图5B)。
2.5 生物力学测试
表1为Ti和100 nm Ti材料植入新西兰兔胫骨4、12周的生物力学测试结果。植入4周时,100 nm Ti组材料的破坏载荷明显高于Ti组,两组比较,差异有统计学意义(P<0.05),提示100 nm Ti表面更利于材料-骨界面的骨整合。植入12周,两组材料的破坏载荷均较4周明显增加(P<0.05),但100 nm Ti组仍明显高于Ti组(P<0.05)。
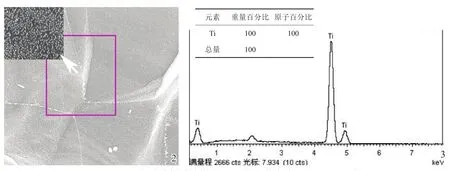
图2 100nm Ti表面场发射扫描电镜图片 图3能量分散谱分析100 nm Ti表面元素

图4 Ti材料植入体内术后Micro CT断层扫描 4A术后4周 4B术后12周 图5 100 nm Ti材料植入体内术后Micro CT断层扫描 5A术后4周 5B术后12周
表1 Ti、100 nm Ti材料植入兔体内4、12周材料-骨界面的破坏载荷(±s,N,n=5)
组别Ti 100 nm Ti t值P值4周29.7±1.9 48.8±2.6-13.286 0.000 12周71.3±4.1 108.9±6.4-11.026 0.000 t值-20.710-19.341 P值0.000 0.000 ----
3 讨论
材料表面的拓扑结构或理化特性与细胞黏附关系密切,骨组织中未成熟骨和成熟骨的平均无机颗粒分别为10~50 nm和20~50 nm(直径2~5 nm)[5],Ⅰ型胶原、细胞外基质蛋白和骨碎屑等也在纳米级大小[5-6],因此可以推断,纳米级别的材料表面可能会更好地被骨细胞、组织所识别,起到促进细胞黏附、增殖和分化的作用,有望成为一种理想的植入材料。
3.1 Micro-CT观察材料-骨的结合程度
材料植入动物体后其表面与骨面之间不可避免地存在一定间隙,这个间隙愈合的过程也就是材料-骨界面愈合的过程,只有骨组织与材料之间的界面发生直接而又牢固的接触,才被视为成功的骨结合[7-9]。作为一种新型的分子影像学技术,Micro-CT适于观测材料周围骨组织的骨体积、骨小梁厚度、骨面积、骨连接密度、骨小梁分离度等[10],Van Oossterwyck等[11]对种植体植入羊体内的实验结果表明,Micro-CT与组织学分析相似;但Butz等[12]却认为,Micro-CT对骨组织相关参数的测量可能受邻近种植体金属伪影的影响。本研究在扫描过程中同样发现钛金属有少量伪影,考虑到伪影对材料周围骨体积、骨小梁厚度等指标准确性的影响,未对这些参数进行分析,而是选择直接观察横断面的材料-骨结合度。本研究发现,100 nm Ti材料植入后4周材料与骨界面结合较Ti好;12周后骨-材料界面结合紧密,未见缝隙。这与生物力学测试的结果是相互吻合的。
3.2 生物力学测试材料-骨界面的破坏载荷
与组织形态分析比较,生物力学测试能够更直观敏感地判断植入材料的稳定性,有效评估材料的力学性能[13-14]。对于叶状或圆柱状植入材料,通常采用拔除实验或推出实验[15]。本推出实验研究结果表明,Ti和100 nm Ti材料植入兔体内4、12周,100 nm Ti组破坏载荷均明显高于Ti组,提示纳米表面可能使骨长入微孔,形成微锁[16],促进材料-骨界面的骨整合,起到加速骨生长、提高骨融合率、加强骨-材料界面强度的作用。研究还显示,植入12周后两组材料的破坏载荷均较4周明显提升,原因可能是由于植入材料4周时处于材料-骨界面愈合早期,炎症、纤维结缔组织等[17]导致骨-材料界面结合力不强;植入12周后材料-骨界面有新骨形成,破坏载荷较4周时大大提高。
传统的抛光钛表面缺乏生物活性,容易与骨界面形成纤维组织,导致假体松动。Xia等[18]对纳米和微米结构表面进行体内外实验研究,结果提示纳米表面碱性磷酸酶活性更强;纳米表面培养成骨细胞后Cbfal、骨钙素骨保护素及Ⅰ型胶原表达明显上升;纳米钛还可促进其表面细胞的生长;此外,由于和颗粒之间的结合点增多[19],因此骨更易长入纳米表面,材料-骨界面的骨整合更为紧密,骨-材料界面的强度进一步提高。动物实验结果还表明,将钛螺钉修饰纳米表面植入鼠模型,骨融合较普通钛螺钉更好,皮肤感染概率降低[20];而经过表面修饰(如二氧化钛喷吵处理[21])的纳米表面植入体内后骨融合程度更高,骨形成更多。生物安全性方面,Popat等[22]将纳米管材料植入大鼠皮下4周后进行组织分析,结果证实纳米管表面具有良好的生物相容性;本研究中无一例发生局部红肿、渗出、切口感染,无毒性反应发生。
[1]Durmus NG,Webster TJ.Nanostructured titanium:the ideal materialforimproving orthopedic implantefficacy?[J]. Nanomedicine,2012,7(6):791-793.
[2]Dowson D.New joints for the Millennium:wear control in total replacement hip joints[J].Proc Inst Mech Eng,2001, 215(4):325-358.
[3] Kaplan FS,Hayes WC,Keaveny TM,et al.Form and function of bone[G]//Simon SP.Orthopedic Basic Science. Columbus:American Academy of Orthopaedic Surgery,1994: 127-184.
[4]Lin X,Zhong ML,Li M,Yin QS,et al.Effects of different lengths of Ti nanorods topography on mesenchymal stem cell growth and proliferation[J].J Nanosci Nanotech(已录用 doi: 10.1166/jnn.2014.9275).
[5]Kaplan FS,Hayes WC,Keaveny TM,et al.Biomaterials[G]// Simon SP.Orthopedic Basic Science.Columbus:American Academy of Orthopedic Surgeons,1994:460-478.
[6]Ruppel ME,Miller LM,Burr DB.The effect of the microscopic and nanoscale structure on bone fragility [J]. Osteoporos Int,2008,19(9):1251-1265.
[7]Brånemark PI.Osseointegration and its experimental background[J].J Prosthet Dent,1983,50(3):399-410.
[8]Osborn JF,Newesely H.Dynamic aspects of implant-bone interface: dental implants: materials and systems [M]. Munich:Verlag,1980,111-123.
[9] Franchi M,Orsini E,Trire A,et al.Osteogenesis and morphology of the peri-implant bone facing dental implants [J].Sci World J,2004.4:1083-1095.
[10]Rebaudi A,KollerB,Laib A,etal.Microcomputed tomographic analysis of the peri-implant bone[J].Int J Periodontics Restorative Dent,2004,24(4):316-325.
[11]Van Oossterwyck H,Duyck J,Vander Sloten J,et al.Use of microfocus computerized tomography as a new technique for characterizing bone tissue around oral implants[J].J Oral Implantol,2000,26(1):5-12.
[12]Butz F,Ogawa T,Chang TL,et al.Three-dimensional bone-implantintegration profiling using micro-computed tomography[J].Int J Oral Maxillofac Implants,2006,21(5): 687-695.
[13]Rüger M,Gensior TJ,Herren C,et al.The removal of Al2O3 particles from grit-blasted titanium implant surfaces:effects on biocompatibility,osseointegration and interface strength in vivo[J].Acta Biomater,2010,6(7):2852-2861.
[14]Castellani C,Lindtner RA,Hausbrandt P,et al.Bone-implant interface strength and osseointegration:biodegradable magnesium alloy versus standard titanium control[J]. Acta Biomater,2011,7(1):432-440.
[15]Beer A,Gahleitner A,Holm A,et al.Correlation of insertion torques with bone mineral density from dental quantitative CT in the mandible[J].Clin Oral Implants Res,2003,14(5): 616-620.
[16]Otsuki B,Takemoto M,Fujibayashi S,et al.Pore throat size and connectivity determine bone and tissue ingrowth into porous implants:three-dimensional micro-CT based structural analyses of porous bioactive titanium implants [J]. Biomaterials,2006,27(35):5892-5900.
[17]Natali AN,Carniel EL,Pavan PG.Investigation of viscoelastoplastic response ofbone tissue in oral implants press fit process[J].J Biomed Mater Res B Appl Biomater,2009, 91(2):868-875.
[18]Xia L,Feng B,Wang P,et al.In vitro and in vivo studies of surface-structured implants for bone formation [J].Int J Nanomedicine,2012,7:4873-4881.
[19]Webster TJ,Ejiofor JU.Increased osteoblast adhesion on nanophase metals:Ti,Ti6Al4,and CoCrMo[J].Biomaterials, 2004,25(19):4731-4739.
[20]Puckett SD,Lee PP,Ciombor DM,et al.Nanotextured titanium surfacges for enhancing skin growth on transcutaneous osseointegrated devices[J].Acta Biomater,2010,6(6):2352-2362.
[21]Bjursten LM,Rasmusson L,Oh S,et al.Titanium dioxide nanotubes enhance bone bonding in vivo[J].J Biomed Mater Res A,2010,92(3):1218-1224.
[22]Popat KC,Leoni L,Grimes CA,et al.Influence of engineered titania nanotubularsurfaceson bone cells[J]. Biomaterials,2007,28(21):3188-3197.
Preliminary experimental study on osteogenesis biological effects of the Ti nanorod in rabbit models
LIN Xi,RUAN Zheng,HE Peng,YAO Zilong,ZHANG Yu,YIN Qingshui.Hospital of Orthopaedics, Guangzhou General Hospital of Guangzhou Military Command,Guangzhou,Guangdong 510010,China
YIN Qingshui,E-mail:gz_yqs@126.com
ObjectiveTo analyze the osseointegration at Ti nanorod material-bone interface,and to explore osteogenesis biological effect of nanostructure Ti rod.Methods Field emission scanning electron microscopy (FESEM)was employed to observe the morphology of Ti nanorod surface,energy dispersive spectroscopy(EDS) was applied to analyze the elements of the materials.Ti rod and Ti nanorod samples were randomly implanted into either side of tibia of New Zealand white rabbits.After 4,12 weeks,Micro-CT and push-out test were applied to compare the differences of osseointegration at the material-tibia interface as well as damage load between 2 materials.Results FESEM showed 100 nm Ti surface were acquired and EDS showed nanorod were composed of Ti element only.No tissue necrosis or wound infection were observed and no loosening or pull-outof implants had happened.Four weeks and 12 weeks after implanting,Micro-CT showed osseointegration density in 100 nm Ti group was better than that in Ti group;damage load in 100 nm Ti group was also higher than the result in Ti group,there was statistical difference between two groups(P<0.05).Conclusion 100 nm Ti could improve the osseointegration density at the bone-material interface,and subsequently enhance bone healing rate in rabbit models.
Nanostructures;Titanium;Bone healing;Biomechanics;Rabbits
R356.1,R318.1
A
1674-666X(2014)02-0105-06
2014-01-05;
2014-02-01)
(本文编辑:白朝晖)
10.3969/j.issn.1674-666X.2014.02.008
国家重点基础研究发展计划(973计划)课题子项目(2012CB619106)
510010广州军区广州总医院骨科医院
尹庆水,E-mail:gz_yqs@126.com

