常压低氧耐力训练对肥胖大鼠Visfatin水平的影响
徐建方,冯连世,张 漓,路瑛丽,王雪冰
常压低氧耐力训练对肥胖大鼠Visfatin水平的影响
徐建方,冯连世,张 漓,路瑛丽,王雪冰
目的:通过建立肥胖大鼠低氧训练模型,观察血清Visfatin含量和脂肪组织Visfatin基因表达水平,探讨低氧训练对肥胖大鼠Visfatin的影响。方法:单纯性肥胖大鼠建模成功后,筛选130只随机分为13组:对照0周组,低氧安静1、2、3、4周组,常氧训练1、2、3、4周组,低氧训练1、2、3、4周组。低氧环境模拟海拔3 500 m(氧浓度13.6%);常氧和低氧训练组分别以25 m/min、20 m/min进行跑台训练,各训练组持续运动1 h/d、6 d/w、1~4周。采用ELISA法测试血清Visfatin含量,荧光定量PCR法测试附睾脂肪Visfain mRNA相对表达量。结果:1)肥胖大鼠0周时血清Visfatin含量(50.095±9.092 μg/L)显著高于其他各周(P<0.01),常氧训练第1、2、3、4周时分别为17.856±3.596 μg/L、27.002±10.475 μg/L、26.866±7.107 μg/L、36.385±5.455 μg/L,低氧安静组第1、2、3、4周时分别为22.382±6.356 μg/L、24.662±6.654 μg/L、25.764±9.382 μg/L、34.504±6.946 μg/L,低氧训练组第1、2、3、4周时分别为17.227±5.106 μg/L、18.360±5.181 μg/L、15.065±4.466 μg/L、16.689±7.728 μg/L;常氧训练和低氧安静组,其变化趋势一致,第1周显著性下降(P<0.01),随后回升;而低氧训练组一直保持在低水平,后3周均显著低于其他两组(P<0.01)。2)肥胖大鼠0周时脂肪组织Visfatin mRNA相对表达量为0.0658±0.0263,常氧训练组第1、2、3、4周时分别为0.0569±0.0237、0.0499±0.0130、0.0653±0.0288、0.1071±0.0437,第4周时显著高于第1、2、3周时水平(P<0.01);低氧安静组第1、2、3、4周时分别为0.0883±0.0442、0.0990±0.0570、0.0507±0.0178、0.0883±0.0312;低氧训练组第1、2、3、4周时则表现出下降的趋势,分别为0.1102±0.0368、0.0845±0.0238、0.0679±0.0245、0.0668±0.0298,低氧训练第4周时其相对表达量低于常氧训练和低氧安静组,与常氧训练组比较差异显著(P<0.05)。结论:1)低氧训练控制肥胖大鼠血清Visfatin水平较常氧训练和低氧安静更为有效;2)与常氧训练和低氧安静比较,低氧训练下调脂肪组织Visfatin基因表达作用更明显。
低氧训练;肥胖;内脂素;鼠;动物实验
随着对代谢综合征研究的逐步深入,越来越多的研究表明,脂肪组织不仅是机体重要的能量储存库,更是机体中最大的内分泌器官,合成和分泌Leptin、Resistin、TNF-α、IL-6、Adiponectin和Visfatin等重要的脂肪细胞因子参与机体的糖代谢、脂代谢和炎症反应的调节,在糖尿病、代谢综合征、心血管疾病的发生、发展过程中发挥关键性作用。其中,Visfatin是近几年新发现的一个主要由内脏脂肪细胞分泌的脂肪因子,发挥类胰岛素生物效应,具有降低血糖,促进脂肪细胞分化、生长、蓄积,抑制肝糖原的释放和促进血管平滑肌细胞成熟等作用,因此,被认为是与肥胖和糖尿病密切相关的重要因子,也是当前代谢综合征研究的有关热点之一[6,7,10]。低氧环境对机体的影响是医学、生物学的研究热点,特别是随着HIF-1a的深入研究,研究人员也试图去揭示低氧对Visfatin的影响。Katsumori等[15]发现,3T3-L1脂肪细胞在1%O2浓度的低氧环境下培养6 h和12 h后,Visfatin mRNA表达水平显著上调1.3倍,且与VEGF mRNA变化同步。他们同时指出,低氧环境下,HIF-1a通路在上调Visfatin mRNA表达时扮演重要角色。BAEB等[4]也报道,低氧能显著诱导MCF7乳腺癌细胞中Visfatin mRNA表达、上调其蛋白水平,并认为,Visfatin基因受HIF-1a的调控,是HIF-1a直接调控的目的基因之一。因此,Visfatin被认为在低氧组只中时激活细胞的糖摄入,以维持低氧环境下所需的ATP水平;激活Akt诱导血管的生成,以适应低氧环境[15]。
随着对Visfatin认识的逐步深入,运动对肥胖和糖尿病患者Visfatin影响的研究也逐步展开,詹晓梅等[2]检索2005年以来的相关文献,采用Meta分析法观察运动干预肥胖与2型糖尿病患者Visfatin水平的效果时,指出肥胖及2型糖尿病患者Visfatin水平均高于健康人群,而且,长期中等强度的有氧运动对肥胖和2型糖尿病患者Visfatin水平具有积极的调节作用。Haus等[12]对16名志愿者(年龄=65±1岁,BMI=33.4±1.5 kg/m2)进行为期12周85%最大心率强度的训练(5 d/w,60 min/d),结果发现,除有氧能力提高、体重及脂肪下降外,血浆Visfatin水平由16.9±2.2 ng/ml显著下降到14.5±1.8 ng/ml,同时,其变化与胰岛素水平显著正相关(r=0.56)。他们认为,运动引起血浆Visfatin下降可能是由于体重下降和体成分改变所导致[12]。虽然低氧减控体重方面的研究甚多,但低氧环境训练在影响体成分的同时如何改善机体的Visfatin水平目前国内外相关研究甚少。因此,本研究通过建立单纯营养性肥胖大鼠模型,观察低氧安静、常氧训练和低氧训练3种条件下肥胖大鼠血清Visfatin含量和脂肪组织Visfatin mRNA表达的变化,探讨常压低氧耐力训练对机体Visfatin水平的影响,以期从Visfatin角度分析低氧减肥的效果。
1 材料和方法
1.1 实验对象
出生21天的离乳雄性SD大鼠,经高脂饲料喂养10周,肥胖模型验证成功后,继续高脂饲料喂养2周,分笼饲养,每笼5只,室温21℃~23℃,湿度40%~60%,自然光照,高脂饲料自由饮食。
1.2 动物分组及训练安排
根据体重、适应性训练情况,130只肥胖大鼠随机分为13组,各组之间体重无显著性差异;分组后的实验动物按表1安排生活和训练。
1.3 取材
对照0周组在分组当天,低氧安静、常氧训练、低氧训练的1、2、3、4周组分别在正式实验开始后的第1、2、3、4周周末取材。对实验大鼠进行称重,按0.3 ml/100 g体重剂量腹腔注射10%水合三氯乙醛溶液麻醉大鼠。腹主动脉取血后,37℃水浴30 min,3 000 rpm离心15 min,吸取血清,待测;分离出肾周脂肪,分装、液氮中保存,待测。
1.4 试剂与仪器
主要试剂:Trizol、oligo dT、RNA酶抑制剂、M-MLV反转录酶(Invitrogen),dNTP(Promega),TaqTM Hot Start Version(TaKaRa),Reference Dye for Quantitative PCR (ROX )(Sigma),Eva Green Dye(Biotium)。
主要仪器:MULTISKAN MK3全自动多功能酶标仪(Thermo,USA)、ABI 7300 Sequence Detection System、Nanodrop ND-1000 Spectrophotometer(Nanodrop technologies)、MINI shaker(MH-1,kylin-Bell Lab Instruments QILINBEIER)。
1.5 测试方法
血清Visfatin含量的测试采用双抗体两步夹心酶联免疫吸附法(ELISA),具体操作过程依说明书进行。脂肪组织Visfatin mRNA相对表达量采用定量荧光PCR测试,测试步骤如下:

表 1 本研究各组大鼠生活及训练安排一览表Table 1 Arrangement of Living and Training(n=10)
1.5.1 总RNA 提取
总RNA 提取参照试剂盒说明书,采用紫外分光光度仪测定RNA 260 nm/280 nm OD 值检验RNA 纯度和进行定量,要求比值在1.8~2.0 之间,并按以下公式计算RNA 含量:RNA 含量(μg/ml)=稀释倍数×OD260值×40。
1.5.2 逆转录
逆转录过程参照试剂盒说明书进行。总反应体系含1 μg 模板(RNA)、2 μl 逆转录10 Buffer、2 μl dNTP 混合物(10 mM)、0.5 μl RNasin Inhibitor、15U AMV 逆转录酶、0.5 μg Oligo(dT)引物、1.0 μl、RNase Inhibitor(MBI),最后加无RNA 酶水至20 μl。
1.5.3 引物设计
genbank 查询mRNA 原序列,选择合适的序列范围,采用primer 5引物设计软件设计适合于SYBR Green Kit 方法的引物,引物长21~24 bp,退火温度58℃~60℃,然后将所选引物用Primer select 5软件进行分析,选取二级结构最小的一对引物作为正式目的基因的扩增引物。引物由上海生物工程有限公司合成。
引物序列:β-actin FW:CCCATCTATGAGGGTTACGC,RV:TTTAATGTCACGC- ACGATTTC,产物长度150 bp;Visfatin FW:AAGTAAAGGCTGTTCCTGAGGGCT,RV:TCTCAATCCAGTTGGTGAGCCAGT,产物长度105 bp;
1.5.4 RQ-PCR 检测
1)RQ-PCR 反应体系的配制(本实验采用20 μl 反应体系):在Real-time PER 管中依次加入cDNA(1 μl)、上游引物(1.2 μl)、下游引物(1.2 μl )和2×定量PCR 优化试剂盒(10 μl),用水补足20 μl;2)设定RQ-PCR 反应条件:50℃ 2 min,95℃ 10 min,95℃ 15s,60℃ 1 min,共40 cycles;3)测CT 值并分析RV熔解曲线;4)每个样本重复3次;5)以β-actin 作为内参,依据CT 比较法进行相对定量分析,△Ct=Ct(目的基因)-Ct(内参基因,△△Ct=△Ct(实验组)-△Ct(对照组),相对表达量=2-△△Ct。
1.6 统计方法
使用统计软件SPSS 16.0对数据进行分析,显著性水平定为α=0.05。将训练方式(常氧训练、低氧安静、低氧训练)和训练时间(第1周、第2周、第3周、第4周)作为组间主因素,分别对肥胖大鼠血清Visfatin含量和脂肪组织Visfatin mRNA相对表达量进行多因素方差分析。
2 研究结果
2.1 肥胖大鼠血清Visfatin含量的变化
0周大鼠血清Visfatin含量为50.095±9.092 μg/L,常氧训练、低氧安静和低氧训练组大鼠Visfatin含量的均值及其变化如表2所示,方差分析结果如表3所示,训练类型的主效应极显著(P<0.01),训练时间的主效应极显著(P<0.01),训练类型与训练时间的交互作用极显著(P<0.01)。

表 2 本研究肥胖大鼠血清Visfatin含量的均值一览表Table 2 Content of Visfatin in Serum(M±SD,μg/L)

表 3 本研究肥胖大鼠血清Visfatin含量的方差分析结果一览表Table 3 Analysis of Variance with Content of Visfatin
由于训练类型与训练时间的交互作用极显著(P<0.01),采用LSD法进行简单效应检验。
对同一训练类型下不同训练时间的大鼠血清Visfatin含量进行多重比较显示:常氧训练组大鼠第1、2、3、4周较0周显著降低,差异极显著(P<0.01);第2、3、4周较第1周则显著升高,差异显著或极显著(P<0.05或P<0.01);第4周较第2、3周显著升高,差异显著(P<0.05);第2、3周之间差异不显著(P>0.05);表明常氧训练组大鼠血清Visfatin含量在第1周出现明显下降,但从第2周开始回升,至第4周显著高于第1、2、3周。低氧安静组大鼠第1、2、3、4周较0周显著降低,差异极显著(P<0.01);第4周较第1、2、3周显著升高,差异显著或极显著(P<0.05或P<0.01);第1、2、3周之间差异不显著(P>0.05);表明低氧安静组大鼠血清Visfatin含量在第1周出现明显下降,随后回升,至第4周明显升高。低氧训练组大鼠第1、2、3、4周较0周显著降低,差异极显著(P<0.01);其余各组间差异不显著(P>0.05);表明低氧训练组大鼠血清Visfatin含量在第1周即出现明显下降后,并低水平保持到训练结束。
对同一训练时间下不同训练类型的大鼠血清Visfatin含量进行多重比较显示:第1周时低氧训练组显著低于低氧安静组(P<0.05),低氧训练组与常氧训练组差异不显著(P>0.05);第2周时低氧训练组显著低于常氧训练组(P<0.05),低于低氧安静组,但差异不显著(P>0.05);第3、4周时低氧训练组显著低于常氧训练组、低氧安静组(P<0.01),且低氧安静组与常氧训练组间差异不显著(P>0.05)。
2.2 肥胖大鼠脂肪组织Visfatin mRNA 相对表达量的变化
0周组大鼠Visfatin mRNA相对表达量的均值为0.0658±0.0263,常氧训练、低氧安静和低氧训练组大鼠Visfatin mRNA相对表达量的均值及其变化如表4所示,方差分析结果如表5所示,训练类型的主效应不显著(P>0.05),训练时间的主效应显著(P<0.05),训练类型与训练时间的交互作用极显著(P<0.01)。
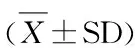
表 4 本研究肥胖大鼠脂肪组织Visfatin mRNA相对表达量的均值一览表Table 4 Relative Expression Quantity of Visfatin mRNA in Adipose Tissue
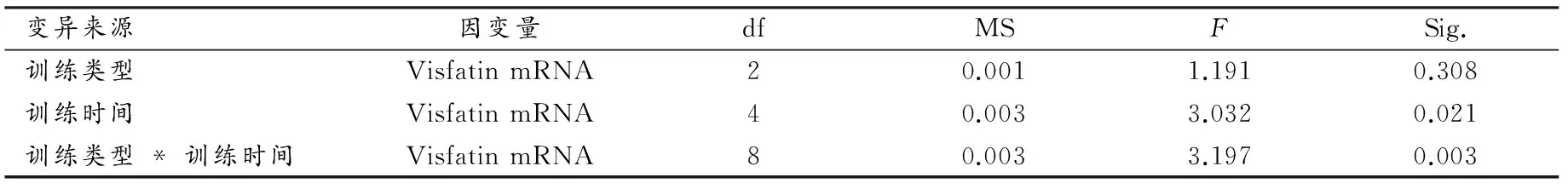
表 5 本研究肥胖大鼠脂肪组织Visfatin mRNA相对表达量的方差分析结果一览表Table 5 Analysis of Variance with Relative Expression Quantity of Visfatin mRNA
由于训练类型与训练时间的交互作用极显著(P<0.01),采用LSD法进行简单效应检验。
对同一训练类型下不同训练时间的大鼠Visfatin mRNA相对表达量进行多重比较显示:常氧训练组大鼠第4周较0、1、2、3周显著升高,差异极显著(P<0.01);第0、1、2、3周之间差异不显著(P>0.05),表明常氧训练组大鼠Visfatin mRNA相对表达量仅在第4周出现明显升高。低氧安静组大鼠第1、2、3、4周与0周比较差异不显著(P>0.05),第3周较第2周降低,差异显著(P<0.05),其余各周之间无显著差异(P>0.05),表明低氧训练组大鼠Visfatin mRNA相对表达量在第3周出现一定程度下降,但第4周时又恢复到第一周水平。低氧训练组大鼠第1周较0周显著升高,差异极显著(P<0.01);第2、3、4周与0周比较差异不显著(P>0.05);第3、4周较第1周降低,差异极显著(P<0.01);其余各周之间无显著差异(P>0.05),表明低氧训练组大鼠Visfatin mRNA相对表达量在第1周显著升高,随后回落到训练前水平。
对同一训练时间下不同训练类型大鼠的Visfatin mRNA相对表达量进行多重比较显示:第1周时低氧训练组显著高于常氧训练组(P<0.05),低氧安静组与常氧训练组、低氧训练组比较差异不显著(P>0.05);第2周时低氧安静组显著高于常氧训练组(P<0.05),低氧训练组与常氧训练组、低氧安静组差异不显著(P>0.05);第3周时低氧训练组、低氧安静组、常氧训练组之间差异不显著(P>0.05);第4周时低氧训练组较常氧训练组显著降低(P<0.05),低氧安静组与常氧训练组、低氧训练组比较差异不显著(P>0.05)。
3 分析与讨论
Visfatin是一种脂源性细胞因子,主要由内脏脂肪细胞合成分泌,它的前身是前β细胞集落增强因子(PBEF)。2005年,Fukuhara等[10]利用差异PCR技术,在比较女性志愿者内脏与皮下脂肪表达差异时,成功分离并鉴定出Visfatin,并指出血浆Visfatin水平与内脏脂肪呈正相关,而与皮下脂肪无关。同时,动物实验表明,小鼠血浆Visfatin水平随小鼠肥胖程度增加而增加、随内脏脂肪组织Visfatin mRNA表达水平升高而增加[11]。其他研究也指出,Visfatin 在其他细胞或组织中也有一定程度的表达,以自分泌和旁分泌的形式,在机体中发挥胰岛素作用,促进脂肪细胞的分化、合成、成熟和蓄积,同时与机体的炎症和免疫应答有关[19]。随着对代谢综合征的深入研究,越来越多的研究人员将目光投到Visfatin这一脂肪因子上,且多数研究者认为,其在肥胖引起的胰岛素抵抗和2型糖尿病过程中发挥着重要作用。但也有研究认为,虽然肥胖患者内脏脂肪组织Visfatin mRNA表达明显升高,但血浆Visfatin水平下降且与内脏脂肪Visfatin mRNA表达无关[5,23]。
3.1 常压低氧耐力训练对肥胖大鼠血清Visfatin含量的影响
在有关身体活动与Visfatin关系的研究中,Floriane等[8]挑选健康男性受试者(BMI=23.4±0.6 k/m2),设置了4种不同程度的身体活动不足,分别为10天禁闭组、1个月停止锻炼组、3个月卧床组和3个月卧床+运动组,结果发现,10天禁闭组和3个月卧床组的血浆Visfatin水平分别上升54.9%和49.7%,而1个月停止训练组和3个月卧床+运动组血浆Visfatin水平无显著变化,这表明短期和长期的身体活动不足均会引起机体血浆Visfatin水平的变化。杨箐岩等[1]研究表明,肥胖机体的血浆Visfatin水平较正常机体显著升高,且与体重、BMI、腰臀比、体脂百分比的改变呈正相关,并指出Visfatin在肥胖和2型糖尿病的发病机制中发挥作用。不同形式的运动可以改善机体的Visfatin水平,特别是对肥胖和糖尿病患者的影响,近两年的相关研究较多。Wayne等[28]对21名非糖尿病女性受试者(年龄:34±2岁,BMI:32.5 ±1.2 kg/m2)进行12周饮食控制并结合适量运动后,发现肥胖组血浆Visfatin浓度由80.2 ±9.3 ng/ml显著下降到38.5 ±3.3 ng/ml,虽然仍高于对照组(22.1 ±0.9 ng/ml),但已经明显改善。同时,Lee等[14]也报道,肥胖女生的血浆Visfatin水平显著高于正常体重女生,而且12周有氧训练后,肥胖女生的血浆Visfatin水平由294.00±124.74 ng/ml下降到185.55±67.30 ng/ml。
本研究发现,常氧训练、低氧安静和低氧训练1周后,肥胖大鼠的血清Visfatin 含量出现非常显著的下降,下降幅度均超过一半,由训练前的50.095±9.092 μg/L分别下降到17.856±3.596 μg/L、22.382±6.356 μg/L和17.227±5.106 μg/L,与上述研究结果一致。Sonmez A等[26]发现,经过6周TLC(Therapeutic life-style changes)治疗后, 受试者的Visfatin水平、BMI、腰围和甘油三酯均显著下降,认为Visfatin可能参与肥胖与脂代谢相关疾病的发生和发展,并指出生活方式的改变有利于改善机体的Visfatin水平。Haider等[11]对18名1型糖尿病病人进行为期8个月的自行车训练,每次以60%~70%最大心率强度运动1 h,以逐递增负荷量的形式,从每2周1次逐渐增加到每周3次,随后维持这个强度,受试者血浆Visfatin水平由训练前的64.1±12.0 ng/ml下降到运动2个月后的27.8±2.6 ng/ml、4个月后的17.5±3.4 ng/ml和8个月后的19.7±5.0 ng/ml,表明运动训练能明显降低机体的血清Visfatin水平,因此,他们认为,1型糖尿病患者高浓度血浆Visfatin可以通过进行有规律的身体锻炼使之得到改善。本研究结果表明,常氧训练、低氧安静和低氧训练3种方式均能明显改善肥胖大鼠的血清Visfatin水平。而有趣的是,Seo等[24]对10名健康妇女进行3个月的60 min/d、3次/w,以60%~70%最大心率强度的有氧训练组合3组10 RM的抗阻训练后,发现受试者体重、BMI、体脂百分比、血游离脂肪酸都有明显降低,但血浆Visfatin水平却在训练前后无显著性变化。这表明,健康人群血浆Visfatin水平相对稳定,机体可能存在着良好的调节机制,因此,在运动训练后血浆Visfatin水平不会发生显著性变化。
在探讨不同训练方式对机体Visfatin水平的影响时,多数研究主要从有氧训练和抗阻训练以及两者结合的方式着手,多数研究结果也表现出较高的一致性。Kadoglou等[21]报道,100名2型糖尿病患者分为对照组(鼓励他们进行自我控制锻炼)、有氧训练组(4次/周、60 min/次、60%~75%最大心率强度)、抗阻训练组(60%~80% 1 RM强度)、有氧和抗阻训练组合组进行6个月的实验,结果发现,各组的初始值没有显著性差异,而有氧训练组、有氧和抗组训练组合组hs-CRP和Visfatin水平较其他各组显著下降,因此,提出有氧训练主要具有改善脂肪因子的作用。Choi等[16]在对48名非糖尿病女性实施12周有氧训练(45 min/次,300 kcal/d,5次/周)和力量训练(20 min/次,100 kcal/d,5次/周)相结合的运动干预后,发现血浆Visfatin浓度由13.6±12.0 ng/ml显著下降到7.7±7.9 ng/ml,而且,肥胖患者的血浆Visfatin浓度明显高于非肥胖受试者(16.4±13.4 ng/ml vs. 7.7±5.2 ng/ml)。Seo等[25]也在对中年肥胖的受试者进行相关研究时发现,有氧训练组合抗阻训练形式除了降低体重、体脂百分比等外,还能明显改善Visfatin水平。但有趣的是,Ghanbari等[13]在观察6名身体健康的青年男性受试者进行一次冲刺跑无氧训练(7组6×35 m,组间1 min休息)后即刻、45 min和90 min后的相关指标时,发现血浆Visfatin由12.5±2.0 ng/ml显著上升到26.6±3.9 ng/ml,经过45 min恢复后,其值回落到正常水平,Visfatin水平一过性的升高机制并未明确阐述。而Vatani等[27]对9名健康男性受试者(年龄=24.2±3.6岁,BMI=21.8±2.8 kg/m2)分阶段进行了急性抗阻训练(60% 1 RM强度,3组×15次)、50 min60%最大心率功率自行车有氧训练以及有氧和抗阻组合训练(60% 1 RM强度,2组×15次抗组训练;22 min60%最大心率功率自行车有氧训练),结果发现,血清Visfatin和胰岛素水平在3种训练方案后均出现明显下降,而且恢复30 min后仍然处于较低水平,所以,他们认为,血浆Visfatin的改变与运动方式无关。
本研究中,在观察第1、2、3、4周的时序性结果时,却发现常氧训练和低氧安静方式下均表现出先降后升的变化趋势,即第4周后肥胖大鼠血清Visfatin水平分别回升到36.385±5.455 μg/L和34.504±6.946 μg/L,但仍然显著低于训练前水平;而低氧训练组肥胖大鼠血清Visfatin水平则一直维持在低水平,至第4周后为16.689±7.728 μg/L。这表明,低氧训练这一方式对肥胖大鼠血清的抑制作用明显强于常氧训练和低氧安静,也进一步提示,虽然训练时间的影响作用也非常明显,但训练方式是影响肥胖大鼠血清Visfatin水平的一个非常重要因素。
本研究中,在对同一训练方式不同训练时间比较时,发现常氧训练和低氧安静方式下,肥胖大鼠血清Visfatin含量在第1周出现明显下降,但从第2周开始回升,至第4周显著高于第1、2、3周,这表明常氧训练和低氧安静在初期均能显著降低肥胖大鼠血清Visfatin水平,而随着对训练方式的适应,效果呈现减弱趋势;但是,低氧训练方式下,肥胖大鼠血清Visfatin水平则自第1周开始持续到第4周后仍然保持在低水平,表明低氧训练方式降低肥胖大鼠血清Visfatin水平的作用效果更强,延续性更好。而对同一训练时间不同训练方式下的血清Visfatin含量进行多重比较时,发现低氧训练方式下肥胖大鼠血清Visfatin水平均明显低。有关低氧训练对Visfatin影响的研究较为缺乏,其机制研究有待于进一步深入。
3.2 常压低氧耐力训练对肥胖大鼠脂肪组织Visfatin mRNA相对表达量的影响
研究表明,Visfatin基因的转录表现出24 h节律性,其转录水平在12点出现峰值,在24点降至最低。脂肪细胞的分化可激活Visfatin的表达,其表达还受药物、激素和其他细胞因子的影响。Visfatin具有促进脂肪细胞分化、成熟和蓄积的作用,且随机体脂肪含量的增加而升高,可加速葡萄糖合成甘油三脂,促进甘油三脂在前脂肪细胞蓄积;Visfatin还可诱导脂肪基因编码标记物PPAR-γ、FAS、Adiponectin的表达[17,18]。
运动影响机体的血浆Visfatin含量和脂肪组织Visfatin的表达水平,对糖尿病和肥胖患者机体的Visfatin水平起到很好的干预作用。Nikolaos等[20]在对247名2型糖尿病患者进行调查时发现,运动组(每周中低强度锻炼超过2 h)相对于安静组(每周中低强度锻炼小于2 h)具有低Visfatin(10.16±5.53 ng/ml vs. 14.77±8.48 ng/ml)、高脂联素(1.82±3.06 μg/ml vs. 7.81±2.11 μg/ml)特征,而且身体活动是Visfatin水平的独立影响因素。因此,他们认为,即使是中等强度的身体活动都有利于改善2型糖尿病患者Visfatin和脂联素水平。同时,Aggeloussi等[3]在调查青少年脂肪因子水平时发现,肥胖青少年血浆Visfatin水平明显高于非肥胖青少年,而且,肥胖青少年中长期参加体育活动的也明显有着较低水平的血浆Visfatin,其值与非肥胖青少年水平相当。

本研究发现,常氧训练条件下肥胖大鼠附睾脂肪组织仅在第4周训练后出现显著性升高,前3周则无明显变化,同期的血清Visfatin含量也出现升高;在考虑时序性时可以看出,常氧训练条件下,前2周Visfatin表达水平表现出明显的下调趋势,但第3周后则回升,至最后则明显上调。低氧安静条件下,仅在第3周后出现显著下调;虽然前2周Visfatin表达水平出现一定程度上升,但不具有显著性差异。低氧训练条件下,则在第1周后出现了非常显著性的上调,这可能与第1周血清Visfatin水平下降有关,随后的时序性变化则表现出与低氧安静条件下相同的趋势,到第4周后又逐步下调到原有水平。
而在比较同一时间不同训练方式下的肥胖大鼠附睾脂肪组织Visfatin表达水平时可以看出,虽然第1、2周后,低氧训练条件下其值较高,但至第4周末,低氧训练条件下的脂肪组织Visfatin表达显著降低,与血清Visfatin的表现较为一致。综合分析,4周训练以低氧训练对肥胖大鼠脂肪组织Visfatin/Visfatin mRNA的表达控制最为理想;同时,从3种条件下Visfatin mRNA相对表达量可以看出,训练和环境对其表达水平的调控具有明显差异,其具体调控机制有待于进一步展开研究。
4 结论
1.常氧训练、低氧安静和低氧训练均能有效控制肥胖大鼠血清Visfatin水平,但以低氧训练效果为好。
2.4周训练后,以低氧训练的形式控制肥胖大鼠脂肪组织Visfatin mRNA的表达效果最为明显。
[1]杨箐岩,陈瑞芳,刘戈力,等.单纯性肥胖儿童血浆内脂素水平与相关因素分析[J].中国实用儿科杂志,2008,2(3):187-189.
[2]詹晓梅,邱珍艳,陈文鹤.肥胖与2型糖尿病患者内脂素水平及运动干预效果评价[J].中国运动医学杂志,2012,31(7):628-635.
[3]AGGELOUSSI S,THEODOROU A A,PASCHALIS V,etal.Adipocytokine levels in children:effects of fatness and training[J].Pediatric Exe Sci,2012,24(3):461-471.
[4]BAEB SOO-KYUNG,KIMA SU-RYUN,KIM JONG GAB,etal.Hypoxic induction of human visfatin gene is directly mediated by hypoxia-inducible factor-1[J].FEBS Letters,2006,580(17):4105-4113.
[5]BERNDT J,KLOTING N,KRALISCH S,etal.Plasma visfatin concentrations and fat depot-specific mRNA expression in humans[J].Diabetes,2005,54(10):2911-2916.
[6]C C YANG,S J DENG,C C HSU,etal.Visfatin regulates genes related to lipid metabolism in porcine adipocytes [J].J ANIM Sci,2010,88(10):3233-3241.
[7]CURAT C A,WEGNER V,SENGENS C,etal.Macrophages in human visceral adipose tissue:increased accumulation in obesity and a source of resistin and visfatin[J].Diabetologia,2006,49:744-747.
[8]FLORIANE RUDWILL,STÉPHANE BLANC,GUILLEMETTE GAUQUELIN KOCH,etal.Effects of different levels of physical inactivity on plasma visfatin in healthy normal-weight men[J]. Appl Physiol Nutr Metab,2013,38:689-693.
[9]FRYDELUND LARSEN L,AKERSTROM T,NIELSEN S,etal.Visfatin mRNA expression in human subcutaneous adipose tissue is regulated by exercise[J].Am J Physiol Endocrinol Metab,2007,292(1):E24-31.
[10]FUKUHARA A,MATSUDA M,NISHIZAWA M,etal.Visfatin:a protein secreted by visceral fat that mimics the effects of insulin[J].Sci,2005,307(5708):426-430.
[11]HAIDER D G,SCHINDLER K,SCHALLER G,etal.Increased plasma visfatin concentrations in morbidly obese subjects are reduced after gastric banding[J].J Clin Endocrinol Metab,2006,91(4):1578- 1581.
[12]HAUS JACOB M,SOLOMON THOMAS P J,MARCHETTI CHRISTINE M,etal.Decreased visfatin after exercise training correlates with improved glucose tolerance[J].Med Sci Sports Exe,2009,41(6):1255-1260.
[13]GHANBARI NIAKI A,SAGHEBJOO M,SOLTANI R,etal.Plasma visfatin is increased after high-intensity exercise[J].Ann Nutr Metab,2010,57:3-8.
[14]LEE K J,SHIN Y A,LEE K Y,etal.Aerobic exercise training induced decrease in plasma visfatin and insulin resistance in obese female adolescents[J].Int J Sport Nutrition Exe,2010,20(4):275-281.
[15]KATSUMORI SEGAWA,ATSUNORI FUKUHARA,NAOMI HOSOGAI,etal.Visfatin in adipocytes is upregulated by hypoxia through HIF1a-dependent mechanism[J].Biochemical Biophysical Res Communications,2006,349(3):875-882.
[16]K M CHOI,J H KIM,G J CHO,etal.Effect of exercise training on plasma visfatin and eotaxin levels[J].Eur J Endocrinology,2007,157:437-442.
[17]KOVACIKOVA M,VITKOVA M,KLIMCAKOVA E,etal.Visfatin expression in subcutaneous adipose tissue of pre-menopausal women:relation to hormones and weight reduction[J].Eur J Clin Invest,2008,38(7):516-522.
[18]KRALISCH S,KLEIN J,LOSSNER U,etal.Isoproterenol TNF-alpha,and insulin down regulate adipose triglyceride lipase in 3T3-L1 adipocytes[J].Mol Cell Endocrinol,2005,240:43-49.
[19]NOSCHEN A R,KASER A,ENRICH B,etal.Visfatin,an adipocytokine with proinflammatory and immunomodulating properties[J].J Immunol,2007,178(3):1748-1758.
[20]NIKOLAOS P E KADOGLOU,IOANNIS S VRABAS,ALKISTIS KAPELOUZOU,etal.The association of physical activity with novel adipokines in patients with type 2 diabetes[J].Eur J Int Med,2012,23:137-142.
[21]N P E KADOGLOU,G FOTIADIS,A KAPELOUZOU,etal.The differential anti-inflammatory effects of exercise modalities and their association with early carotid atherosclerosis progression in patients with Type 2 diabetes[J].Diabet Med,2013,30:e41-e50.
[22]ROUPAS N D,MAMALI I,MARAGKOS S,etal.The effect of prolonged aerobic exercise on serum adipokine levels during an ultra-marathon endurance race[J].Hormones Int J Endocrinology Metabolism,2013,12(2):275-282.
[23]SAMARA A,PFISTER M,MARIE B,etal.Visfatin,low-grade inflammation and body mass index (BMI) [J].Clin Endocrinol,2008,69(4):568-574.
[24]SEO D I,YOO E J,LIM K I,etal.Plasma visfatin response to combined exercise training in healthy women[J].Faseb J,2007,21(6):A931-A931.
[25]SEO D I,WY,HA S,etal.Effects of 12 weeks of combined exercise training on visfatin and metabolic syndrome factors in obese middle-aged women[J].J Sports Sci Med,2011,10(1):222-226.
[26]SONMEZ A,TEOMAN D,LLKER T,etal.l Relationship between plasma Visfatin levels and the metabolic variables in metabolic syndrome[J].Endocrine Abstracts,2006,11:357.
[27]VATANI D S,FARAJI H,RAHIMI R,etal.Acute effect of exercise type on serum visfatin in healthy men[J].Med Dello Sport,2012,65(1):75-83.
[28]WAYNE H H SHEU,TZU-MING CHANG,WEN-JANE LEE,etal.Effect of weight loss on proinflammatory state of mononuclear cells in obese women[J].Obesity,2008,16(5):1033-1038.
EffectsofHypoxicEnduranceTrainingontheVisfatinLevelsinObesityRats
XU Jian-fang,FENG Lian-shi,ZHANG Li,LU Ying-li,WANG Xue-bing
This paper is aimed to discuss the effects of hypoxic endurance training on the Visfatin levels in obesity rats observing the serum Visfatin level and the gene expression of Visfatin mRNA.Mehods:130 obesity rats were divided into 13 groups as the followings:control 0 week group,hypoxic control 1,2,3,4 week groups,normoxic 1,2,3,4 week training groups and hypoxic 1,2,3,4 week training groups.All hypoxic training groups stayed in the environment with 13.6% oxygen concentration.The treadmill training was applied with 25m / min in normoxic training groups and 20 m/min in hypoxic training groups.The rats were trained for 1h/d,5d/w,1~4 weeks respectively.The Visfatin mRNA genes expressions in fat tissue of epididymis were measured by quantitative fluorescent PCR,and the serum Visfatin levels were measured by ELISA.Results:1)The serum Visfatin level of 0 week reaches 50.095±9.092 μg/L and all the other groups’ are significantly blow to its (P<0.01).There are the same trend in hypoxic control groups and normoxic training groups with first decrease and then increase variation.While it always keeping low level in hypoxic training groups.2)The Visfatin mRNA gene expression of 0 week in epididymis fat tissue reaches 0.0658±0.0263.The Visfatin gene expression in normoxic training groups has the same trend as the serum Visfatin levels.Although there is the trend with first up regulating and then down regulating in hypoxic control groups and hypoxic training groups,the gene expression of hypoxic 4 week training group is significantly down regulated compared to hypoxic training 1 week group,hypoxic control and normoxic training 4 week groups(P<0.01).Conclusion:1)Hypoxic training has more efficency than hypoxic control and normoxic training for decreasing the serum Visfatin levels.2)Hypoxic training also has more efficiency than hypoxic control and normoxic training for down regulating the Visfatin mRNA gene expression.
HypoxicTraining;ObesityRats;Visfatin;rat;animalexperiment
1000-677X(2014)02-0068-07
2013-08-16;
:2014-01-08
国家自然科学基金资助项目(30971415);国家体育总局体育科学研究所基本科研业务费资助项目(基本08-12)。
:徐建方(1976-),男,安徽望江人,副研究员,博士,研究方向为优秀运动员训练监控、低氧训练适应机制、减肥机理研究,Tel:(010)87182524,E-mail:xujianfang2000@ aliyun.com。
国家体育总局体育科学研究所,北京 100061 China Institute of Sport Science,Beijing 100061,China.
G804.7
:A

