微小RNA传递载体聚乙二醇-b-聚赖氨酸的合成及细胞毒性研究
任海峰,赵英魁,杨 峰,俞 媛,马志强 (第二军医大学药学院,上海 200433)
微小RNA(microRNA,miRNA)是由内源性发夹(hairpin)结构转录衍生而来的一种长度为19~25 nt的单链RNA(single-stranded RNA,ssRNA),广泛存在于真核生物细胞中,是一种非编码RNA,它可以介导基因沉默[1]。近年来,越来越多的证据显示miRNA在生理过程中起到很大的作用[2],它们的异常表达会导致很多疾病的发生[3,4]。因此,近年来不少科学家试图利用miRNA的生理功能实现疾病治疗的目的[5,6]。但是,裸miRNA通过注射等方式进入机体存在诸多问题,包括:在血清中稳定性差,很快被细胞外的RNA酶降解;在正常组织中会有非特异性分布,从而使它们在靶组织的水平降低,发挥不了期望的药理活性[7]。因此,将miRNA成功地导入体内,有效地到达靶组织,迫切需要寻找一种高效的载体来克服上述障碍。
目前常用的两种基因载体:病毒载体和非病毒载体。病毒载体虽然有极高的转染效率,但是其转基因表达时间短,不能在宿主细胞中持续表达,临床上也存在多种安全问题[7-10],因此病毒载体的应用前景备受质疑。为了解决病毒载体出现的问题,大量的非病毒载体被开发出来用于基因传递,例如壳聚糖、阳离子脂质体以及阳离子高分子嵌段聚合物等。在诸多非病毒载体中,具有质子海绵效应的聚阳离子高分子材料日益受到重视,有望成为解决基因传递问题的重要材料。该类材料可以增强复合物粒子在血液中的稳定性,避开网状内皮系统(reticuloendothelial system ,RES)的吞噬作用,具有良好的内涵体逃逸功能,同时兼具较低的细胞毒性,是一种理想的基因载体。
聚赖氨酸是近年来应用较广泛的一种阳离子载体,极具应用前景。在质粒DNA以及siRNA(small interfering RNA)的传递系统中多有报道[11-13],但是尚未见该材料用于miRNA的基因传递系统中。hsa-miR-15a是一种典型的miRNA, 在多种肿瘤中该基因缺失或者下调。本实验合成了PEG化的聚赖氨酸,并以hsa-miR-15a为模型基因探讨PEG化的聚赖氨酸包覆miRNA的性能,对其细胞毒性进行考察,实验结果表明PEG-b-PLL是一种有潜力的miRNA基因传递载体。
1 材料与方法
1.1实验材料
1.1.1试剂 甲氧基聚乙二醇胺(mPEG-NH2)和N-碳苄氧基赖氨酸(Nepsilon-Cbz-L-Lysine)购于上海阿拉丁试剂有限公司;二亚乙基三胺(DET)购自百灵威科技有限公司;Goldview核酸染料,购自北京赛百盛基因技术有限公司;CKK-8试剂盒,购自同仁化学研究所;其余有机溶剂与反应介质购自国药集团。
1.1.2仪器 核磁共振仪(美国Bruker公司);冷冻干燥机V55C型(美国Virtis公司);CO2培养箱(美国Barnstead公司);电泳仪WH-300-LCD(上海伊瑞生物科技仪器有限公司);水平电泳槽YR-158(上海伊瑞生物科技有限公司);凝胶成像仪(上海复日科技有限公司)。
1.2试验方法
1.2.1PEG-b-PLL的合成
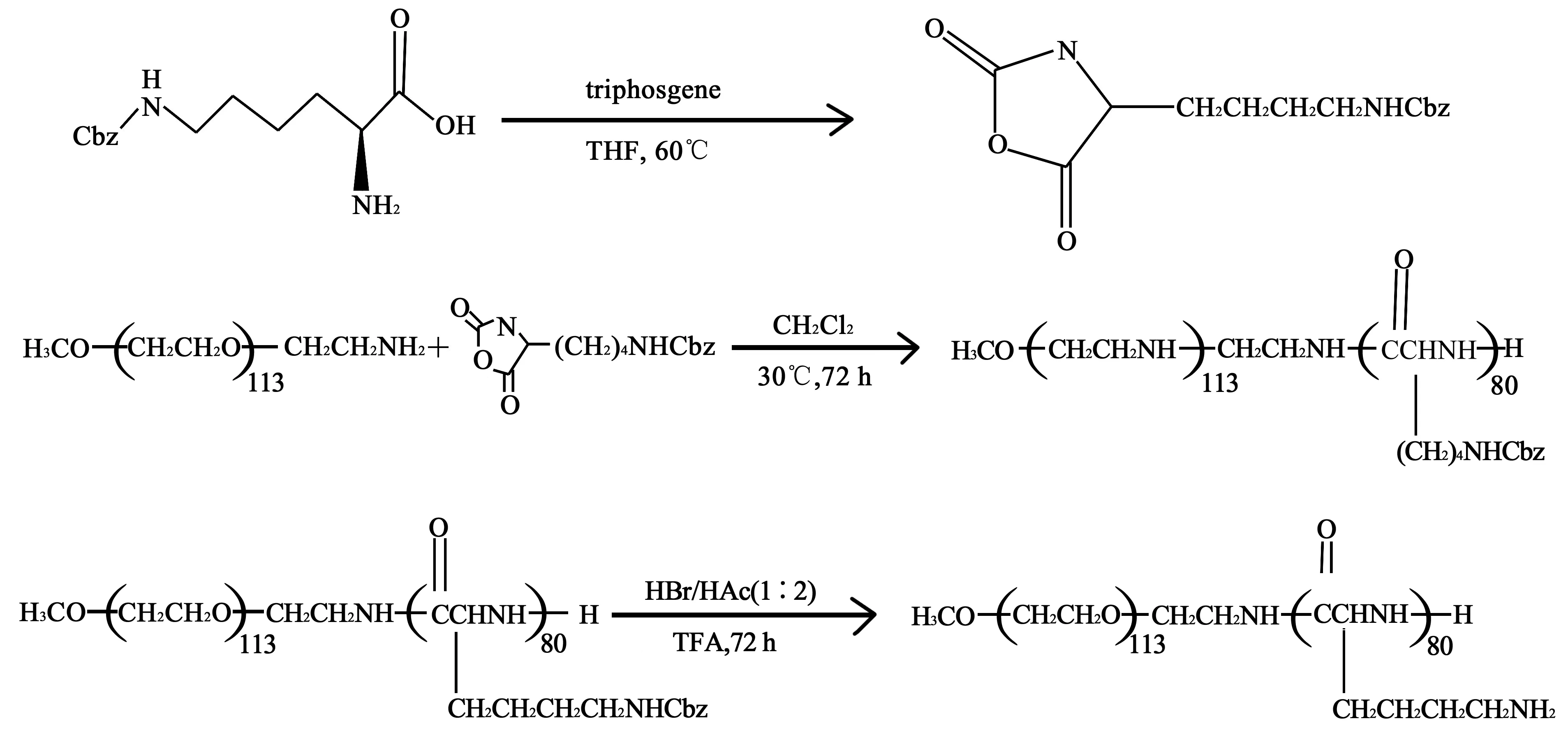
图1 PEG-b-PLL合成示意图
称取N-碳苄氧基氨酸10 g,溶于回流过的四氢呋喃50 ml,升温至60℃,在磁力搅拌下加入三光气7 g,待反应液变成澄清后充入氮气去除多余的光气和HCl气体,旋蒸浓缩反应液,用氯仿稀释,并缓慢加入过量正己烷沉淀产物,在冰箱中静置12 h,过滤得粗产物,并用乙酸乙酯-正己烷(1:1)重结晶,静置12 h,过滤,真空干燥得产物L-碳苄氧基赖氨酸-N-羧酸酐。
精密称取PEG-NH2500 mg、L-碳苄氧基赖氨酸-N-羧酸酐2.5 g,溶于6.2 ml的DMF(二甲基甲酰胺)中,氮气保护,体系隔绝水,在35 ℃条件下反应72 h,用纯水透析,即得PEG-b-PLL-Cbz。
取PEG-b-PLL-Cbz 500 mg,加入10 ml混合溶剂HBr-HAc(1:2), 再加入2 ml TFA(三氟乙酸),室温下反应72 h,加入过量乙醚沉淀分层,取水相,加入碱调至弱酸,透析,加入过量乙醚,沉淀,加入水静置分层,除去乙醚层,加碱中和,透析,冻干,得终产品。
1.2.2聚复合物的合成及表征 采用自组装法合成聚复合物。按照N/P=0,5,10,20,取PEG-b-PLL和hsa-miR-15a在10 mmol/L Tris-HCl (pH 7.4)中,按照一定比例混合孵育,自组装得到载基因聚复合物(hsa-miR-15a-polyplex)。将hsa-miR-15a-polyplex稀释于0.001 mol/L NaCl溶液中,测定光散射粒径、PDI、Zeta电位值。
同时,为了考察该胶束复合物的性质随时间变化的趋势,选定N/P=20的情况对各组胶束复合物的粒径和PDI在10%FBS(胎牛血清)的PBS(磷酸盐缓冲液)溶液中考察,每半小时测定一次,直到最稳定组的粒径和PDI发生凝聚后1 h停止记录。
用4% 琼脂糖凝胶电泳检测聚复合物对miRNA的包封率。称取琼脂糖4 g,加入87 ml无菌蒸馏水,微波炉中加热溶解,加入10 ml RNArun溶液,室温下将溶液冷却至60 ℃左右,再加入3 ml去离子甲醛,混匀,趁热灌胶,上样前用110 V电压预电泳5 min。
1.2.3聚复合物细胞毒性的研究 培养的慢性淋巴白血病细胞(K562细胞),采用CKK-8试剂盒测定考察PEG-b-PLL的细胞毒性。实验步骤如下:
1.2.3.1取出对数生长期的K562细胞,吹匀,1 500 r/min离心5 min,弃去培养基,收集K562细胞,重悬接种于96孔板,每孔加细胞悬液90 μl,浓度为1×104cell/well。加入不同浓度的合成聚合物溶液,混合均匀,于37℃、5% CO2条件下连续培养4 h。设计每个浓度3个复孔。同时设不加细胞的空白孔和不进行任何处理的阴性对照孔。
1.2.3.2各因素组细胞孵育2 d后,取出96孔板,每孔加入15 μl的CCK-8溶液,将孔板置于孵箱中继续孵育4 h。
1.2.3.3用紫外酶标仪测定在450 nm处的吸光度值。
1.2.3.4计算每组3个复孔的平均吸光度值(OD值),按以下公式计算细胞生存率:
细胞生存率(%)=(样品OD值-空白OD值)/(阴性对照OD值-空白组OD值)×100%
2 结果
2.1PEG-b-PLL的合成 设计聚赖氨酸的聚合度为80,合成的产品核磁谱如图1,以分子中PEG定标的情况下得出苄基的个数为82.7个,即所得产品赖氨酸聚合度约为83。PEG-b-PLL-Cbz在脱掉苄基后即生成PEG-b-PLL。
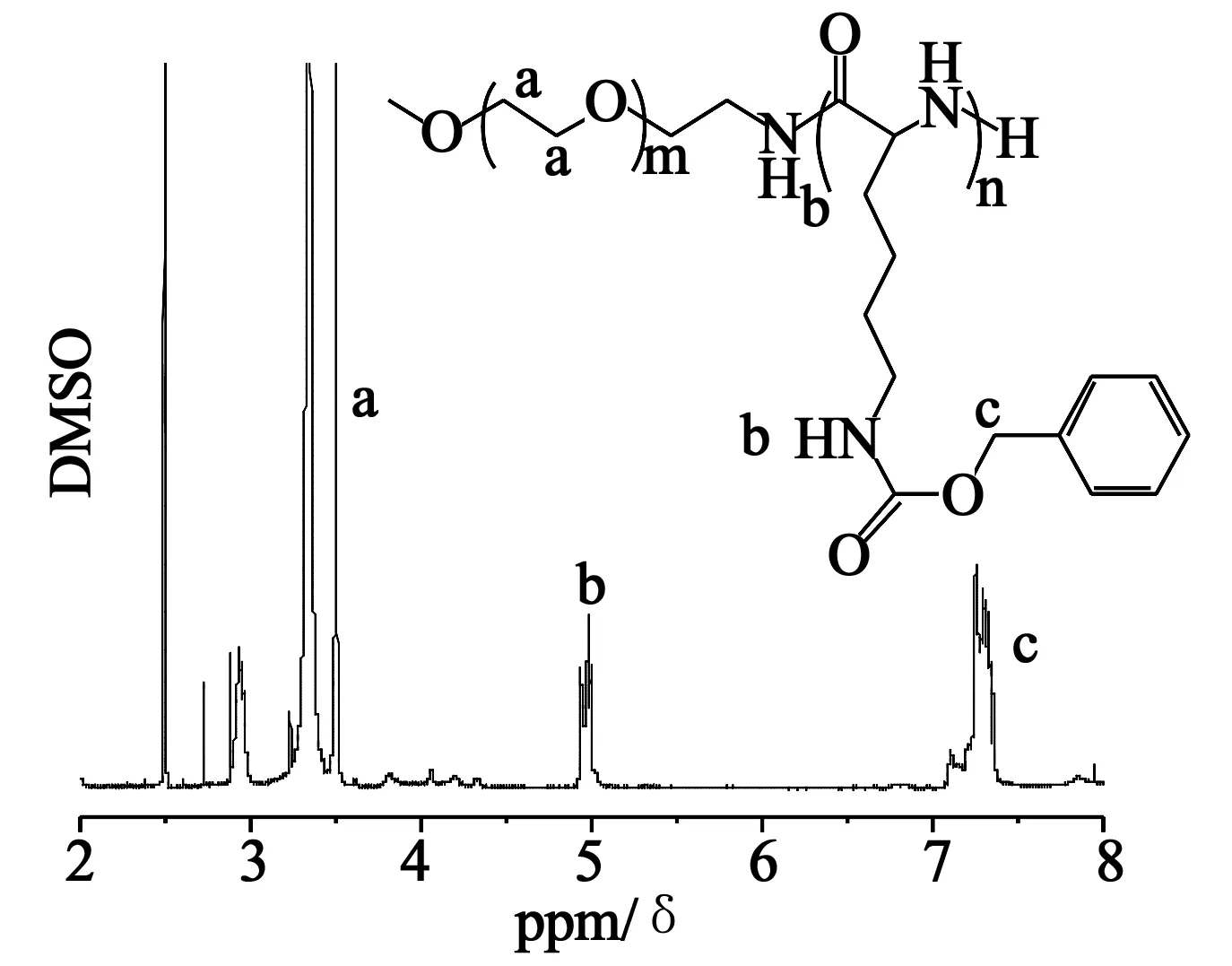
图1 PEG-b-PLL-Cbz核磁图谱
2.2聚复合物的合成及表征 实验结果如表1, 结果显示随着N/P(氮磷比)的增大,miRNA由游离状态逐渐与高分子材料复合,形成胶束复合物,胶束复合物的纳米粒比较松散,粒径在150~260 nm之间。可能因为miRNA的链段很短(只有21个碱基对),并且刚性很强的缘故,因此在我们的实验里, 并未见到胶束的粒径与 N/P有明显的线性关系。PDI(多分散性)可衡量胶束复合物粒径的分散程度,通常认为在胶束复合物系统中,PDI<0.3方可满足进一步研究的要求。我们制备的胶束复合物的PDI均在0.3以下,并且胶束复合物整体带正电荷(Zata电位都在10 mV以上),满足后续实验通过与细胞膜的负电荷物质(主要为磷脂双分子层)相互作用,内吞进入细胞的要求。
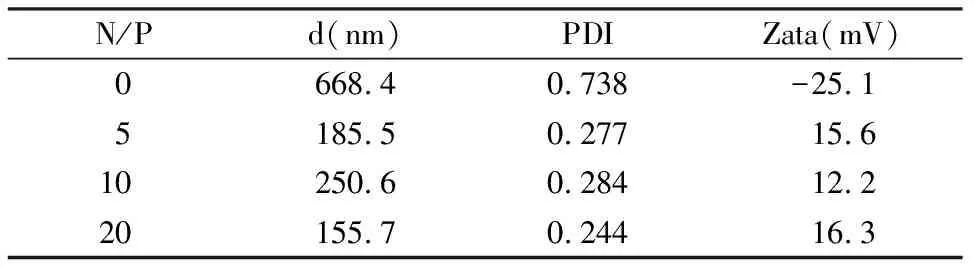
表1 不同氮磷比下胶束复合物的动态光散射数据
中性溶液中,带有负电荷的miRNA可利用甲醛变性琼脂糖从负极向正极泳动,利用Goldview核酸染料插入到miRNA后在紫外灯下呈现荧光条带。凝胶电泳阻滞分析法可以通过荧光的位置和强度直观地反映聚合物与RNA结合作用的强弱。当聚合物与miRNA结合牢固时,紫外灯下无法观察到荧光;如果结合得不牢固,那么游离的miRNA就会与核酸染料结合显示出荧光。如图2所示,当N/P=0时,裸的miRNA显示出非常强的荧光,随着N/P的增大,荧光逐渐减弱,并且拖尾现象消失,显示miRNA已经与PEG-b-PLL稳定结合形成胶束复合物,滞留在加样孔中。
图2 不同N/P条件下,高分子嵌段共聚物对于miRNA的复合效率(图中0~5为复合物中的N/P,即氮磷比)
为了测定该胶束复合物在生理条件下的稳定性,在0.1 mol/L PBS的溶液体系中制备N/P=10,基因浓度在5 nmol/L的胶束复合物溶液,每隔2 h测一次其粒径和PDI变化(图3)。可以看出,粒径和PDI的变化是比较一致的。随着时间的推移,复合物的粒径逐渐增大,由160 nm左右增至1 000 nm以上,伴随的是PDI的数值由0.2左右逐渐增大到0.45左右,表明随着时间的推移,胶束复合物的稳定性逐渐下降,胶束复合物在溶液电解质的作用下,在20 h后明显发生团聚现象。
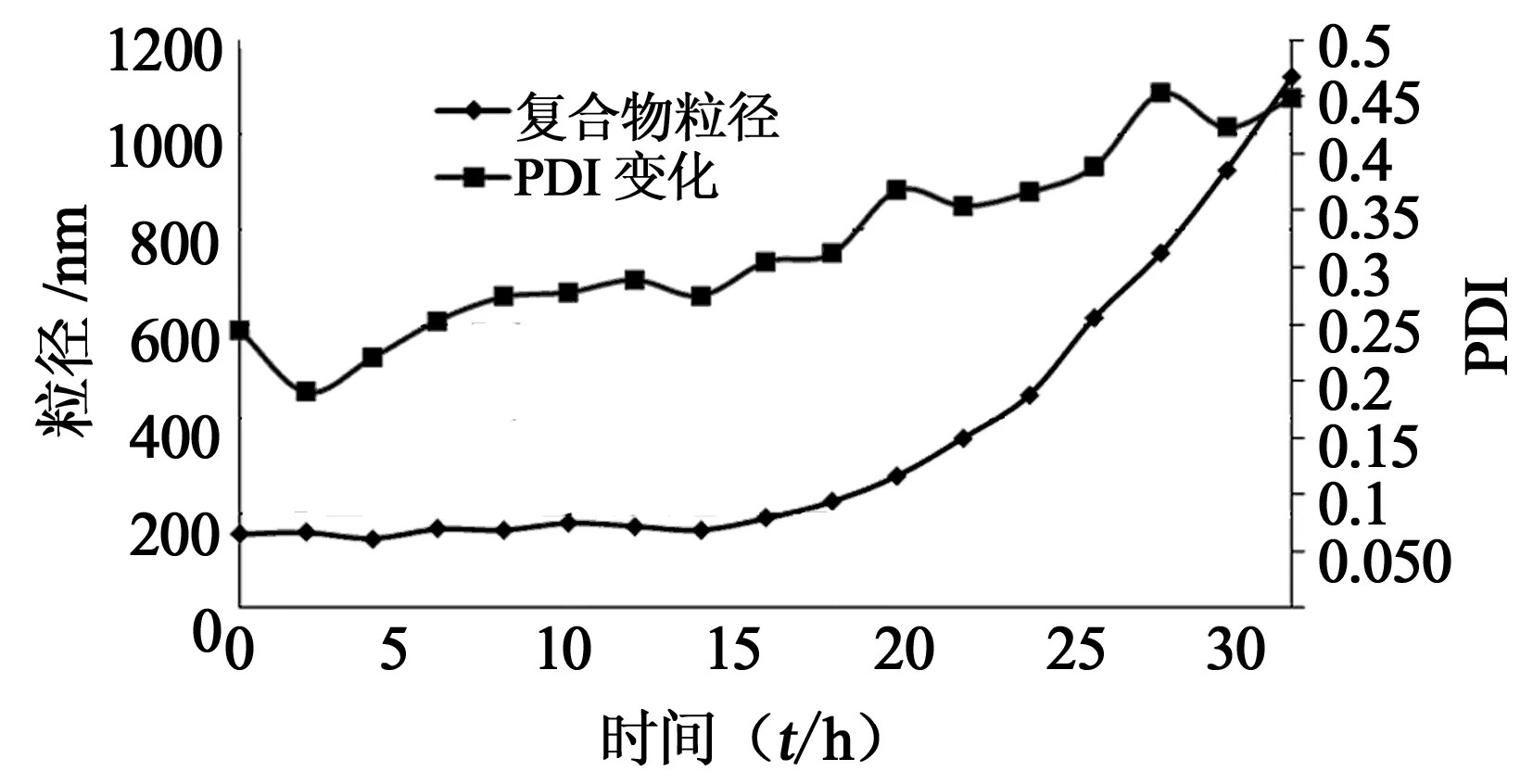
图3 N/P=10时,胶束复合物的粒径和PDI随时间变化趋势
2.3聚复合物细胞毒性的研究 实验所得结果如图4,分别在PEG-b-PLL的浓度为0.04、0.2、1 mg/ml时测定其毒性。由实验结果我们可以看出,在相同浓度下,相对传统的转染试剂PEI,胶束复合物的细胞存活率远高于PEI组;同已经商业化的lipo2000比较,只有高分子材料在1 mg/ml的高浓度时毒性高于lipo2000,而在接近工作浓度的0.04 mg/ml,高分子材料的表现略优于lip2000。表明该材料可作为基因载体做进一步的研究。
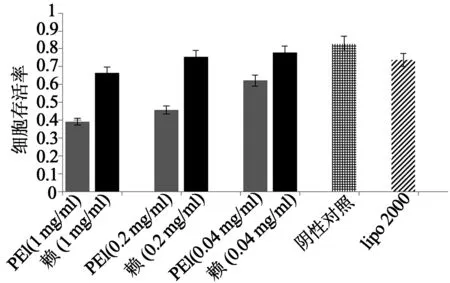
图4 不同浓度下,PEG-b-PLL的细胞毒性(赖:PEG-b-PLL)
3 讨论
因为miRNA较质粒DNA和siRNA脆弱,因此在载体系统的设计中能保证其稳定性就显得十分重要。在本实验中成功制得PEG-b-PLL,核磁谱显示聚赖氨酸聚合度83,与实验设计的结构接近,说明本合成方案可行。利用动态光散射对不同N/P条件下胶束复合物的流体力学半径以及Zeta电位进行研究,实验结果表明,随着N/P的增大,胶束复合物的流体力学半径变小,Zeta电位变化不大,表明可能在此过程中,胶束复合物复合miRNA的能力逐渐增大。本实验还利用凝胶阻滞色谱测定了胶束复合物复合miRNA的能力,在N/P≥5时,聚合物可以对miRNA进行有效包覆;动态光散射数据显示,在N/P=10时,在20 h后胶束复合物开始发生聚沉现象,显示胶束复合物在类生理环境下具有一定的稳定性。最后对该高分子材料的细胞生物毒性进行了考察,结果显示聚赖氨酸-miRNA聚复合物各项特性符合应用要求,相比其他载体毒性低,极具应用前景。该材料有望通过传递miRNA进入细胞内,在肿瘤治疗等领域发挥巨大作用。
【参考文献】
[1] Lee RC, Feinbaum RL, Ambros V. The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell, 1993, 75(5):843-854.
[2] Hagiwara K, Ochiya T, Kosaka N. A paradigm shift for extracellular vesicles as small RNA carriers: from cellular waste elimination to therapeutic applications[J].Drug Deliv Transl Res, 2014, 4: 31-37.
[3] Sheherbata HR,Hatfield S,Ward EJ,etal.The MicroRNA pathway plays a regulatory role in stem cell division[J].Cell Cycle, 2006, 5(2):172-175.
[4] Hatfield SD, Sheherbata HR, Fischer KA,etal. Stem cell division is regulated by the microRNA pathway[J].Nature, 2005, 435(7044): 974-978.
[5] Tan PH, Pao YY, Cheng JK,etal. MicroRNA-based therapy in pain medicine: current progress and future prospects[J].Acta Anaesthesiol Taiwanica, 2013, 51:171-176.
[6] Hatakeyama H, Murata M, Sato Y,etal. The systemic administration of an anti-miRNA oligonucleotide encapsulated pH-sensitive liposome results in reduced level of hepatic microRNA-122 in mice[J].J Control Rel, 2014, 173: 43-50.
[7] Marshall E. Gene therapy death prompts review of adenovirus vector[J].Science, 1999, 286: 2244-2245.
[8] Hollon T. Researchers and regulators reflect on first gene therapy death[J].Am J Ophthalmol, 2000, 129(5): 701.
[9] Assessment of adenoviral vector safety and toxicity: report of the National Institutes of Health Recombinant DNA Advisory Committee [J].Hum Gene Ther, 2002, 13(1): 3-13.
[10] Cavazzana Calvo M, Hacein Bey S, Basile G,etal. Gene therapy of human severe combined immunodeficiency (SCID)-X1 disease[J].Science, 2000, 288: 669-672.
[11] Sanjoh M, Miyata K, Christie RJ,etal. Dual environment-responsive polyplex carriers for enhanced intracellulardelivery of plasmid DNA[J].Biomacromolecules, 2012, 13(11):3641-3649.
[12] Osada K, Shiotani T, Tockary TA,etal. Enhanced gene expression promoted by the quantized folding of pDNA within polyplex micelles[J].Biomaterials, 2012 , 33(1):325-332.
[13] Sanjoh M, Hiki S, Lee Y,etal. pDNA/poly(L-lysine) polyplexes functionalized with a pH-sensitive charge-conversional poly(aspartamide) derivative for controlled gene delivery to human umbilical vein endothelial cells[J]. Macromol Rapid Commun. 2010, 31(13):1181-1186.

