来源于天然产物的抗肿瘤先导结构研究进展
武善超,盛春泉,张万年 (第二军医大学药学院,上海 200433)
肿瘤是严重威胁人类生命的常见病和多发病,其死亡率仅次于心血管疾病,已经成为威胁人类健康的第二大杀手,全球每年约700万人死于各种肿瘤。因此,发现新结构类型、新作用机制、更有效的抗肿瘤药已成为当务之急。天然产物是现有药物的重要来源,也在抗肿瘤药物发现过程中有着重要的作用和意义。据统计,在1981年至2006年间上市的新药中有50%直接或间接来源于天然产物[1]。单独就抗肿瘤药而言,约有2/3的药物来源于天然产物。一些来源于天然产物的抗肿瘤药物如紫杉醇类、喜树碱类、长春碱类、鬼臼毒素类、埃坡霉素类等在治疗肿瘤中发挥了重要作用。本文综述了几种新近发现具有抗肿瘤活性的天然产物,重点介绍其作用机制、抗肿瘤活性及构效关系的研究进展。
1 白桦酸 (betulinic acid)
白桦酸(1)又名白桦脂酸,是一种可以从多种植物中提取得到的五环三萜化合物。白桦酸的生物来源主要有白桦树皮、蒲桃树叶、酸枣仁等,它也可以用白桦脂醇为原料通过化学合成得到。
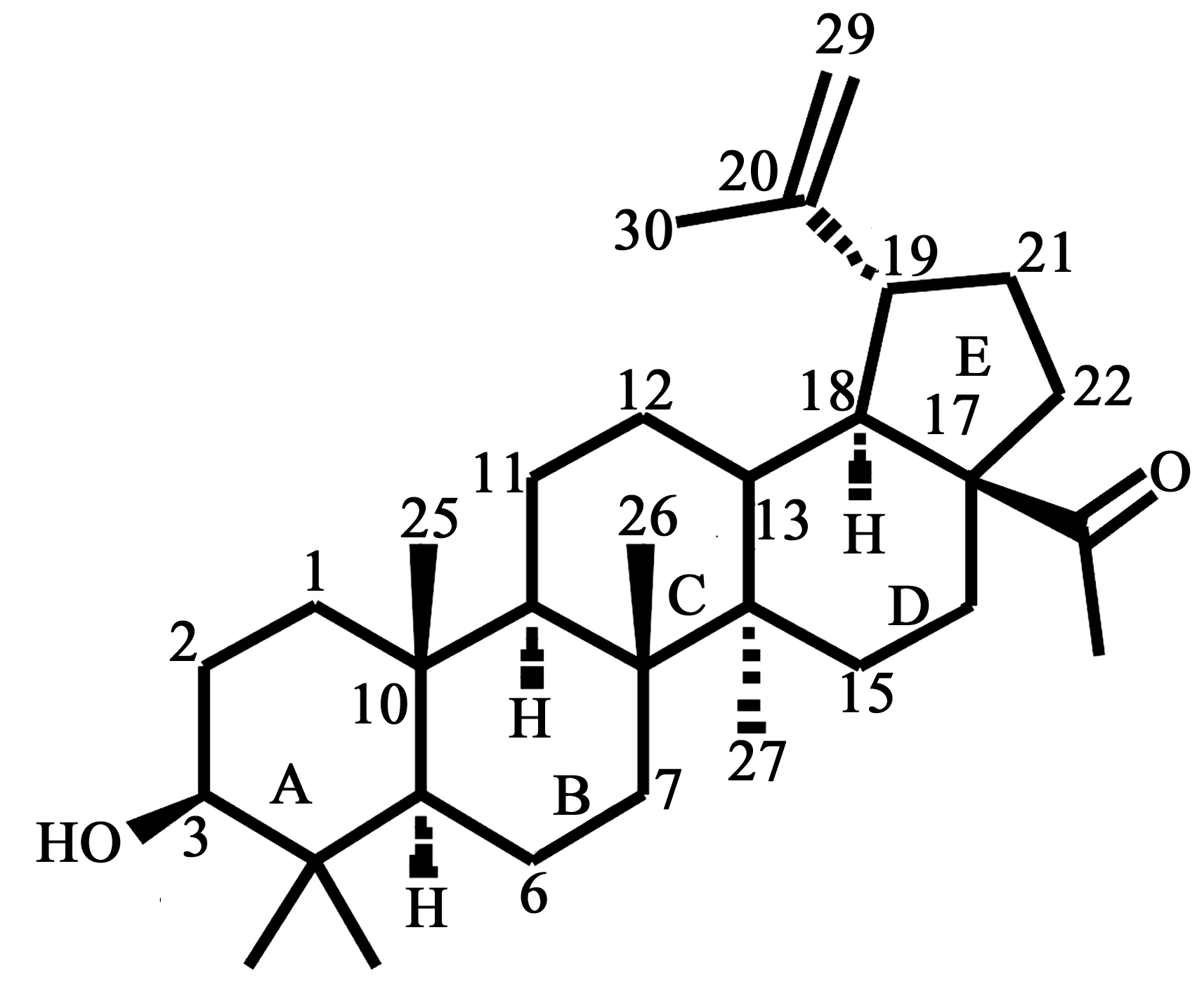
图1 白桦酸的化学结构式(1)
1.1抗肿瘤活性 现有大量数据表明白桦酸对多种类型的肿瘤细胞具有抑制活性[2]。最初发现白桦酸是人类黑色素瘤的生长抑制剂,随后证实它可以引起成神经细胞瘤、成神经管细胞瘤、尤文肉瘤等细胞株的凋亡。Zuco等[3]报道白桦酸具有体外抗恶性肿瘤细胞增殖活性。Chintharlapalli等[4]报道了白桦酸具有抑制结肠癌细胞生长的作用,减少雌性激素受体阴性乳腺癌细胞MDA-MB-231细胞增殖和促进其凋亡的作用。白桦酸可抑制转录因子Sp1(specificity protein1)、Sp2、Sp4,并同时促进锌指ZBTB10 的表达[5]、引起促横纹肌肉瘤细胞凋亡[6]。它对黑色素瘤、白血病、乳腺癌、前列腺癌、结肠癌、肝癌、子宫内膜恶性肿瘤细胞、骨髓瘤都有促凋亡作用[7-9]。并且最新的研究发现其对鼻咽癌肿瘤细胞也具有较好的抑制作用[10]。
1.2作用机制 白桦酸的抗肿瘤作用机制目前还不是很明确,但大量的实验表明白桦酸通过影响线粒体调节的信号通路引起细胞凋亡[11]。Chintharlapalli等[4]报道了白桦酸抑制前列腺癌细胞生长的作用机制。生成活性氧自由基、抑制拓扑异构酶Ⅰ、活化MAP激酶、抑制血管生成、活化调节促生长因子转录和氨肽酶N端活性,对白桦酸促细胞凋亡具有重要作用。这些潜在的作用机制将使白桦酸具有良好的抗肿瘤作用[12]。白桦酸的抗结肠癌作用机制是下调特异性蛋白的Sp1、Sp3、Sp4转录因子[13],其抗乳腺癌的作用至少部分是由于白桦酸与小分子RNA(microRNA)作用而引起细胞死亡[5]。
1.3构效关系 白桦酸是一个具有前景的抗肿瘤先导结构,为研究白桦酸构效关系,合成了一系列它的类似物,以期得到抗肿瘤候选药物。白桦酸的构效关系总结如下:
三个环的骨架结构(A、B、C环)在白桦酸抗肿瘤活性中起重要作用,对A环进行扩环其细胞毒性改变不大[14];C-2位引入溴原子表现出高活性并且对肿瘤细胞抑制具有选择性[15];C-2位与C-3位间并五元杂环,抗肿瘤活性保持但水溶性降低[15];C-3位为酯基时其细胞毒性增加[14];C-3位酰基化对人肺癌细胞株A549的细胞毒性增加、对人卵巢癌细胞CAOV3细胞毒性降低[16];C-28位的羧酸对细胞毒性重要,白桦酸C-2位被卤素取代后其细胞毒性减弱[14]。
2 白藜芦醇 (resveratrol)
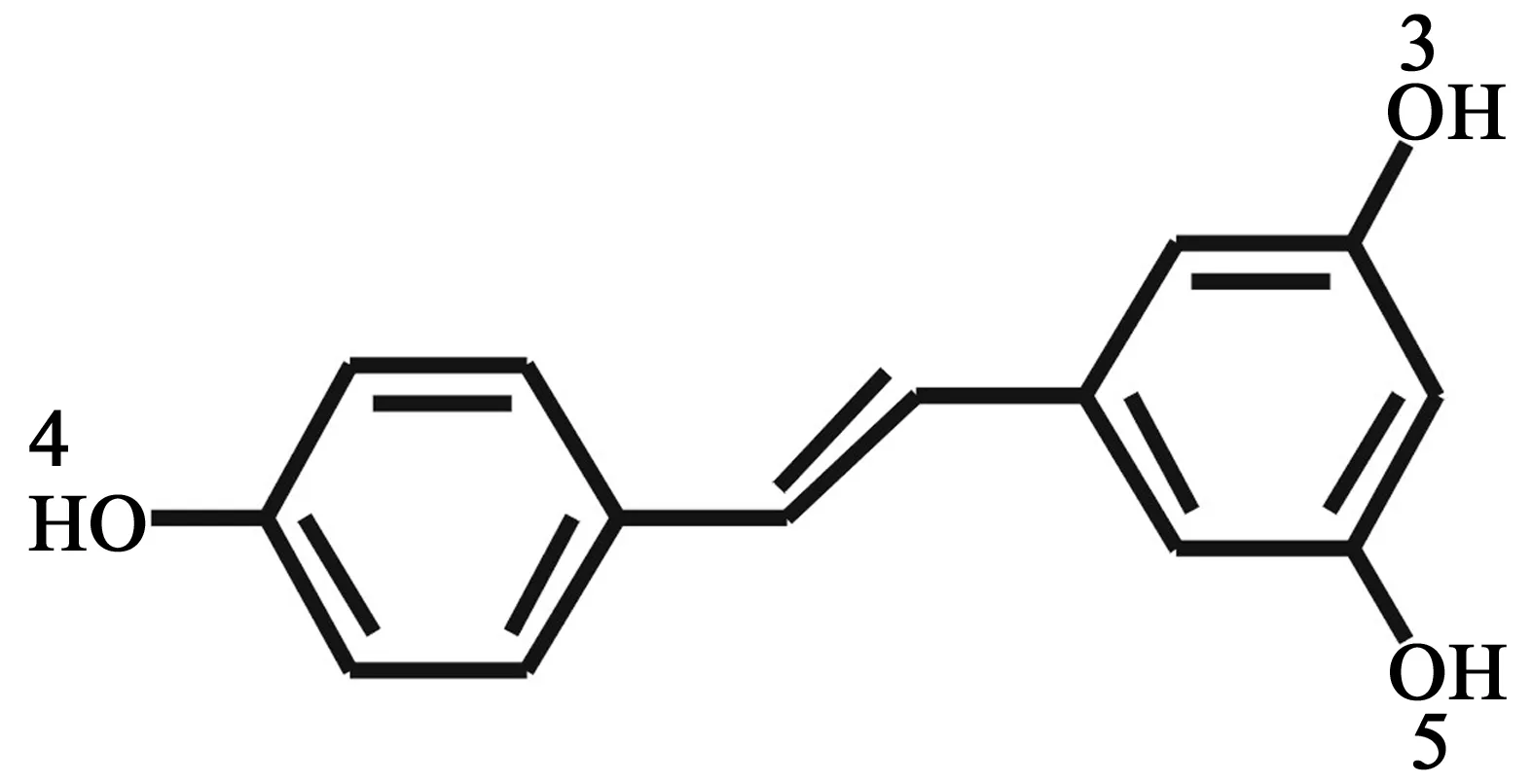
图2 白藜芦醇的化学结构式(2)
白藜芦醇(2)是一种天然存在的多元酚,首次发现是从白藜芦的根部提取出来的,现已发现在70多种植物中存在,是一种植物抗毒素。白藜芦醇是一个不对称的E-构型二苯代乙烯,具有广泛的生物活性,例如抗氧化、抗衰老、抗心血管疾病、抗肿瘤作用等。
2.1抗肿瘤活性 大量的证据表明白藜芦醇在预防和治疗肿瘤方面具有广阔的前景。它影响致癌的3个阶段:癌症的启动、促进和演变。在过去的十年里,有关白藜芦醇的潜在抗肿瘤活性研究取得了显著的进展[17]。作为一种潜在的抗肿瘤药物,白藜芦醇可以引起许多肿瘤细胞株(例如白血病、肝癌、成神经细胞瘤、前列腺癌、结肠癌、胃癌、胰腺癌、食管癌、乳腺癌、人类黑色素瘤等)的分化和细胞凋亡。
2.2作用机制 自从1997年Jang[18]发表了白藜芦醇有助于小鼠抵抗皮肤癌的论文之后,其抗肿瘤活性的研究不断深入。白藜芦醇能够调控一系列细胞内信号分子的表达和活动,如细胞周期的调控、细胞增殖、致癌物质代谢。Kundu等[19]总结了白藜芦醇潜在的化学预防和化学治疗肿瘤的作用机制,主要有阻滞各种致癌物质的活性或者促进它们的解毒作用,阻止致癌物质对目标分子DNA的氧化,减少炎症和肿瘤细胞增殖扩散。白藜芦醇还能够诱导各种癌变前的细胞或类似肿瘤细胞凋亡,阻滞肿瘤细胞演变的血管生成和转移进程,缓解化疗患者的耐药性[20]。大量的体内体外实验数据表明,白藜芦醇是通过调节由特定激酶[20]、转录因子[21]等调控的信号转导来抑制癌症的发生与发展。尽管对白藜芦醇的抗肿瘤研究取得了许多重大突破,但与其抗肿瘤相关的临床前研究还很少。
2.3构效关系 目前,白藜芦醇构效关系研究揭示了结构因素(如羟基、甲氧基取代的数量和位置、分子内氢键、立体异构体等)对其生物活性的影响。对于体外培养的HL-60和人类白血病细胞株的抗氧化和促细胞凋亡活性对比,发现3,4-二羟基的白藜芦醇类似物的生物活性显著高于反式白藜芦醇和其他类似物[22]。去除4位羟基的白藜芦醇,抗氧化活性降低;在4位邻位再引入一个羟基的双羟基白藜芦醇其抑制低密度脂蛋白过氧化反应和自由基捕获的能力增强[23]。Saiko等[24]研究发现,具有4位羟基和邻二苯氧基或间二苯氧基的类似物其生物活性较白藜芦醇显著增加,这为未来设计抗肿瘤药物提供了重要信息。
3 吴茱萸碱 (evodiamine)
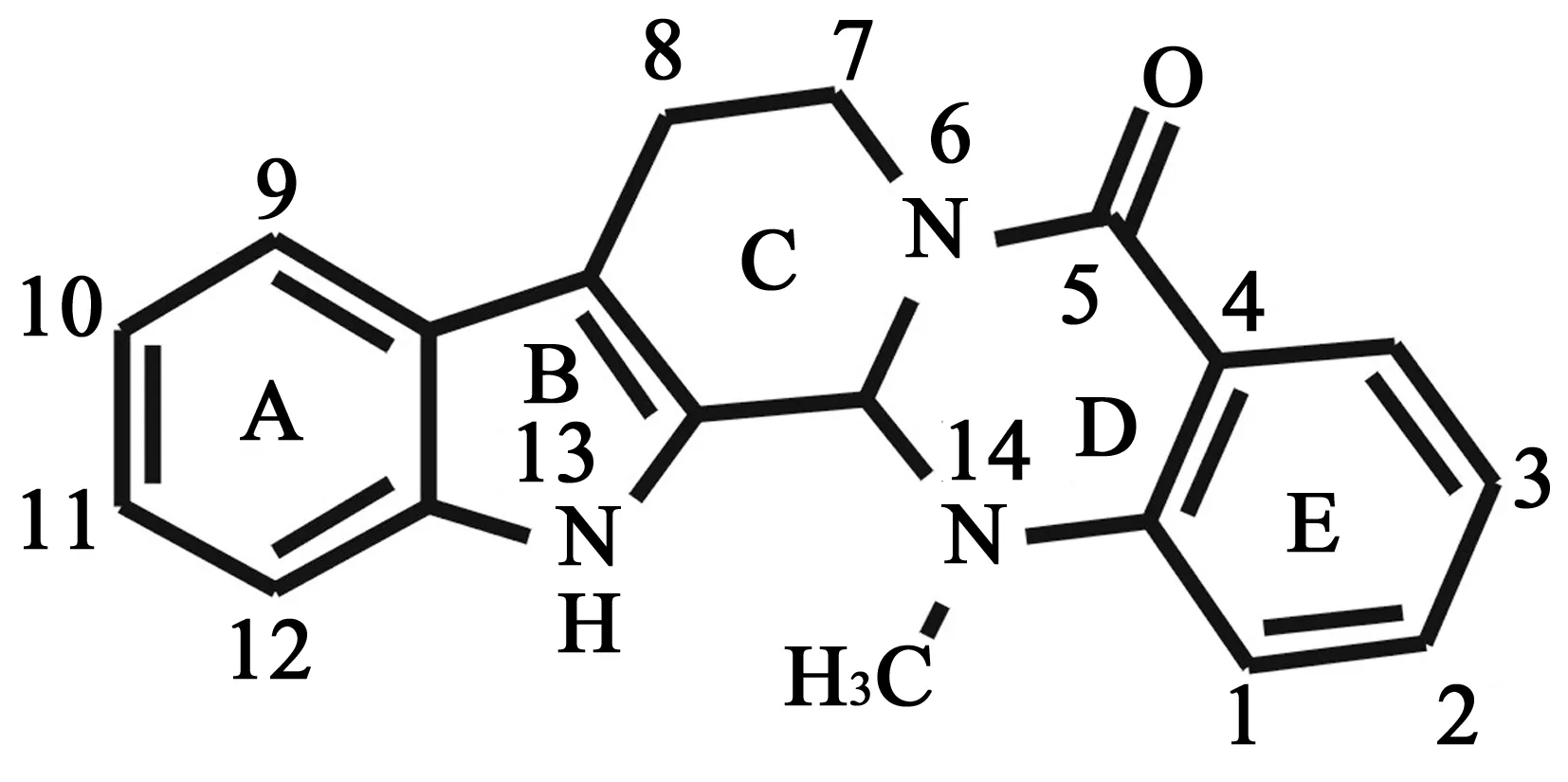
图3 吴茱萸碱的化学结构式(3)
吴茱萸碱(3)是从芸香科植物吴茱萸(Evodiarutaecarpa)果实中分离得到的喹诺酮生物碱,具有广泛的生物活性[25],例如促睾丸酮分泌、促儿茶酚胺分泌、止痛、抗炎、减肥、促血管舒张、调节体温、促子宫收缩、抗肿瘤等。
3.1抗肿瘤活性 吴茱萸碱对多种肿瘤具有抑制作用,如肺癌、前列腺癌、白血病、T淋巴细胞、黑色素瘤、子宫癌、结肠癌和肺癌等。更为重要的是,吴茱萸碱对耐阿霉素乳腺癌细胞敏感,而对人正常外周血细胞毒性低[26]。它对人结肠癌lovo细胞有抑制作用,引起其细胞凋亡和细胞S期阻滞[27]。吴茱萸碱作为抗肿瘤先导结构具有很多优势:首先,吴茱萸碱显示广谱抗肿瘤作用,抑制肿瘤侵袭扩散,并且毒性低;其次,吴茱萸碱是潜在的多靶标作用分子,对多条细胞凋亡信号转导通路有影响,具体作用的分子靶标有待于研究;再次,吴茱萸碱分子量和溶解性合理,有进一步成药性改造空间。
3.2作用机制 吴茱萸碱具有多靶点抗肿瘤机制,主要通过诱导肿瘤细胞凋亡、阻遏细胞周期和抑制肿瘤组织侵袭和转移发挥抗肿瘤作用[28]。吴茱萸碱主要作用于PI3K/Akt/caspase、MAPK 和 Fas-L/NF-κB 等信号转导通路来诱导肿瘤细胞凋亡[29]。吴茱萸碱阻止肿瘤细胞周期停留在 G2/M 期,主要通过提高细胞中聚合型微管蛋白水平而阻止有丝分裂[30]。吴茱萸碱诱导细胞凋亡还与Bc1-2的磷酸化,Bax和aMase 的上调有关[31]。吴茱萸碱促人胃癌SGC-7901细胞株凋亡是因为其上调了酸性鞘磷脂酶(aSMase)的表达并水解神经鞘磷脂成神经酰胺[32],进一步的研究发现吴茱萸碱能同时促进胃癌SGC-7901细胞自我吞噬和促细胞凋亡的作用[33]。最新研究表明,吴茱萸碱能通过PI3K/Akt通路增强吉西他滨的抗胰腺癌活性[34]。
3.3构效关系 本课题组前期针对抗肿瘤重要药靶DNA拓扑异构酶Ⅰ (Topo Ⅰ )开展了虚拟高通量筛选研究,发现吴茱萸碱是新型Topo Ⅰ 抑制剂, 进一步验证其多靶点抗肿瘤作用特点[35,36]。在此基础上,首次开展了吴茱萸碱的初步结构优化研究。我们首先根据其与Topo Ⅰ 的作用模式,设计合成了一系列N-取代的衍生物,发现多个抗肿瘤活性更强和抗肿瘤谱更广的化合物。其中,N-(4-氯苯甲酰基)吴茱萸碱对乳腺癌MDA-MB-435细胞株、肺癌A549细胞株和结肠癌HCT116细胞株的IC50值分别为0.049、0.86和2.6 μmol/L。吴茱萸碱N13位构效关系研究显示,苯甲酰基取代优于苄基和烷基取代,苯甲酰基苯环上4-氯取代活性最强。吴茱萸碱系统的构效关系研究正在进行之中。
4 姜黄素 (curcumin)
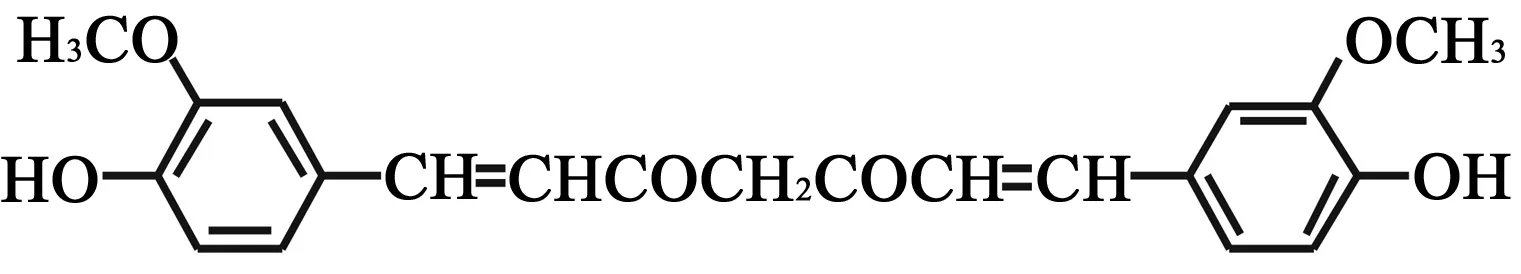
图4 姜黄素的化学结构式(4)
姜黄素(4)是从姜科、天南星科中一些植物的根茎中提取的一种化学成分,为二酮类化合物、疏水性多元酚,是植物界很稀少的具有二酮结构的色素。分子结构中两个α, β-不饱和结构存在酮-醇互变。在酸性和中性溶液中主要以酮式为主,在碱性溶液中主要以醇式为主。
4.1抗肿瘤活性 文献表明,姜黄素是极具前景的化学预防和化学治疗先导药物。到目前为止大约有超过800篇文献报道了姜黄素的抗肿瘤活性,姜黄素具有治疗各种不同类型癌症(例如白血病、淋巴癌、胃肠道癌症、乳腺癌、卵巢癌、头颈部鳞状细胞癌、黑色素瘤、肺癌、恶性毒瘤、泌尿系肿瘤)的潜在活性[37]。姜黄素的多项临床试验已经完成,并陆续有相关文献报道[38]。临床试验显示,姜黄素对家族性腺瘤性息肉病、晚期胰腺癌、多发性骨髓瘤患者有效[39]。
4.2作用机制 姜黄素具有抑制肿瘤转化、增殖、转移的作用。大量的研究表明,姜黄素调控多种生物化学传导路径并与多个致癌靶标作用。姜黄素是多种转录因子的抑制剂(包括 NF-κB、AP-1、STAT蛋白质、PPAR-γ、β-连环蛋白[40]。姜黄素还具有抑制多个激酶(例如EGFR、ERK、JAK、PKC等激酶 )活性的作用。此外,姜黄素还可以有效抑制多种调控肿瘤细胞生长增殖的相关酶(例如MMP、iNOS、GST等)、细胞因子(例如TNF、IL、MIP、MCP)和生长因子(例如EGF、NGF、HGF、PDGF)的活性,并能有效抑制多种受体(例如H2-R、IL-8R等)的表达[37]。 姜黄素的多靶点抗肿瘤活性的特征将会使其成为具有潜力的抗肿瘤药物。
4.3构效关系 姜黄素构效关系的研究主要集中在芳基上的取代基、1,3-二酮结构和简化二桂皮酰甲烷的药效团。构效关系研究表明,具有呋喃基的姜黄素类似物对硫氧还蛋白还原酶(TrxR)具有不可逆转的抑制作用,这表明在姜黄素类似物与TrxR作用时,呋喃部分可能是药效团[41]。姜黄素连接上水溶性的聚乙二醇分子后细胞毒性增强[42]。最近的研究表明,含有戊二烯酮的姜黄素类似物对恶性肿瘤细胞增生的抑制活性是姜黄素的2~50倍。
5 荜茇酰胺 (piperlongumine)
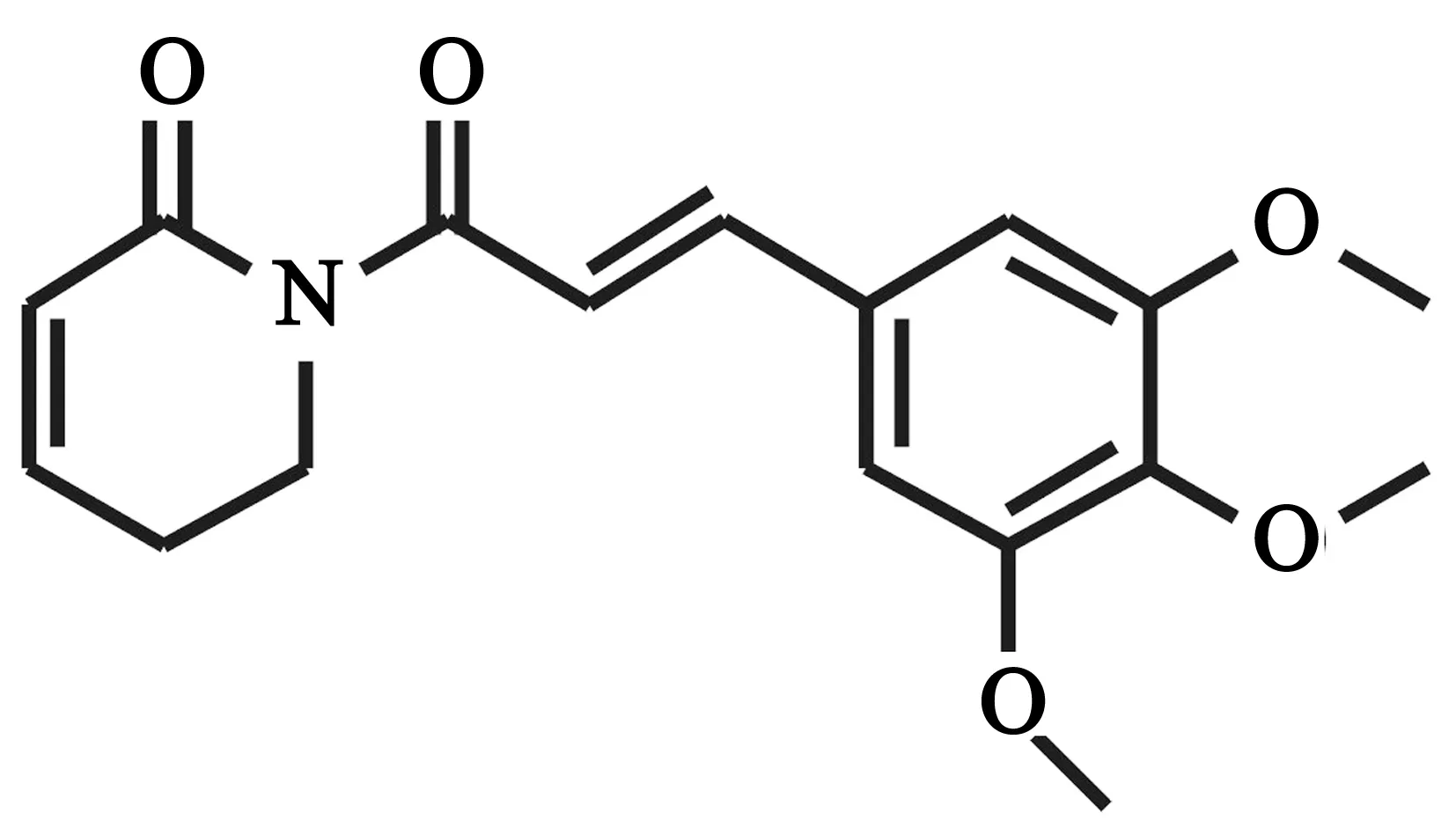
图5 荜茇酰胺的化学结构式(5)
荜茇酰胺(又称荜茇明碱,piplartine)是一种来自于胡椒科植物荜茇果穗的天然产物,荜茇酰胺具有反式和顺式两种结构,反式结构的活性优于顺式结构。
荜茇酰胺具有很多功效,例如抗血小板凝集、抗焦虑、抗抑郁、抗真菌、抗血吸虫等。研究人员通过细胞筛选及功能蛋白组学研究,发现荜茇酰胺能针对性地杀灭肿瘤细胞而无损于正常细胞[43]。荜茇酰胺可以通过抑制肿瘤细胞的增殖,促进肿瘤细胞凋亡,对多种肿瘤具有抑制作用。
5.1抗肿瘤活性 荜茇酰胺的抗肿瘤作用在动物实验中得到了证实。 Bezerra等[44]通过雌性Swiss小鼠移植S180模型研究荜茇酰胺的抗肿瘤作用,对肝、脾、肾等器官进行组织病理学和形态学分析以评价荜茇酰胺的毒理学性质。研究发现荜茇酰胺可以抑制实体瘤的生长,低浓度荜茇酰胺可引起白血病细胞的凋亡,而高浓度则可导致细胞坏死[45]。荜茇酰胺同样能抑制乳腺癌细胞的增殖及转移。该化合物能有效灭杀异体移植瘤小鼠体内的肿瘤细胞,而对正常小鼠无损伤[43]。在注射了人类膀胱癌、乳腺癌、黑色素瘤和肺癌癌细胞的小鼠模型中,荜茇酰胺对肿瘤的生长具有抑制作用,但对正常小鼠没有毒副反应。Golovine等[46]的研究表明,通过蛋白体酶调控的活性氧(ROS)机制,微摩尔级浓度的荜茇酰胺能有效迅速地减少人前列腺肿瘤细胞中雄激素受体蛋白的水平,并且同时能够有效抑制雄性激素受体的转录活性和前列腺癌细胞增殖。荜茇酰胺与5-氟尿嘧啶(5-FU)联用不仅能增强药效,同时还可以改善5-FU引起的免疫力下降问题[47]。
5.2作用机制 荜茇酰胺可以通过活性氧来抑制肿瘤,它能在升高ROS水平的同时促使肿瘤细胞凋亡[43]。
5.3构效关系 荜茇酰胺抗肿瘤的构效关系如下:α,β-不饱和羰基部分在细胞毒方面具有重要作用;二亚甲氧基苯基与抗肿瘤活性有关; 反式荜茇酰胺比顺式荜茇酰胺抗肿瘤活性强。
6 总结和展望
来源于天然产物的抗肿瘤药物在人类治疗肿瘤过程中发挥着重要的作用,但在研究开发有效的天然源抗肿瘤药物过程中仍存在着很多困难。首先,一些抗肿瘤药物虽然抗肿瘤效果好,但由于其资源的有限性,限制了它们的使用范围。其次,很多的抗肿瘤药物虽然已经应用于临床,但还存在着一些缺陷,如选择性差、毒副作用、耐药性等。再次,天然产物抑制肿瘤细胞生长或诱导其凋亡多来源于体外实验,但体内实验情况相当复杂,其作用机制还不是很明确。鉴于以上的困难,应加强利用生物合成、半合成、化学全合成方法对天然源抗肿瘤药物进行结构修饰,以获得低毒性、高活性的抗肿瘤候选新药。进一步研究天然抗肿瘤药物作用机制仍然是今后药学研究者的努力方向。有理由相信,随着人们对天然产物研究的深入,必将会研发出更多的抗肿瘤药物应用于临床。
【参考文献】
[1] Newman DJ, Cragg GM. Natural products as sources of new drugs over the last 25 years[J]. J Nat Prod ,2007, 70 (3):461-477.
[2] Kessler JH, Mullauer FB, de Roo GM,etal. Broadinvitroefficacy of plant-derived betulinic acid against cell lines derived from the most prevalent human cancer types[J]. Cancer Lett ,2007, 251 (1):132-145.
[3] Zuco V, Supino R, Righetti SC,etal. Selective cytotoxicity of betulinic acid on tumor cell lines, but not on normal cells[J]. Cancer Lett,2002, 175 (1):17-25.
[4] Chintharlapalli S, Papineni S, Ramaiah SK,etal. Betulinic acid inhibits prostate cancer growth through inhibition of specificity protein transcription factors[J]. Cancer Res,2007, 67 (6):2816-2823.
[5] Mertens-Talcitt SU, Noratto GD, Li X,etal. Betulinic acid decreases ER-negative breast cancer cell growthinvitroandinvivo: role of Sp transcription factors and microRNA-27a:ZBTB10[J]. Mol Carcinog, 2012Mar7,doi: 10.1002/mc.21893.
[6] Eichenmuller M, Hemmerlein B, Von Schweinits D,etal. Betulinic acid induces apoptosis and inhibits hedgehog signalling in rhabdomyosarcoma[J]. Br J Cancer, 2010, 103 (1):43-51.
[7] Liu X, Jutooru I, Lei P,etal. Betulinic acid targets YY1 and ErbB2 through cannabinoid receptor-dependent disruption of microRNA-27a:ZBTB10 in breast cancer[J]. Mol Cancer Ther, 2012, 11 (7):1421-1431.
[8] Kama E,Szoka L, Palka JA,etal. Betulinic acid inhibits the expression of hypoxia-inducible factor 1alpha and vascular endothelial growth factor in human endometrial adenocarcinoma cells[J]. Mol Cell Biochem, 2010, 340 (1-2):15-20.
[9] Pandey MK, Sung B, Aggarwail BB,etal. Betulinic acid suppresses STAT3 activation pathway through induction of protein tyrosine phosphatase SHP-1 in human multiple myeloma cells[J]. Int J Cancer, 2010, 127 (2):282-292.
[10] Liu Y, Luo W. Betulinic acid induces Bax/Bak-independent cytochrome C release in human nasopharyngeal carcinoma cells[J]. Mol Cells, 2012, 33 (5):517-524.
[11] Yogeeswari P, Sriram D. Betulinic acid and its derivatives: a review on their biological properties[J]. Curr Med Chem, 2005, 12 (6):657-666.
[12] Eiznhamer DA, Xu ZQ. Betulinic acid: a promising anticancer candidate[J]. I Drugs, 2004, 7 (4):359-373.
[13] Chintharlli S, Papineni S, Lei P,etal. Betulinic acid inhibits colon cancer cell and tumor growth and induces proteasome-dependent and-independent downregulation of specificity proteins (Sp) transcription factors[J]. BMC Cancer, 2011, 11:371.
[14] Mukheijee R, Kumar V, Srivastava SK,etal. Betulinic acid derivatives as anticancer agents: structure activity relationship[J]. Anticancer Agents Med Chem, 2006, 6 (3):271-279.
[15] Urban M, Vlkm M, Dzubak P,etal. Cytotoxic heterocyclic triterpenoids derived from betulin and betulinic acid[J]. Bioorg Med Chem, 2012, 20 (11):3666-3674.
[16] Ahmad FB, Ghaffari Moghaddam M,Basri M,etal. Anticancer activity of 3-O-acylated betulinic acid derivatives obtained by enzymatic synthesis[J]. Biosci Biotechnol Biochem, 2010, 74 (5):1025-1029.
[17] Kundu JK,Surh YJ. Cancer chemopreventive and therapeutic potential of resveratrol: mechanistic perspectives[J]. Cancer Lett, 2008, 269 (2):243-261.
[18] Jang M, Cai L, Udeani GO,etal. Cancer chemopreventive activity of resveratrol, a natural product derived from grapes[J]. Science, 1997, 275 (5297):218-220.
[19] Kundu JK, Surh YJ. Molecular basis of chemoprevention by resveratrol: NF-kappaB and AP-1 as potential targets[J]. Mutat Res, 2004, 555 (1-2):65-80.
[20] Garg AK, Buchholz TA, Aggarwal BB. Chemosensitization and radiosensitization of tumors by plant polyphenols[J]. Antioxid Redox Signal, 2005, 7 (11-12):1630-1647.
[21] Bhardwaj A, Sethi G, Vadhan-Raj S,etal. Resveratrol inhibits proliferation, induces apoptosis, and overcomes chemoresistance through down-regulation of STAT3 and nuclear factor-kappaB-regulated antiapoptotic and cell survival gene products in human multiple myeloma cells[J]. Blood ,2007, 109 (6):2293-2302.
[22] Cai YJ, Wei QY, Fang JG,etal. The 3,4-dihydroxyl groups are important for trans-resveratrol analogs to exhibit enhanced antioxidant and apoptotic activities[J]. Anticancer Res, 2004, 24 (2B):999-1002.
[23] Hung LM, Su MJ, Chu WK,etal. The protective effect of resveratrols on ischaemia-reperfusion injuries of rat hearts is correlated with antioxidant efficacy[J]. Br J Pharmacol, 2002, 135 (7):1627-1633.
[24] Saiko P, Szakmary A, Jaeger W,etal. Resveratrol and its analogs: defense against cancer, coronary disease and neurodegenerative maladies or just a fad? [J]. Mutat Res, 2008, 658 (1-2):68-94.
[25] Jiang GJ, Hu C. Evodiamine: a novel anti-cancer alkaloid from Evodia rutaecarpa[J]. Molecules, 2009, 14 (5):1852-1859.
[26] Liao CH, Pan SL,Guh JH,etal.Antitumor mechanism of evodiamine, a constituent from Chinese herb Evodiae fructus, in human multiple-drug resistant breast cancer NCI/ADR-RES cellsinvitroandinvivo[J]. Carcinogenesis, 2005, 26 (5):968-975.
[27] Zhang C, Fan X, Xu X,etal. Evodiamine induces caspase-dependent apoptosis and S phase arrest in human colon lovo cells[J]. Anticancer Drugs, 2010, 21 (8):766-776.
[28] Liao CH, Pan SL, Guh JH,etal. Antitumor mechanism of evodiamine, a constituent from Chinese herbEvodiaefructus, in human multiple-drug resistant breast cancer NCI/ADR-RES cellsinvitroandinvivo[J]. Carcinogenesis, 2005, 26 (5):968-975.
[29] Lee TJ, Kim EJ, Kim S,etal. Caspase-dependent and caspase-independent apoptosis induced by evodiamine in human leukemic U937 cells[J]. Mol Cancer Ther, 2006, 5 (9):2398-2407.
[30] Takada Y, Kobaysshi Y, Aggarwal BB. Evodiamine abolishes constitutive and inducible NF-kappaB activation by inhibiting IkappaBalpha kinase activation, thereby suppressing NF-kappaB-regulated antiapoptotic and metastatic gene expression, up-regulating apoptosis, and inhibiting invasion[J]. J Biol Chem, 2005, 280 (17):17203-17212.
[31] Yang ZG, Chen AQ, Liu B. Antiproliferation and apoptosis induced by evodiamine in human colorectal carcinoma cells (COLO-205)[J]. Chem Biodivers, 2009, 6 (6):924-933.
[32] Huang H, Zhang Y, Liu X,etal. Acid sphingomyelinase contributes to evodiamine-induced apoptosis in human gastric cancer SGC-7901 cells[J]. DNA Cell Biol, 2011, 30 (6):407-412.
[33] Rasul A, Yu B, Zhong L,etal. Cytotoxic effect of evodiamine in SGC-7901 human gastric adenocarcinoma cells via simultaneous induction of apoptosis and autophagy[J]. Oncol Rep, 2012, 27 (5):1481-1487.
[34] Wei WT, Chen H, Wang ZH,etal. Enhanced antitumor efficacy of gemcitabine by evodiamine on pancreatic cancer via regulating PI3K/Akt pathway[J]. Int J Biol Sci, 2012, 8 (1):1-14.
[35] Dong G, Sheng C, Wang S,etal. Selection of evodiamine as a novel topoisomerase I inhibitor by structure-based virtual screening and hit optimization of evodiamine derivatives as antitumor agents[J]. Med Chem, 2010,53 (21):7521-7531.
[36] Sheng C, Miao Z, Zhang W. New strategies in the discovery of novel non-camptothecin topoisomerase I inhibitors[J]. Curr Med Chem, 2011, 18(28):4389-4409.
[37] Anand P, Sundaram C, Jhurani S,etal. Curcumin and cancer: an “old-age” disease with an “age-old” solution[J]. Cancer Lett, 2008, 267 (1):133-164.
[38] Goel A, Kunnumakkara AB, Aggarwal BB. Curcumin as “Curecumin”: from kitchen to clinic[J]. Biochem Pharmacol, 2008, 75 (4):787-809.
[39] Aggarwal BB, Harikumar KB. Potential therapeutic effects of curcumin, the anti-inflammatory agent, against neurodegenerative, cardiovascular, pulmonary, metabolic, autoimmune and neoplastic diseases[J]. Int J Biochem Cell Biol, 2009, 41 (1):40-59.
[40] Shishodia S, Singh T, Chaturvedi MM. Modulation of transcription factors by curcumin[J]. Adv Exp Med Biol, 2007, 595:127-148.
[41] Qiu X, Liu Z, Shao WY,etal. Synthesis and evaluation of curcumin analogues as potential thioredoxin reductase inhibitors[J]. Bioorg Med Chem, 2008, 16 (17):8035-8041.
[42] Safavy A, Raisch KP, Mantena S,etal. Design and development of water-soluble curcumin conjugates as potential anticancer agents[J]. J Med Chem, 2007, 50 (24):6284-6288.
[43] Raj L, Ide T, Chrkar AU,etal. Selective killing of cancer cells by a small molecule targeting the stress response to ROS[J]. Nature, 2011, 475 (7355):231-234.
[44] Bazerra DP, Castro FO,Alves AP,etal.Invivogrowth-inhibition of sarcoma 180 by piplartine and piperine, two alkaloid amides from Piper[J]. Braz J Med Biol Res, 2006, 39 (6):801-807.
[45] Bezerra DP, Militao GC, de Castro FO,etal.Piplartine induces inhibition of leukemia cell proliferation triggering both apoptosis and necrosis pathways[J]. ToxicolInVitro, 2007, 21 (1):1-8.
[46] Golowine KV, Makhov PB, Teper E,etal. Piperlongumine induces rapid depletion of the androgen receptor in human prostate cancer cells[J]. Prostate, 2013, 73(1):23.
[47] Bezeera DP, de Castro FO, Alves AP,etal.Invitroandinvivoantitumor effect of 5-FU combined with piplartine and piperine[J]. J Appl Toxicol, 2008, 28 (2):156-163.

