长链非编码RNA HOTAIR在食管鳞癌中的表达及意义
张曌玥,尹越,牟笑,吴诗,毛朝明,陈德玉
(1.江苏大学临床医学院,江苏镇江212001;2.江苏大学附属医院核医学科,江苏镇江212001;3.江苏大学附属医院放疗科,江苏镇江212001)
长链非编码RNA HOTAIR在食管鳞癌中的表达及意义
张曌玥1,尹越1,牟笑1,吴诗1,毛朝明2,陈德玉3
(1.江苏大学临床医学院,江苏镇江212001;2.江苏大学附属医院核医学科,江苏镇江212001;3.江苏大学附属医院放疗科,江苏镇江212001)
目的:研究食管鳞癌患者长链非编码RNA HOTAIR(long non-coding RNA HOTAIR,lncRNA HOTAIR)的表达、临床意义及其与转化生长因子β1(TGF-β1)间的关系。方法:实时荧光定量PCR技术检测57例食管鳞癌患者癌组织与癌旁组织中HOTAIR及TGF-β1mRNA的表达水平,分析HOTAIRmRNA表达与患者临床病理特征的关系。结果:食管鳞癌组织中HOTAIR mRNA表达较癌旁组织明显升高(Z=-2.507,P=0.012),TGF-β1mRNA表达明显降低(Z=-2.038,P=0.042)。癌组织中HOTAIR mRNA表达与肿瘤分化程度及临床分期有关,与TGF-β1mRNA表达呈负相关(r=-0.406,P=0.002)。结论:lncRNA HOTAIR与食管鳞癌的发生发展及其恶性程度显著相关,可能通过TGF-β1通路起作用。
HOTAIR;转化生长因子β1;食管鳞癌
长链非编码RNA(long non-coding RNAs,lnc-RNAs)是一类转录本长度超过200 bp的RNA分子,本身并不编码蛋白质,而是以RNA的形式在表观遗传调控、转录调控以及转录后调控等多种层面上调控基因的表达水平[1]。现有的研究发现,lnc-RNAs在包括肿瘤在内的多种疾病中存在异常表达,且可能与疾病的发生发展有着密切的联系[2-5]。HOTAIR是lncRNAs的成员之一,转录本长度为2.2 kb,定位在人类12q13.13上HOXC位点,不编码任何蛋白质[6]。有研究表明,HOTAIR在原发性与转移性乳腺癌中表达上调,且其高表达与乳腺癌转移和不良预后呈正相关[7]。还有一些研究显示,HOTAIR在胃肠道间质瘤[8]、胰腺癌[9]、结直肠癌[10]、肝癌[11]、鼻咽癌[12]中高表达,并且与肿瘤的转移及不良预后有潜在关系。
多梳齿状复合物2(polycomb repressive complex 2,PRC2)是多梳蛋白家族基因的一员,可通过修饰染色质结构来维持基因的转录抑制。有研究表明,HOTAIR可以通过连接PRC2和组蛋白去甲基酶LSD1来沉默HOXD位点的转录[10]。而作为PRC2靶基因的细胞周期调控相关基因受转化生长因子β1(transforming growth factorβ1,TGF-β1)的调控。因此我们猜测,HOTAIR或许与TGF-β1间存在着某种相关性。目前仅有少数文献研究食管癌中HOTAIR的表达[13],因此,关于HOTAIR在食管鳞癌中的表达情况及作用机制还有待进一步研究。本研究采用实时荧光定量PCR法检测HOTAIR mRNA在食管鳞癌组织中的表达,并分析其与临床病理参数间的关系,探讨其与TGF-β1间潜在的关系。
1 材料和方法
1.1 材料
1.1.1 组织标本 57例食管鳞癌组织与癌旁组织(距肿块边缘3~5 cm)均取自2012年4月至2013年5月江苏大学附属医院胸外科食管癌手术患者,术后均经病理诊断确诊为鳞癌,切缘阴性。患者年龄45~76岁,入院均行胸部X片、上消化道造影、纤维食管镜、胸部CT等检查。术前未接受任何放射或化学药物等抗肿瘤治疗。按AJCC临床分期标准:Ⅰ、Ⅱ期29例,Ⅲ、Ⅳ期28例。术后病理确诊:高、中分化43例,低分化14例。所有标本收集后迅速置-80℃冰箱保存。本实验经江苏大学附属医院伦理委员会批准,所有患者均在手术前签署书面同意书。
1.1.2 试剂和仪器 Trizol®(美国Invitrogen公司)、PrimeScriptTMRT reagent Kit(TaKaRa公司)、SYBR®Premix Ex TaqTM(TaKaRa公司)、引物由美国Invitrogen公司设计合成。BIOMATE 3S紫外/可见光分光光度计(美国THERMO公司)、My Cycler梯度PCR仪(美国Bio-rad公司),Mx3000p Real Time PCR仪(美国Stratagene公司)。
1.2 方法
1.2.1 总RNA提取 食管鳞癌与癌旁组织从-80℃冰箱取出后迅速称重,取100 mg组织,按Trizol说明书进行提取,最后用DEPC水溶解RNA。提取的RNA用分光光度计检测其浓度和纯度。
1.2.2 cDNA反转录合成 按反转录试剂盒说明书,以10μL反应体系进行cDNA反转录合成。反应条件为37℃15 min、85℃5 s,-20℃保存备用。
1.2.3 实时荧光定量PCR HOTAIR上游引物:5′-GGTAGAAAAAGCAACCACGAAGC-3′,下游引物:5′-ACATAAACCTCTGTCTGTGAGTGCC-3′,产物长度为170 bp[7]。TGF-β1上游引物:5′-CTAATGGTGGAAACCCACAACG-3′,下游引物:5′-TATCGCCAGGAATTGTTGCTG-3′,产物长度为209 bp。GAPDH上游引物:5′-TCAACGGATTTGGTCGTATTG-3′,下游引物:5′-TGGGTGGAATCATATTGGAAC-3′,产物长度为136 bp。按实时荧光定量PCR试剂盒说明书,以25μL反应体系进行扩增,阴性对照用2μL DEPC处理的超纯水代替cDNA模板。反应条件:95℃30 s 1个循环,95℃5 s,55℃20 s,40个循环。实时荧光定量PCR结果用2-ΔΔCt法进行分析。其中ΔΔCt=ΔCt(癌组织)-ΔCt(癌旁组织)。所有实验均重复3次,取3次结果的平均值为实验结果。
1.3 统计学处理
采用SPSS 20.0统计软件进行统计分析,HOTAIR mRNA及TGF-β1mRNA相对表达量为非正态分布资料,计量资料以中位数(四分位数间距)表示,配对样本采用非参数Wilcoxon符号秩和检验,独立样本采用Mann-Whitney U和Kruskal-Wallis检验。HOTAIR与TGF-β1相对表达量经log2正态性转换后,进行Pearson相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 实时荧光定量PCR产物电泳检测结果
所有标本总RNA提取后进行光密度检测,纯度较好,D(260 nm)/D(280 nm)值在1.8~2.0之间。阴性对照无扩增曲线。PCR产物通过2%琼脂糖凝胶电泳检测,于170 bp及209 bp处出现特异性目标条带(图1)。
2.2 实时荧光定量PCR检测结果
食管鳞癌组织中HOTAIRmRNA表达高于癌旁组织(Z=-2.507,P=0.012),TGF-β1mRNA表达低于癌旁组织(Z=-2.038,P=0.042)。见图2。

图1 HOTAIR及TGF-β1 PCR产物电泳检测结果
2.3 HOTAIR mRNA表达与食管鳞癌患者临床病理特征的关系
HOTAIR mRNA表达与肿瘤分化程度(P= 0.041)及患者临床分期有关(P=0.041),与性别、年龄、肿块的部位与大小、淋巴结转移无统计学相关(P>0.05)。TGF-β1mRNA表达与肿瘤分化程度(P=0.010)、淋巴结转移(P=0.041)、临床分期(P=0.044)有关,与性别、年龄、肿块的部位与大小无统计学相关(P>0.05),见表1。

图2 HOTAIR与TGF-β1 mRNA在食管鳞癌组织中的表达
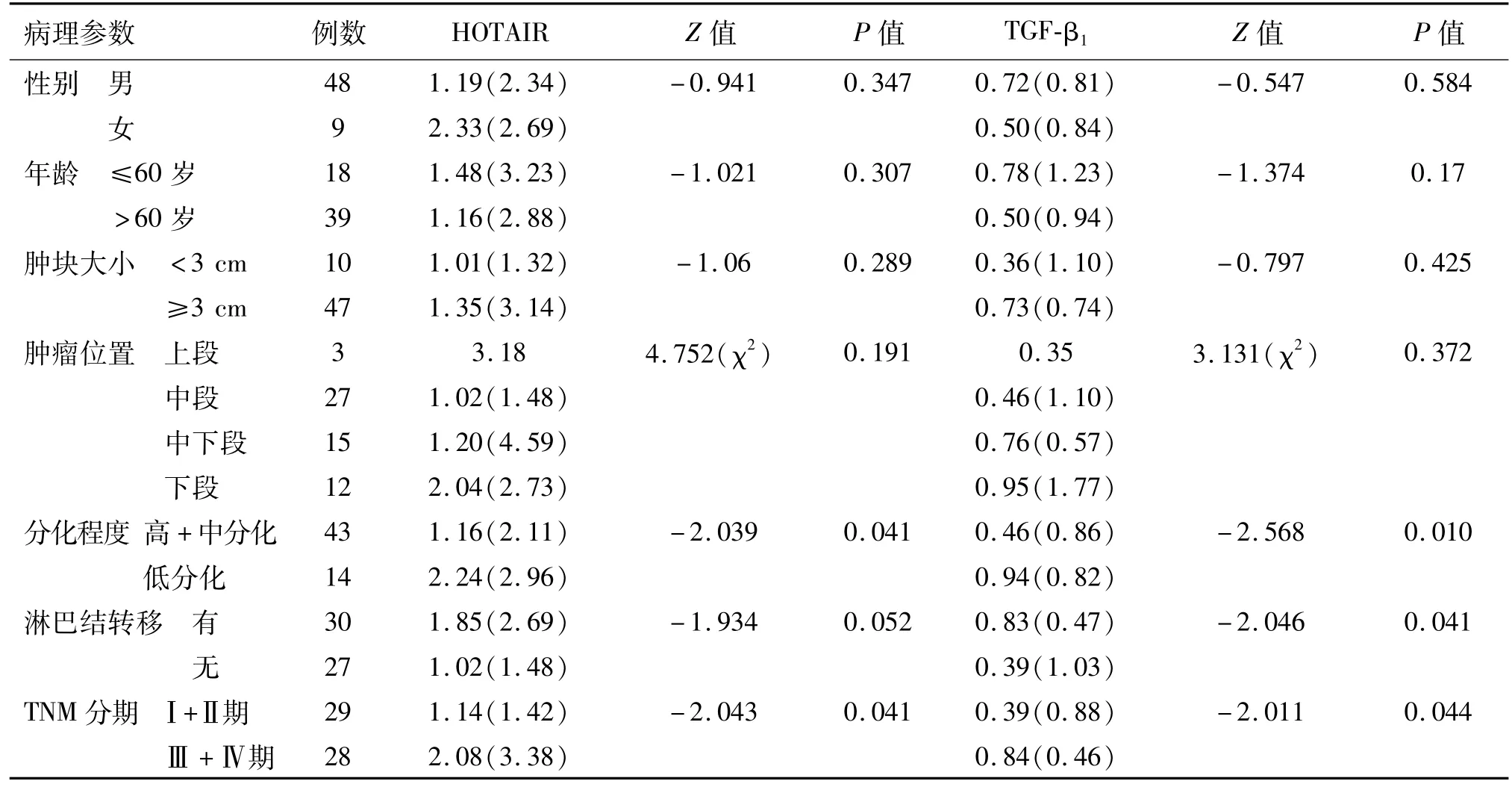
表1 HOTARI和TGF-β1 m RNA与食管鳞癌患者临床病理特征的关系 M(QR)
2.4 HOTAIR与TGF-β1间的相关性
相关分析结果表明,在食管鳞癌组织中,HOTAIR mRNA表达与TGF-β1呈负相关(r=-0.406,P=0.002),见图3。
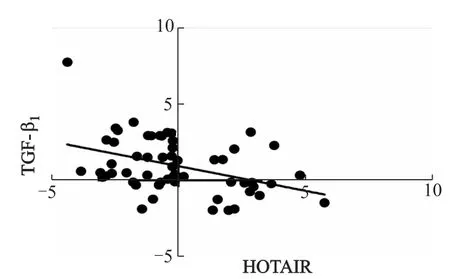
图3 食管鳞癌组织中HOTAIR与TGF-β1 mRNA表达的相关性
3 讨论
lncRNA HOTAIR是人类12号染色体HOXC基因簇的一条反义链,能募集哺乳动物PRC2(主要由H3K27me3、SUZ12、EZH2和EED组成),并将其定位于2号染色体HOXD位点,进而沉默该基因座基因转录[6-7,14]。另外,HOXD也能与CoREST/REST共抑制复合物(包含LSD1)结合[15]。因此,HOTAIR用其5′端与PRC2结合,负责H3K27甲基化,而3′端绑定LSD1复合物,介导H3K4me2去甲基化,从而沉默HOXD基因[16-17]。以上机制也分别在乳腺癌[7]、结直肠癌[10]中被验证。还有一些研究表明HOTAIR对snail蛋白[1]、PTEN[18]也有作用。因此,HOTAIR的准确机制仍有待阐明。
本研究从食管鳞癌着手,比较分析了食管鳞癌组织与癌旁组织中HOTAIR mRNA的表达情况,结果显示,与癌旁组织相比,HOTAIR mRNA在食管鳞癌组织中表达升高,且其表达随着肿瘤分化程度的降低和临床分期的进展而增高,这表明HOTAIR的高表达不仅与食管鳞癌的恶性程度有关,且可能参与了食管鳞癌的发生发展。
我们在前面提到,PRC2的靶基因同时也受TGF-β1的调控。因此我们猜测HOTAIR与TGF-β1间存在着某种相关性,从而从另一条通路来调控下游靶基因的表达。我们的结果表明,TGF-β1作为重要的肿瘤抑制物,在食管鳞癌组织中的表达要低于癌旁组织,且与肿瘤的恶性程度、临床分期、淋巴结转移均有关系。同时,相关性分析结果显示,在食管鳞癌组织中,HOTAIR mRNA表达与TGF-β1呈负相关。
TGF-β1对肿瘤的生长呈抑制作用,TGFβ/Smads信号转导通路是TGF-β1发挥生物学功能的主要通路,通路中任一元件发生突变都将会影响信号的传递,使细胞逃避TGF-β1介导的生长抑制作用,从而具有选择性生长优势,导致肿瘤的发生与发展[19]。我们的结果表明,HOTAIR很可能是通过抑制TGF-β1的生物学功能来促进食管鳞癌的发生发展,但其作用机制尚需进一步探讨和验证。
综上所述,lncRNA HOTAIR的异常高表达可能参与了食管鳞癌的发生发展,且可能是通过TGF-β1实现其对食管鳞癌组织的促进作用。下一步我们将从体内体外两方面进一步验证HOTAIR在食管鳞癌中的作用,探讨其与TGF-β1负相关的具体分子机制,希望能为食管鳞癌的发生发展机制提供一个新的思路。
[1] 杨韬,李俊堂,王丽娟,等.干涉lncRNAs HOTAIR对人乳腺癌细胞MDA-MB-231的影响[J].细胞与分子免疫学杂志,2012,28(1):97-98.
[2] Ji P,Diederichs S,WangW,etal.MALAT-1,a novel noncoding RNA,and thymosinβ4 predict metastasis and survival in early-stage non-small cell lung cancer[J].Oncogene,2003,22(39):8031-8041.
[3] Chen FJ,Sun M,Li SQ,etal.Upregulation of the long non-coding RNA HOTAIR promotes esophageal squamous cell carcinomametastasis and poor prognosis[J].Mol Carcinog,2013,52(11):908-915.
[4] Li X,Wu Z,MeiQ,et al.Long non-coding RNA HOTAIR,a driver ofmalignancy,predicts negative prognosis and exhibits oncogenic activity in oesophageal squamous cell carcinoma[J].Br JCancer,2013,109(8):2266-2278.
[5] Wang CM,Wu QQ,Li SQ,et al.Upregulation of the long non-coding RNA PlncRNA-1 promotes esophageal squamous carcinoma cell proliferation and correlateswith advanced clinical stage[J].Dig Dis Sci,2014,59(3):591-597.
[6] Rinn JL,Kertesz M,Wang JK,et al.Functional demarcation of active and silent chromatin domains in human HOX loci by noncoding RNAs[J].Cell,2007,129(7):1311-1323.
[7] Gupta RA,Shah N,Wang KC,et al.Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis[J].Nature,2010,464(7291):1071-1076.
[8] Niinuma T,SuzukiH,Nojima M,etal.Upregulation of miR-196a and HOTAIR drive malignant character in gastrointestinal stromal tumors[J].Adv Cancer Res,2012,72(5):1126-1136.
[9] Kim K,Jutooru I,Chadalapaka G,et al.HOTAIR is a negative prognostic factor and exhibits pro-oncogenic activity in pancreatic cancer[J].Crit Rev Oncog,2013,32(13):1616-1625.
[10] Kogo R,Shimamura T,Mimori K,et al.Long noncoding RNA HOTAIR regulates polycomb-dependent chromatin modification and is associated with poor prognosis in colorectal cancers[J].Adv Cancer Res,2011,71(20):6320-6326.
[11] Yang Z,Zhou L,Wu LM,etal.Overexpression of long non-coding RNA HOTAIR predicts tumor recurrence in hepatocellular carcinoma patients following liver transplantation[J].Ann Surg Oncol,2011,18(5):1243-1250.
[12] Nie Y,Liu X,Qu S,et al.Long non-coding RNA HOTAIR is an independent prognostic marker for nasopharyngeal carcinoma progression and survival[J].Cancer Sci,2013,104(4):458-464.
[13] 连贵勇,王铭辉,姜明,等.长链非编码RNA HOTAIR在食管鳞状细胞癌中的表达及意义[J].岭南现代临床外科,2012,12(6):407-409.
[14] Kaneko S,Li G,Son J,et al.Phosphorylation of the PRC2 component Ezh2 is cell cycle-regulated and upregulates its binding to ncRNA[J].Genes Dev,2010,24(23):2615-2620.
[15] Lunyak VV,Burgess R,Prefontaine GG,et al.Corepressor-dependent silencing of chromosomal regions encoding neuronalgenes[J].Science,2002,298(5599):1747-1752.
[16] Tsai MC,Manor O,Wan Y,et al.Long noncoding RNA asmodular scaffold of histonemodification complexes[J].Science,2010,329(5992):689-693.
[17] Hayami S,Kelly JD,Cho HS,et al.Overexpression of LSD1 contributes to human carcinogenesis through chromatin regulation in various cancers[J].Int J Cancer,2011,128(3):574-586.
[18] Li D,Feng J,Wu T,et al.Long intergenic noncoding RNA HOTAIR is overexpressed and regulates PTEN methylation in laryngeal squamous cell carcinoma[J].Diagn Mol Pathol,2013,182(1):64-70.
[19] de la Cruz-Merino L,Henao-Carrasco F,Garc a-Manrique T,et al.Role of transforming growth factorβin cancermicroenvironment[J].Clin Transl Oncol,2009,11(11):715-720.
Expression and clinical significance of long non-coding RNA HOTAIR in patients w ith esophageal squamous cell carcinoma
ZHANG Zhao-yue1,YIN Yue1,MOU Xiao1,WU Shi1,MAO Chao-ming2,CHEN De-yu3
(1.School of Clinical Medicine,Jiangsu University,Zhenjiang Jiangsu 212001;2.Department of Nuclear Medicine,the Affiliated Hospital of Jiangsu University,Zhenjiang Jiangsu 212001;3.Department of Radiation Oncology,the Affiliated Hospital of Jiangsu University,Zhenjiang Jiangsu 212001,China)
Objective:To explore the expression and clinical significance of long non-coding RNA HOTAIR(lncRNA HOTAIR)in esophageal squamous cell carcinoma(ESCC)and analyze its correlation with transforming growth factorβ1(TGF-β1).M ethods:Quantitative real-time polymerase chain reaction was used to detect the expressions of HOTAIRmRNA and TGF-β1mRNA in 57 ESCC tissues and matched tumor-free tissues.The relationship between HOTAIRmRNA and clinico-pathological features of ESCCwas also analyzed.Results:In comparison tomatched tumor-free tissues,the expressions of HOTAIR mRNA(Z=-2.507,P=0.012)and TGF-β1mRNA(Z=-2.038,P=0.042)were found to be elevated and lowered,respectively,in ESCC tissues.Up-regulation of HOTAIR expression was correlated with tumor differentiation degree and clinical stage.The expression of HOTAIR was negative correlated with TGF-β1(r=-0.406,P=0.002).Conclusion:lncRNA HOTAIR in ESCC tissuesmay play a significant role in the occurrence and development of ESCC through TGF-β1signaling pathways.
HOTAIR;transforming growth factorβ1;esophageal squamous cell carcinoma
R735.1
A
1671-7783(2014)03-0260-04
10.13312/j.issn.1671-7783.y140007
镇江市社会发展支撑计划项目(SH2011019;SH2012023)
张曌玥(1988—),女,硕士研究生;陈德玉(通讯作者),教授,主任医师,E-mail:cdeyu@hotmail.com
2014-01-07 [编辑] 何承志

