外源性一氧化碳释放分子2对脓毒症小鼠肝脏能量代谢的调控作用及机制
梁峰,孙炳伟,王旭,秦魏婷,刘大东,仇雪枫
(江苏大学附属医院烧伤整形科,江苏镇江212001)
外源性一氧化碳释放分子2对脓毒症小鼠肝脏能量代谢的调控作用及机制
梁峰,孙炳伟,王旭,秦魏婷,刘大东,仇雪枫
(江苏大学附属医院烧伤整形科,江苏镇江212001)
目的:观察脓毒症小鼠肝脏能量代谢的变化,同时探讨外源性一氧化碳释放分子2(carbon monoxide-releasingmolecules-2,CORM-2)对其调控及作用机制。方法:将48只C57BL/6小鼠随机均分成对照组,盲肠结扎穿孔(CLP)组,CORM-2组,无活性CORM-2(inactivated CORM-2,iCORM-2)组。采用CLP术制作脓毒症模型,对照组不作任何处理,CORM-2组和iCORM-2组除术后使用CORM-2或无活性CORM-2外,其余处理同CLP组,术后72 h内连续监测各组12只小鼠血糖浓度的动态变化及存活情况。另选32只小鼠分组同上,术后24 h收集肝脏组织及血浆,检测肝组织的18F-FDG分布、葡萄糖激酶活性、乳酸含量,全自动生化分析仪检测血浆丙氨酸转氨酶(ALT),天冬氨酸转氨酶(AST)。结果:与对照组比较,CLP组葡萄糖代谢水平增强,葡萄糖激酶、AST、ALT活性以及乳酸含量均明显增高(P均<0.05);CORM-2干预后上述指标明显降低(P均<0.05)。与对照组比较,各手术组小鼠血糖在术后36 h内持续下降,且组间差异无统计学意义。结论:CORM-2能明显减少脓毒症小鼠肝18F-FDG摄取、葡萄糖激酶活性和乳酸含量,从而改善脓毒症小鼠肝脏能量代谢紊乱,提高生存率。
一氧化碳释放分子2;脓毒症;肝脏;18F-FDG
脓毒症是由感染引起的炎症反应综合征,进一步发展可导致严重脓毒症、脓毒性休克及多器官功能障碍,病死率仍居高不下[1]。肝脏能量代谢紊乱是导致脓毒症高病死率的重要原因。在脓毒症早期就可出现血糖升高,并且与预后密切相关[2]。我们的前期研究已证实外源性一氧化碳能抑制脓毒症时严重的炎症反应所导致的多器官功能衰竭[3-4],但其对脓毒症时肝脏能量代谢紊乱的调控作用未见报道。本研究采用小鼠盲肠结扎穿孔术(cecal ligation and puncture,CLP)制备脓毒症模型,尾静脉注射外源性一氧化碳释放分子2(carbon monoxide-releasing molecules-2,CORM-2)进行早期干预,观察脓毒症时小鼠肝脏能量代谢的变化,同时探讨CORM-2对其影响并分析作用机制。
1 材料与方法
1.1 主要仪器与试剂
γ计数器(PE/1470Wizard,美国PE公司)、VMR小动物麻醉机(美国Matrx公司)、酶标仪(美国Molecular Device公司)。CORM-2(美国Sigma公司)使用前溶于二甲基亚砜,浓度为10 mmol/L,同时制备无活性CORM-2(inactivated CORM-2,iCORM-2)。18F-FDG由江苏省原子能研究所提供。小鼠葡萄糖激酶和乳酸试剂盒购自南京建成生物工程研究所。其他试剂如无特殊注明均购自美国Sigma公司。
1.2 小鼠脓毒症模型的制作及样本采集
C57BL/6雄性小鼠,体质量(20±2)g,由江苏大学动物中心提供,随机分成4组,每组12只,分别为对照组、CLP组、CORM-2和无活性CORM组(iCORM-2组)。小鼠均不限制饮食,室温(25± 2)℃,湿度45%~65%,适应性喂养7 d后进行实验。空白对照组未做特殊处理,CLP组小鼠接受CLP手术。在小鼠持续吸入2%异氟烷麻醉情况下,于其腹壁逐层切开2 cm创口,轻柔提起盲肠并于末端约1 cm处用3号丝线结扎,16号针头于结扎远端穿孔,避开较大血管并挤出适量肠腔内容物。原位回复盲肠,腹腔注射37℃生理盐水约1 mL。逐层缝合腹壁。其他手术组亦进行CLP手术并分别给予尾静脉注射CORM-2或iCORM-2(8mg/kg)。CORM-2注射浓度参考以往小鼠实验研究报道及我们课题之前的研究中所使用的浓度[3,5]。手术24 h后异氟烷吸入麻醉下心脏穿刺收集血液并完整提取肝脏,组织标本每份称取0.1 g,加入1 mL PBS后冰上超声波裂解2次,每次30 s[5]。组织匀浆4℃低温离心(12 000 r/min),取上清,-70℃保存。
1.3 小鼠生存率的检测
各受试小鼠术后分组饲养,不限饮食,每6 h观察并记录小鼠活力及死亡情况,持续72 h。
1.4 小鼠血糖的测量
分别检测并记录各组小鼠在术前及术后1,2,4,6,8,10,12,16,20,24,36,48,72 h的血糖值。检测时剪去小鼠尾部尖端2~3 mm,按摩挤压少许血液(0.5~10μL)于血糖试纸检测孔,用快速血糖仪读取数值。
1.5 小鼠肝脏18F-FDG生物分布检测
各实验组小鼠在检测前禁食24 h。尾静脉注射18F-FDG 20μCi,60 min后全部小鼠断颈处死,取完整的肝脏组织逐一称重后使用γ计数仪检测组织放射性同位素示踪剂18F-FDG含量,通过对组织重量的标准化,并计算放射性同位素的注射衰变时间,从而得出每只小鼠的标准化放射摄取值(SUV)。计算结果经过标准化处理后得到最后的SUV值[6]。
1.6 小鼠血清转氨酶,葡萄糖激酶及乳酸含量的检测
日本奥林巴斯公司AU2700全自动生化分析仪测定小鼠血清丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)活性。肝细胞葡萄糖激酶活性和乳酸的含量通过使用相应的试剂盒检测,方法参照试剂盒使用说明书。
1.7 统计学分析
信息化管理是市政工程造价控制与管理的重要实现途径,而且我国政府也比较重视信息化,也相继推出了一系列的优惠政策来推动信息化管理的实施和信息化工程的建设。但在我国现阶段的实施过程中,往往会出现工程造价不能得到真正意义的普及,而其中则存在两方面的原因:①信息化工程造价居高不下;②缺乏完善、系统的工程信息化的配套政策;有很多市政施工单位的经营理念、施工方法技术、管理模式都比较传统,也比较落后,这也导致其管理机制比较僵化,很难适应当下社会;很多施工单位都没有进行信息化管理,也没有相应的技术水平,缺乏信息化管理系统等,这些都是信息化管理问题出现的原因。
2 结果
2.1 各组小鼠的生存率
本实验通过对4个受试组共48只小鼠72 h的观察显示,CLP小鼠24 h的生存率仅为33%,48 h仅为25%。相比之下,使用CORM-2干预后的小鼠24 h生存率为72%,48 h的生存率达60%,甚至72 h后仍有20%小鼠存活。见图1。
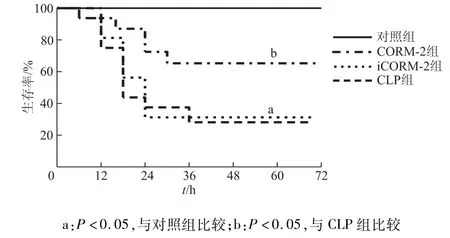
图1 4组小鼠生存曲线的比较
2.2 CORM-2对脓毒症小鼠血糖浓度的影响
CLP术后每2 h检测小鼠血糖,持续36 h。对照组小鼠血糖无明显改变,CLP组小鼠血糖在CLP术后持续降低,术后36 h下降约63%,CORM-2组和iCORM-2组小鼠未能明显改善CLP术引起的血糖降低(P均>0.05)。见图2。
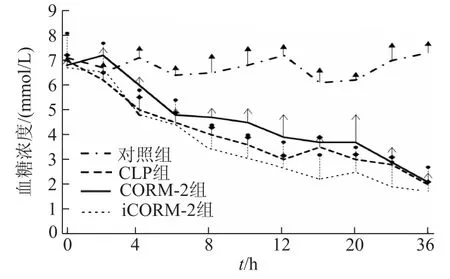
图2 CORM-2对CLP小鼠血糖浓度的影响
2.3 CORM-2对脓毒症小鼠肝脏葡萄糖代谢的影响
CLP术后24 h,应用γ计数仪检测小鼠肝脏18F-FDG生物分布。结果显示,对照组SUV值为(0.75±0.17)ID%/g,CLP组为(1.94±0.54)ID%/g,CORM-2组为(1.04±0.16)ID%/g,iCORM-2组为(3.57±0.69)ID%/g。CLP组和iCORM-2组的18F-FDG分布明显高于另外两组(P均<0.05)。
2.4 CORM-2对肝脏葡萄糖激酶活性及乳酸含量的影响
CLP术后24 h,与对照组比较,CLP组和iCORM-2组肝脏葡萄糖激酶活性及乳酸含量均明显增高(P<0.05);与CLP组比较,CORM-2组肝脏葡萄糖激酶活性及乳酸含量明显降低(P<0.05)。见表1。
表1 4组小鼠肝脏葡萄糖激酶的表达及乳酸含量的比较n=8±s
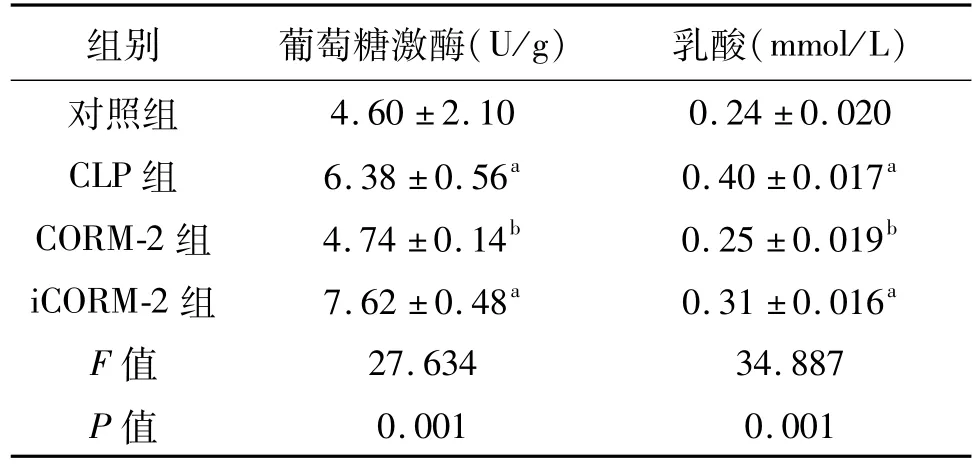
表1 4组小鼠肝脏葡萄糖激酶的表达及乳酸含量的比较n=8±s
a:P<0.05,与对照组比较;b:P<0.05,与CLP组比较
组别 葡萄糖激酶(U/g) 乳酸(mmol/L)4.60±2.10 0.24±0.020 CLP组 6.38±0.56a 0.40±0.017a CORM-2组 4.74±0.14b 0.25±0.019b iCORM-2组 7.62±0.48a 0.31±0.016a F值 27.634 34.887 P值对照组0.001 0.001
2.5 CORM-2对血清ALT和AST活性的影响
CLP术后24 h,与对照组比较,CLP组和iCORM-2组血清ALT和AST均明显增高(P均<0.05);与CLP组比较,CORM-2组ALT和AST均明显降低(P均<0.05)。见表3。
表3 各组小鼠血清转氨酶的比较 n=8±s
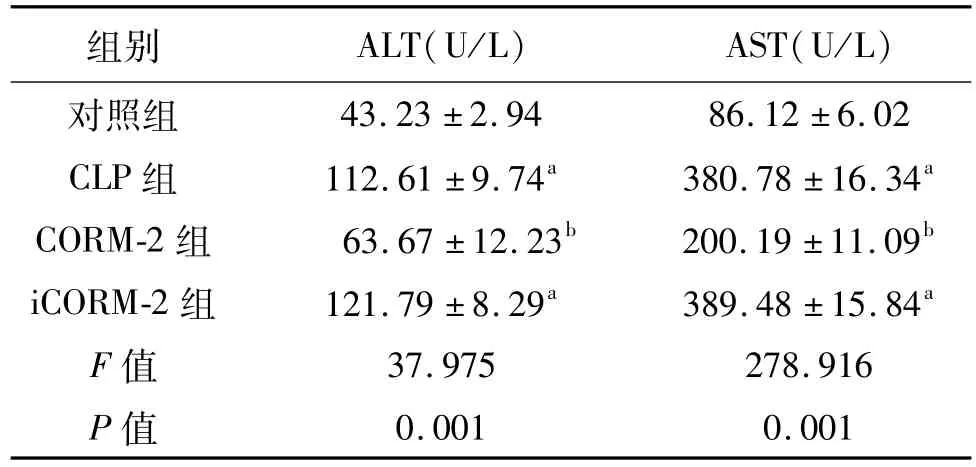
表3 各组小鼠血清转氨酶的比较 n=8±s
a:P<0.05,与对照组比较;b:P<0.05,与CLP组比较
组别 ALT(U/L) AST(U/L)43.23±2.94 86.12±6.02 CLP组 112.61±9.74a 380.78±16.34a CORM-2组 63.67±12.23b 200.19±11.09b iCORM-2组 121.79±8.29a 389.48±15.84a F值 37.975 278.916 P值对照组0.001 0.001
3 讨论
临床研究证实,脓毒症时肝脏能量代谢紊乱,表现为葡萄糖、蛋白质、脂肪等需求加大,导致机体处于高代谢水平[7]。其中,由于无氧酵解增加以及肝糖原合成能力下降所引起的高血糖,导致重要器官的功能损害,与患者预后不良密切相关。一方面,高血糖降低了中性粒细胞活性,削弱了机体的免疫功能,使机体抗感染能力下降;另一方面高血糖能影响细胞因子的产生,增加了肿瘤坏死因子、白细胞介素6的释放,减少了内皮细胞NO的生成[8]。
内源性一氧化碳(CO)是由血红素经血红素加氧酶(HO)催化分解而产生,具有明显的抗炎、抗凋亡等作用[9]。既往采用吸入的方法作为外源性CO的来源,但其装置复杂、吸入浓度难以控制,易导致碳氧血红蛋白血症(HbCO)。CORM-2是近几年新合成的外源性CO释放分子,溶解后能缓慢释放CO,从而发挥生理作用。
实验发现,CLP小鼠血糖在术后2 h开始逐渐下降,至36 h时已降低63%。使用CORM-2干预后并没有改变这一情况。我们认为出现这一情况的主要原因可能是由于手术后小鼠的摄食行为明显减低,作为代谢能力本身比较旺盛的啮齿类动物,在创伤后所需要的能量更是显著增高,因而短时间的禁食即可能出现明显低血糖。Barkhausen等[10]在2009年报道过该现象。这有没有可能是因为脓毒症严重感染,导致代谢能力下降所引起?是否和之前所研究的脓毒症患者全身高代谢征的理论相悖呢?本实验中我们对此做了进一步的研究。18FFDG作为一种类葡萄糖放射性示踪剂,可以显示组织器官受到各种疾病或药物的影响时葡萄糖代谢水平的变化,目前已被应用于人及小动物糖代谢的研究[11]。18F-FDG被细胞膜上的葡萄糖转运蛋白(GLUT)运输到细胞内,通过HK磷酸化为18F-2′-FDG-6,继而不能像G-6-P那样继续进行糖代谢而是被滞留在细胞内,因此,其含量就代表了细胞转运和代谢葡萄糖的能力。现已发现,FDG高摄取的情况不仅仅发生在恶性肿瘤,许多良性的炎性反应也常常表现出高FDG摄取现象[11]。我们检测18FFDG生物分布,发现脓毒症小鼠的肝脏葡萄糖代谢水平明显增高,超过了正常水平,而使用CORM-2干预后其葡萄糖代谢能力则受到了明显的抑制。
葡萄糖激酶是葡萄糖代谢的关键酶,主要存在于动物肝细胞及胰岛B细胞胞质内,其活性的增高常常意味着葡萄糖代谢水平的增高。通过对脓毒症小鼠肝细胞葡萄糖激酶活性的检测,我们发现脓毒症时葡萄糖激酶活性较对照组明显增高,而CO干预后这一改变受到明显抑制。由此,我们推测,CORM-2可能是通过抑制葡萄糖激酶的活性,降低了肝细胞葡萄糖代谢水平。
脓毒症时异常代谢的另一个重要变化就是高乳酸代谢,这是激素和细胞因子的反向调节异常而引起的肌肉及其他组织无氧酵解过程增加所引起的,这一过程被称为乳酸穿梭。组织中乳酸含量的高低和持续时间直接影响后期器官功能障碍的形成,乳酸堆积所引起的酸中毒对于脓毒症预后也是极为不利的[7]。机体清除乳酸最主要的器官就是肝脏。我们的实验结果显示,CORM-2干预后的脓毒症小鼠肝脏乳酸堆积明显受抑,这也是CORM-2调控脓毒症小鼠肝脏能量代谢的一个重要机制。
因此,CORM-2通过调节脓毒症小鼠肝脏葡萄糖代谢、组织乳酸含量及转氨酶活性,改善了肝脏能量代谢,从而使脓毒症小鼠的生存率明显提高。本研究初步证实了CORM-2对脓毒症时肝脏能量代谢紊乱的调控作用,后期,我们将进一步对CORM-2干预能量代谢中脂肪和蛋白质的代谢进行研究。
[1]Martin GS,Mannino DM,Eaton S,et al.The epidemiology of sepsis in the United States from 1979 through 2000[J].N Engl JMed,2003,348(16):1546-1554.
[2]Holm C,Hörbrand F,Mayr M,et al.Acute hyperglycaemia following thermal injury:friend or foe?[J].Resuscitation,2004,60(1):71-77.
[3]孙艳,孙炳伟.膜糖蛋白活化、造血系细胞特异蛋白-1磷酸化与脓毒症时血小板功能异常的关系研究进展[J].江苏大学学报:医学版,2011,21(6):544-548.
[4]Wang X,Cao J,Sun BW,etal.Exogenous carbonmonoxide attenuates inflammatory responses in the small intestine of septicmice[J].World JGastroenterol,2012,18(40):5719-5728.
[5]Sun B,Sun H,Liu C,et al.Role of CO-releasingmolecules liberated CO in attenuating leukocytes sequestration and inflammatory responses in the lung of thermally injured mice[J].J Surg Res,2007,139(1):128-135.
[6]Ishimori T,Saga T,Mamede M,et al.Increased18FFDG uptake in amodel of inflammation:concanavalin A-mediated lymphocyte activation[J].JNucl Med,2002,43(5):658-663.
[7]Norbury WB,Jeschke MG,Herndon DN.Metabolism modulators in sepsis:propranolol[J].Crit Care Med,2007,35(9 Suppl):616-620.
[8]Turina M,Fry DE,Polk HC Jr.Acute hyperglycemia and the innate immune system:clinical,cellular,and molecular aspects[J].Crit Care Med,2005,33(7):1624-1633.
[9]Hintze KJ,Theil EC.Cellular regulation and molecular interactions of the ferritins[J].Cell Mol Life Sci,2006,63(5):591-600.
[10]Barkhausen T,Probst C,Hildebrand F,et al.Insulin therapy induces changes in the inflammatory response in amurine 2-hitmodel[J].Injury,2009,40(8):806-814.
[11]Mittra E,Quon A.Positron emission tomography/computed tomography:the current technology and applications[J].Radiol Clin North Am,2009,47(1):147-160.
Effect of CORM-2 on liver energy metabolism in sepsis and the potentialmechanism s
LIANG Feng,SUN Bing-wei,WANG Xu,QINWei-ting,LIU Da-dong,QIU Xue-feng
(Department of Burn and Plastic Surgery,the Affiliated Hospital of Jiangsu University,Zhenjiang Jiangsu 212001,China)
Objective:To explore the effects of CO-releasing molecules[tricarbonyl dichlororuthenium(Ⅱ)dimer,CORM-2]-liberated CO on liver energymetabolism of septic model and potentialmechanisms.M ethods:Forty-eightmice were randomly divided into four groups:control group,CLP group,CORM-2 group,inactivated CORM-2(iCORM group),cecal ligation and puncture(CLP)group.The CORM-2 and iCORM-2 group were treated with CLP surgery then followed by tail vein injection of8 mg/kg CORM-2 and iCORM-2,respectively.Twelvemice in each group were used during the experiments of blood glucose testing and survival ratemeasurement.In the other experiment,eightmicewere used in each group.Levels of aminotransferases(ALT and AST)were measured by biochemicalmethods.Glucokinase activity and the concentration of lactate in tissue homogenateswere assessed using assay kits.Blood glucose ofmice in each groupswas tested every 2 hourswithin 36 hours using a fast blood glucose testmeter.Aγcounter was used to detect the biodistribution of18F-FDG in the liver ofmice.Results:The survival rate of septic mice was significantly increased by CORM-2.The uptake of18F-FDG was decreased when treated with CORM-2.The activity of glucokinase,AST,ALT and concentration of lactate in septic mice treated with CORM2 were maintained in normal levels.The blood glucose of septicmicewas decreased significantly in all the three op-eration groups.Conclusion:CORM-2-released CO improves the survival of septic mice by modulating the metabolism of glucose septic mice and protecting the function of liver in sepsismice.
carbon monoxide-releasingmolecules-2;sepsis;liver;18F-FDG
R631
A
1671-7783(2014)01-0018-04
10.13312/j.issn.1671-7783.y130248
国家自然科学基金资助项目(30772256,81071546,81272148);江苏省自然科学基金资助项目(BK2012703)
梁峰(1983—),男,硕士研究生;孙炳伟(通讯作者),教授,博士生导师,E-mail:sunbinwe@hotmail.com
2013-10-30 [编辑]陈海林

