维生素K对去卵巢大鼠肝氧化应激及炎症因子的影响
潘春芳,徐三荣
(1.江苏大学临床医学院,江苏镇江212013;2.金坛市中医医院妇产科,江苏金坛213200;3.江苏大学附属医院普外科,江苏镇江212001)
维生素K对去卵巢大鼠肝氧化应激及炎症因子的影响
潘春芳1,2,徐三荣3
(1.江苏大学临床医学院,江苏镇江212013;2.金坛市中医医院妇产科,江苏金坛213200;3.江苏大学附属医院普外科,江苏镇江212001)
目的:探讨补充维生素K对去卵巢大鼠肝氧化应激及炎症的影响。方法:以去卵巢SD大鼠作为围绝经期模型,比较维生素K补充与不补充对肝组织丙二醛,超氧化物歧化酶(SOD),还原型谷胱甘肽(GSH)等氧化应激指标以及肿瘤坏死因子α(TNF-α)和白介素6(IL-6)的影响。将30只6月龄雌性SD大鼠随机分为3组,每组均为10只,即假手术组,去卵巢组以及去卵巢后补充维生素K组(维生素K组)。术后1周开始分组给药,维生素K组将维生素K混于丙三醇中每日灌胃,而假手术组和去卵巢组每日给予丙三醇灌胃。90 d后,取肝组织测定丙二醛,SOD,GSH;冰冻切片行苏木素-伊红(HE)与活性氧(ROS)荧光染色;免疫印迹检测TNF-α和IL-6的表达。结果:维生素K组肝组织丙二醛水平较去卵巢组明显降低,但明显高于假手术组(P均<0.05)。维生素K组肝组织SOD,GSH水平均较去卵巢组明显降低(P<0.05),与假手术组比较差异无统计学意义。形态学检测表明维生素K组肝细胞胞质内小空泡数目明显少于去卵巢组,而假手术组则未见空泡;维生素K组肝细胞内活性氧荧光强度明显低于去卵巢组,与假手术组相近。免疫印迹结果表明维生素K组肝内TNF-α与IL-6表达水平均介于去卵巢组和假手术组之间;去卵巢组两种因子水平明显高于假手术组。结论:去卵巢大鼠肝组织处于较高的氧化应激状态,并伴有促炎因子表达增高,这种改变能在一定程度上被维生素K缓解。
维生素K;去卵巢;肝;氧化应激;白介素6;肿瘤坏死因子α
绝经后卵巢功能下降常伴有肝内氧化应激水平增高和促炎因子的增加[1]。氧化应激水平增高主要由脂质过氧化物产生增加和(或)抗氧化物减少所致,严重时会引起肝细胞损伤。肝内促炎因子的增高如肿瘤坏死因子α(TNF-α)和白介素6(IL-6)也可能会损伤肝细胞[2]。这些改变与绝经后雌激素水平降低密切相关。故绝经后补充雌激素能缓解绝经带来的肝氧化损伤,但雌激素替代疗法易增加乳腺癌和其他妇科肿瘤的发病率[3]。维生素K的结构与雌激素有相近之处。虽然其经典效应主要为参与凝血,但最近的研究表明维生素K不仅能改善绝经后骨质疏松的症状,而且具有较强的抗氧化能力,能够降低氧化应激对细胞的损伤[4-5]。我们以6月龄大鼠去卵巢模型模拟绝经,观察肝内氧化应激水平与炎症因子的表达,同时观察维生素K补充对这些改变的干预效果。由于维生素K1有着较强的抗氧化能力,故本实验主要研究维生素K1的干预效果。
1 材料和方法
1.1 实验动物
6月龄健康雌性SPF级SD大鼠30只,体质量(350±20)g,由江苏大学实验动物中心提供。实验动物给予分笼饲养,在(24±2)℃,12 h昼夜条件下,给予颗粒饲料喂养。
1.2 试剂及仪器
维生素K1和2-硫代巴比妥酸(TBA)购自Sigma公司(批号:V3501,T5500),超氧化物歧化酶(SOD,WST法)与还原型谷胱甘肽(GSH)测定试剂盒购自南京建成生物工程研究所。活性氧染色试剂盒购自上海杰美基因医药科技有限公司。RIPA裂解液购自加拿大Fermentas公司。IL-6,TNF-α抗体购自武汉博士德生物工程有限公司,β-肌动蛋白抗体及HRP耦联二抗购自美国Santa Cruz公司,PVDF膜及化学发光剂购自德国Millipore公司。BCA蛋白测定试剂盒购自美国Thermo公司。μQuant酶标仪购自美国BioTek公司,冰冻切片机及荧光显微影像系统购自德国莱卡公司,电泳仪购自美国Bio-Rad公司,凝胶成像系统购自北京赛智创业科技有限公司。
1.3 动物分组及造模
实验按照随机区组设计。大鼠编号后以随机数字表法分成3组,分别为假手术组,卵巢切除组(去卵巢组)及卵巢切除补充维生素K1组(维生素K组),每组各10只。去卵巢组和维生素K组大鼠按如下操作进行手术。戊巴比妥钠腹腔注射麻醉,仰卧位固定,腹部备皮消毒;腹正中线作切口,切开肌肉,找到两侧输卵管,依次切除末端卵巢;结扎出血处,缝合各层组织结构,缝合腹腔。假手术组大鼠操作与此一致,只是仅仅切除卵巢周围的一小块脂肪组织后止血,缝合腹腔。术后3 d注射青霉素以预防感染。维生素K组术后1周开始补充维生素K1。具体方法是将维生素K1溶于甘油中,每日以20 mg/kg的剂量灌胃,每周末称重调整下周维生素K1补给量。去卵巢组与假手术组则给予相近剂量的甘油灌胃。饲养90 d后,处死大鼠,以PBS从门静脉灌洗肝脏后分离冻存于超低温冰箱内待用。
1.4 肝脏丙二醛,SOD及GSH的测定
以超声法制备10%肝组织匀浆,以500×g转速离心除沉淀,取上清进行测定。丙二醛测定采用TBA法:将三氯乙酸沉淀蛋白后加入1%TBA,95℃水浴80 min,冷却后应用酶标仪测定532 nm处的光密度值。SOD与GSH的测定按照试剂盒说明书进行。采用BCA法测定蛋白浓度。丙二醛,SOD与GSH测定结果均以蛋白浓度进行校正。
1.5 肝脏苏木素-伊红染色及活性氧荧光染色
取各组大鼠肝组织进行冰冻切片(8μm)以备染色。分别以苏木素和伊红(HE)滴染切片,梯度浓度乙醇脱水,二甲苯透明后以中性树胶封片。同时对冰冻切片进行活性氧荧光染色,原理为2′,7′-二乙酰二氯荧光素(DCFH-DA)在胞内能被分解为无荧光的DCFH,而DCFH能被活性氧氧化成发绿色荧光的DCF。具体操作步骤按试剂盒进行。染色后的切片置于莱卡显微镜分别以普通光和荧光进行摄影和记录。
1.6 蛋白质印迹法检测肝组织IL-6和TNF-α的表达
RIPA裂解液制备10%的肝组织匀浆,加入上样缓冲液,100℃加热5 min使蛋白变性。制备10%的分离胶和5%的积层胶,电泳,转膜,脱脂奶粉封闭1 h,以一抗孵育过夜,洗膜,HRP耦联的二抗孵育1 h,洗膜,涂加发光剂,于凝胶成像系统上进行曝光,记录结果。每组取6只大鼠的肝脏进行免疫印迹检测,曝光结果使用成像系统自带软件进行灰度分析以便统计。所用的一抗包括兔抗大鼠IL-6,TNF-α(稀释比例均为1∶300),小鼠抗大鼠β-肌动蛋白(1∶3000)。二抗为HRP耦联的羊抗兔及羊抗小鼠抗体(1∶10 000)。
1.7 统计学处理
应用SPSS 16.0统计学软件进行数据分析,测定结果以均数±标准误表示。先进行方差齐性检验和单因素方差分析,然后以LSD-t法两两比较组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 补充维生素K对去卵巢大鼠肝脏丙二醛,SOD以及GSH的影响
与假手术组比较,去卵巢组大鼠肝内丙二醛明显升高(t=4.768,P<0.01),而SOD和GSH明显降低(t=2.739,P<0.05;t=2.523,P<0.05)。假手术组与维生素K组相比,上述3项氧化应激指标差异无统计学意义(丙二醛、SOD以及GSH的t值分别为1.341,0.484,0.155,P均大于0.05)。与去卵巢组比较,维生素K组大鼠肝组织丙二醛明显降低(t=3.427,P<0.01),而SOD与GSH均明显升高(t=2.255,P<0.05;t=2.678,P<0.05)。见图1。
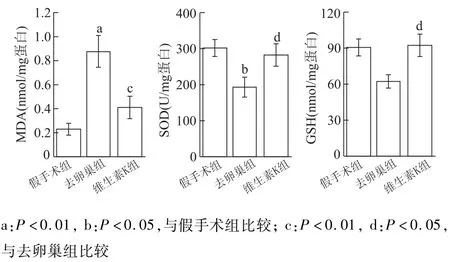
图1 3组大鼠肝组织丙二醛,SOD及GSH水平比较
3.2 补充维生素K对卵巢切除大鼠肝组织形态及活性氧含量的影响
HE染色表明,与假手术组比较,去卵巢组肝细胞的胞质内存在较多5μm左右的空泡,而维生素K组空泡数明显减少。各组肝细胞的形态和排列未见明显差别。活性氧染色可见去卵巢组中荧光弥散地分布在肝细胞胞质内,细胞核呈黑色空洞状,位于细胞中央。假手术组和维生素K组的荧光都极弱。因此,去卵巢组肝细胞内荧光强度明显高于其他两组,而维生素K组和假手术组之间差异不明显。见图2。
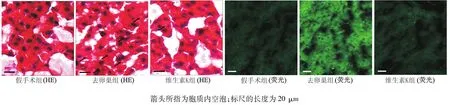
图2 各组肝组织病理形态的变化(HE染色与活性氧荧光染色)
3.3 维生素K对去卵巢大鼠肝组织IL-6和TNF-α表达的影响
蛋白质印迹结果显示,肝内IL-6的表达水平从高到低依次为去卵巢组,维生素K组,假手术组。TNF-α表达水平的高低次序与此一致,只是各组间差异小于IL-6间的差异。统计学分析表明,去卵巢组肝内TNF-α和IL-6的表达明显高于维生素K组和假手术组(与维生素K组比较,IL-6:t=3.946,P<0.01,TNF-α:t=2.219,P<0.05;与假手术组比较,IL-6:t=4.500,P<0.01,TNF-α:t=3.159,P< 0.01)。而IL-6和TNF-α在维生素K组与假手术组之间的差异均无统计学意义(IL-6:t=0.554,TNF-α:t=0.940,P均大于0.05)。见图3。

图3 各组大鼠肝组织中IL-6和TNF-α的表达水平
4 讨论
研究证实卵巢切除会打破大鼠肝脏中抗氧化-氧化系统的平衡[6],主要表现为肝匀浆中丙二醛升高,GSH降低。丙二醛是脂质过氧化的终产物,可反映组织内脂质过氧化程度,因而成为衡量细胞自由基损伤程度的常用指标[7]。GSH是非酶类抗氧化剂的代表性物质,其他的还包括抗坏血酸,生育酚等。本研究结果也证实了卵巢切除后3个月,大鼠肝脏内丙二醛升高,GSH降低。而关于肝内酶类抗氧化系统特别是SOD在卵巢切除后的变化则存在不同的研究结果。Konyalioglu等[8]研究表明,卵巢切除5周后大鼠肝内SOD水平上升。而另一些研究结果显示,卵巢切除则会降低大鼠肝内SOD水平[9-10]。我们的研究结果与后者一致,这可能是由于本实验在卵巢切除后第97天才分离检测肝脏SOD水平。因为卵巢切除后肝内氧化因子和抗氧化因子会出现波动性变化,很可能早期出现一定程度的代偿,而晚期才出现降低[6]。
维生素K与雌激素都属脂类激素,主要参与凝血过程。近年来,维生素K在改善绝经后骨质疏松等方面的潜力已成为一个研究热点,这提示维生素K与雌激素的生理功能间可能存在交集。另一方面,维生素K能够通过抑制12脂氧化酶的激活对抗少突胶质细胞中由花生四烯酸引起的氧化损伤[11]。动物实验还证实,补充维生素K能够降低老龄雌性大鼠的认知缺陷[12]。本实验结果表明,维生素K同样能够降低卵巢切除大鼠肝内氧化应激水平,具体表现在大鼠肝内丙二醛降低,而SOD和GSH均升高。维生素K的这种肝内抗氧化效应可能也与12脂氧化酶有关,详细的机制尚需进一步的研究。
活性氧是指细胞在代谢过程中由氧化还原反应产生的、并在分子组成上含氧的一类化学性质极其活泼的物质总称,氧自由基是其中最重要的一类。氧自由基包括超氧阴离子、羟自由基、单线态氧等能使无荧光的染料氧化成有荧光的物质[13]。本实验表明,卵巢切除后肝内活性氧水平异常升高,弥散分布在胞质内,而维生素K则能使之降低到正常水平。活性氧易与膜内各种脂质发生过氧化反应形成以丙二醛为代表的脂质过氧化物,进一步验证了卵巢切除后肝内氧化应激水平的升高及维生素K的保护作用。
肝内氧化应激与活性氧的升高常伴有TNF-α等炎症因子的增多,从而进一步加重肝细胞损伤[14]。24月龄大鼠卵巢切除后,肝内TNF-α,IL-6,iNOS,HO-1等多种炎症因子显著升高[15]。本实验结果表明6月龄雌性大鼠卵巢切除后,肝内炎症因子同样也显著升高,而这种升高能被补充维生素K部分性地抑制。故维生素K具有抑制炎症反应的效应,这与之前的报道一致。维生素K能够抑制脂多糖诱导的肝内炎症反应,此效应与TNF-α和IL-6这两种因子的抑制密切相关[16]。维生素K还能通过抑制核因子κB来抑制脂多糖诱导的炎症反应[17]。
卵巢切除大鼠肝内氧化应激、活性氧以及促炎因子水平的升高很可能与雌激素突降导致的非酒精性脂肪肝(NAFLD)有关[18]。雌激素水平突降使体内性激素之间的平衡发生很大变化,导致总胆固醇、三酰甘油、低密度脂蛋白胆固醇明显升高,高密度脂蛋白胆固醇急剧降低,造成血液及其他组织器官中脂质及其代谢产物的异常而出现脂代谢紊乱,脂肪在体内堆积而形成肥胖,增加了高血压、心血管疾病、2型糖尿病和NAFLD等慢性疾病的风险[19]。肝HE染色显示去卵巢组肝细胞内存在较多的小空泡,类似于空泡状变性,提示肝细胞能量代谢的紊乱。而补充维生素K后大鼠肝细胞内的空泡明显减少,但并未完全消失,说明维生素K的保护作用并不完全。此结果提示脂质代谢紊乱可能是卵巢切除大鼠肝氧化应激与促炎因子升高的根本原因。而维生素K或许能够通过部分性地纠正脂质代谢紊乱,改善肝脏的状态[20]。
综上,维生素K对抑制绝经后肝氧化应激具有一定的实用价值,但仍需大量基础及临床研究来进一步确定其机制和适宜剂量,毕竟过多脂溶性维生素摄入仍存在蓄积中毒的可能性。维生素K与雌激素联用是否能够获得更高的安全性和更好的效果也需要进一步研究。
[1]Sanchez-Rodriguez MA,Zacarias-Flores M,Arronte-Rosales A,et al.Menopause as risk factor for oxidative stress[J].Menopause,2012,19(3):361-367.
[2]吴娜,蔡光明,何群.氧化应激与肝脏损伤[J].世界华人消化杂志,2008,16(29):3310-3315.
[3]Oztekin E,Tiftik AM,Baltaci AK,etal.Lipid peroxida
tion in liver tissue of ovariectomized and pinealectomized rats:effect of estradiol and progesterone supplementation[J].Cell Biochem Funct,2007,25(4):401-405.
[4]洪又佳,梁九根.维生素K与骨质疏松症[J].中国骨质疏松杂志,2010,16(7):525-528.
[5]Li J,Lin JC,Wang H,etal.Novel role of vitamin k in preventing oxidative injury to developing oligodendrocytes and neurons[J].J Neurosci,2003,23(13):5816-5826.
[6]Kankofer M,Radzki RP,Bienko M,et al.Anti-oxidative/oxidative status of rat liver after ovariectomy[J].J Vet Med A Physiol Pathol Clin Med,2007,54(5):225-229.
[7]王爱梅,李弋,陈亚奇.葛根异黄酮对衰老大鼠卵巢形态和功能的影响[J].中国妇幼保健,2011,26(36):5786-5788.
[8]Konyalioglu S,Durmaz G,Yalcin A.The potential antioxidant effect of raloxifene treatment:a study on heart,liver and brain cortex of ovariectomized female rats[J].Cell Biochem Funct,2007,25(3):259-266.
[9]Al-Rejaie SS.Thymoquinone treatment alleviate ovariectomy-induced hepatic oxidative damage in rats[J].Journal of Applied Pharmaceutical Science,2013,3(6):126-131.
[10]Ha BJ.Oxidative stress in ovariectomy menopause and role of chondroitin sulfate[J].Arch Pharm Res,2004,27(8):867-872.
[11]Li J,Wang H,Rosenberg P A.Vitamin K prevents oxidative cell death by inhibiting activation of 12-lipoxygenase in developing oligodendrocytes[J].J Neurosci Res,2009,87(9):1997-2005.
[12]Carrie I,Belanger E,Portoukalian J,et al.Lifelong lowphylloquinone intake is associated with cognitive impairments in old rats[J].J Nutr,2011,141(8):1495-1501.
[13]Basaranoglu M,Basaranoglu G,Senturk H.From fatty liver to fibrosis:a tale of"second hit"[J].World JGastroenterol,2013,19(8):1158-1165.
[14]Kuwata K,Shibutani M,Hayashi H,et al.Concomitant apoptosis and regeneration of liver cells as amechanism of liver-tumor promotion byβ-naphthoflavone involving TNFα-signaling due to oxidative cellular stress in rats[J].Toxicology,2011,283(1):8-17.
[15]Kireev RA,Tresguerres AC,Garcia C,et al.Hormonal regulation of pro-inflammatory and lipid peroxidation processes in liver of old ovariectomized female rats[J].Biogerontology,2010,11(2):229-243.
[16]Ohsaki Y,Shirakawa H,Hiwatashi K,et al.Vitamin K suppresses lipopolysaccharide-induced inflammation in the rat[J].Biosci Biotechnol Biochem,2006,70(4):926-932.
[17]Ohsaki Y,Shirakawa H,Miura A,etal.Vitamin K suppresses the lipopolysaccharide-induced expression of inflammatory cytokines in culturedmacrophage-like cells via the inhibition of the activation of nuclear factor kappaB through the repression of IKKalpha/beta phosphorylation[J].JNutr Biochem,2010,21(11):1120-1126.
[18]Lavoie JM,Pighon A.NAFLD,Estrogens,and Physical Exercise:The Animal Model[J].J Nutr Metab,2012(2011):914938.
[19]王晓琳,章志建,陆炎,等.雌激素在肝脏糖脂代谢中的作用机制研究[C].广州:中华医学会第十一次全国内分泌学学术会议,2012:217-218.
[20]Denisova NA,Booth SL.Vitamin K and sphingolipidmetabolism:evidence to date[J].Nutr Rev,2005,63(4):111-121.
Effects of phylloquinone on hepatic oxidative stress and inflammatory factors in ovariectom ized rats
PAN Chun-fang1,2,XU San-rong3
(1.School of ClinicalMedicine,Jiangsu University,Zhenjiang Jiangsu 212013;2.Departmentof Gynaecology and Obstetrics,Jintan Traditional Chinese Medical Hospital,Jintan Jiangsu 213200;3.Departmentof General Surgery,the Affiliated Hospital of Jiangsu University,Zhenjiang Jiangsu 212001,China)
Objective:To observe the effects of phylloquinone supplementation on hepatic oxidative stress and inflammation in ovariectomized rats and to propose a new way to prevent the hepatic impairment associated with menopause.M ethods:Thirty female SD rats of sixmonths agewere randomly divided into 3 groups,sham group(Sham,n=10),ovariectomy group(OVX,n=10),phylloquinone supplementation after ovariectomy group(OVX+VK,n=10).One week after operation,phylloquinone or glycerol which served as delivery agent was administrated through gastric lavage to OVK+VK group or Sham and OVX group respectively for 90 days.After that,the livers were harvested to determine malonaldehyde(MDA),superoxide dismutase(SOD)and glutathione(GSH)levels.Hematoxylin eosin(HE)and reactive oxygen species(ROS)fluorescent staining were performed on hepatic frozen sections.The expressions of IL-6 and TNF-αin the livers were evaluated by Western blotting.Results:The hepatic MDA levels in the OVX+VK group were significantly lower than those in the OVX group and higher than those in the Sham group(both P<0.05).The hepatic SOD and GSH levels in the OVX+VK group were significantly lower than those in the OVX group,but were not significantly different from those in the Sham group.HE stainingdemonstrated that the small vacuoles in the OVX+VK group were obviously fewer than those in the OVX group while the livers in Sham group contained no vacuole.The ROS fluorescence in the hepatic sections in the OVX+VK group wasweaker than that in the OVX group.The results ofWestern blotting demonstrated that the levels of IL-6 and TNF-αin the OVX+VK group located between the other two groupswhile those in the OVX group were higher than those in the Sham group.Conclusion:The liver of ovariectomized rats was under higher oxidative stress concomitant with higher levels of inflammatory factors as compared with that of normal rats.These changes can be alleviated by phylloquinone supplementation to some extents.
phylloquinone;ovariectomy;liver;oxidative stress;IL-6;TNF-α
R339.22;R458.7
A
1671-7783(2014)01-0031-05
10.13312/j.issn.1671-7783.y130236
潘春芳(1979—),女,江苏金坛人,主治医师,硕士研究生;徐三荣(通讯作者),主任医师,硕士生导师,E-mail:1695071511@qq.com
2013-10-07 [编辑]陈海林

