靶向miR-126慢病毒表达载体的构建及意义
杨学艺,卢小东,邵启祥,刘家秀,刘娟
(1.江苏大学基础医学与医学技术学院,江苏镇江212013;2.淮阴卫生高等职业技术学校检验药学系,江苏淮安223300;3.淮安市第四人民医院检验科,江苏淮安223001)
靶向miR-126慢病毒表达载体的构建及意义
杨学艺1,2,卢小东1,邵启祥1,刘家秀2,刘娟3
(1.江苏大学基础医学与医学技术学院,江苏镇江212013;2.淮阴卫生高等职业技术学校检验药学系,江苏淮安223300;3.淮安市第四人民医院检验科,江苏淮安223001)
目的:检测微小RNA-126(microRNA-126,miR-126)在CD4+CD25+调节性T细胞(regulatory T cells,Tregs)中的表达水平,同时构建基于慢病毒的miR-126反义寡核苷酸序列(antisense oligonucleotides,ASOs)表达载体。方法:实时定量PCR特异性探针法检测miR-126在Tregs中的表达水平;针对miR-126序列,设计合成其ASOs序列,退火后连接至经AgeⅠ酶和Eco RⅠ酶双酶切的pGCsil-LV-GFP载体上,连接产物转化DH5α感受态细胞,对经PCR鉴定为阳性的载体(命名为pGCsil-miR-126-ASOs)进行测序分析;将构建成功的pGCsil-miR-126-ASOs表达质粒和pHelper 1.0、pHelper 2.0质粒共转染293T细胞,浓缩病毒颗粒并测定所获病毒滴度;将制备好的病毒颗粒感染经TGF-β体外诱导培养的小鼠CD4+CD62L+初始T细胞,72 h后用流式细胞仪检测其Foxp3的表达变化。结果:实时定量PCR结果显示miR-126在CD4+CD25+Tregs中的表达明显高于CD4+CD25-T细胞(P<0.01);测序结果证明成功构建pGCsil-miR-126-ASOs重组质粒载体,包装并获得高浓度的慢病毒颗粒,病毒滴度为9×108TU/m L;重组的病毒能明显抑制Tregs的外周诱导(P<0.05)。结论:成功构建miR-126 ASOs的慢病毒表达载体,并获得高浓度的病毒颗粒。
微小RNA-126;CD4+CD25+调节性T细胞;反义寡核苷酸;慢病毒
微小RNA(microRNAs,miRNAs)是一组内源性、长度在22~24 nt的非编码单链小RNA分子,能在转录后水平通过促进靶mRNA的降解或抑制蛋白质翻译来负调控靶基因的表达,从而参与调控细胞的发育、分化和功能[1-2]。近年来大量研究显示,T细胞亚群具有不同的miRNAs表达谱,后者在不同亚群T细胞的发育、分化和功能维持中发挥了关键的调控作用[3-4]。
CD4+CD25+调节性T细胞(regulatory T cell,Tregs)是一群具有负向免疫调控抑制功能的CD4+T细胞亚群,在维持机体免疫稳定的过程中发挥重要作用,其与其他亚群之间的失衡常常导致肿瘤的免疫逃逸、免疫耐受的打破和自身免疫性疾病的发生、发展[5]。外周血中的Tregs分为胸腺发育产生的nTregs(natural Tregs)和经诱导产生的iTregs(induced Tregs)两类。体内微环境诱导产生的iTregs在临床疾病如感染性疾病和肿瘤等发生过程中发挥重要作用,然而其诱导机制仍不明确。新近的研究表明,miRNAs与Tregs的发育和功能密切相关[6]。因此,分析特定的miRNAs分子与Tregs之间的关系将有助于揭示Tregs在外周微环境中被诱导的机制。
miR-126是近年来报道的miRNAs家族成员之一,在包括肿瘤在内的多种临床疾病发生中发挥了重要作用[7]。新近的研究显示,miR-126对于CD4+T细胞的功能起了关键的调控作用[8],然而,还未有报道其是否参与Tregs的外周诱导过程的研究。本研究拟先检测Tregs中miR-126的表达水平,然后构建基于慢病毒的miR-126反义寡核苷酸序列(antisense oligonucleotides,ASOs)表达载体,并初步观察miR-126 ASOs是否影响Tregs的外周诱导,以期为后续深入探讨特定miRNAs分子在Tregs外周诱导过程中的作用及机制提供前期实验基础。
1 材料与方法
1.1 主要试剂与仪器
慢病毒载体系统包括pGCsil-LV-GFP载体、pHelper 1.0载体、pHelper 2.0载体(GeneChem公司);AgeⅠ、Eco RⅠ、T4DNA连接酶(美国NEB公司);DH5α感受态细胞(本室保存),质粒抽提试剂盒(美国Promega公司),琼脂糖凝胶回收试剂盒(碧云天生物技术公司),RPMI 1640培养基(美国Hyclone公司),胎牛血清(北京索莱宝科技公司),鼠Tregs、CD4+CD62L+初始T细胞磁珠分选试剂盒(美国Miltenyi Biontec公司),PCR试剂(TaKaRa公司),LipofectamineTM2000(美国Invitrogen公司),流式抗体(eBioscience公司),LightCycler定量PCR仪(Roche公司),FACSCalibur流式细胞仪(美国BD公司),Gel DocTMXR+凝胶成像系统(美国Bio-Rad公司)。
1.2 实时荧光定量PCR法检测细胞中miR-126的表达
MACS磁珠法分选BALB/c小鼠脾脏Tregs和CD4+CD25-T(conventional T cell,Tcon)细胞,Trizol一步法提取细胞总RNA,反转录合成cDNA;用miR-126特异性发夹状引物按试剂盒说明书操作应用LightCycler定量PCR仪对两群细胞miR-126成熟体进行定量检测,PCR反应条件按试剂盒说明书操作。在扩增结束后将扩增产物进行2%凝胶电泳分析,以确定扩增产物的特异性和灵敏度。miR-126成熟体目的基因相对表达水平=特异基因的DNA含量/内参GAPDH的含量。
1.3 靶向miR-126 RNA反义寡核苷酸序列的设计和合成
通过miRBase数据库查询到miR-126(MIMAT0000137)序列为5′-CAUUAUUACUUUUGGUACGCG-3′,设计相应的反义寡核苷酸序列,正义链:CCGGCGCGTACCAAAAGTAATAATGTTTTTG;反义链:AATTCAAAAACATTATTACTTTTGGTACGCG;上下游序列分别含有AgeⅠ和Eco RⅠ酶切位点。将合成的正义链、反义链溶解于退火缓冲液中,90℃水浴15 min,自然冷却进行退火反应形成双链的DNA插入片段。
1.4 重组慢病毒载体的构建
将退火形成的双链DNA插入片段和经AgeⅠ和Eco RⅠ酶切后线性化的pGCsil-LV-GFP质粒在T4DNA连接酶作用下于16℃连接过夜,转化氯化钙法新鲜制备的DH5α感受态细胞,菌液涂布在氨苄西林抗性的LB培养平皿,培养12 h,筛选阳性克隆并进行菌落PCR鉴定,将鉴定为阳性的克隆送美季生物公司测序分析;菌落PCR及测序引物由捷瑞生物公司合成,上游:5′-GGAAAGAATAGTAGACATAATAGC-3′;下游:5′-AATTCAAAAACATTATTACTTTTGGTACGCG-3′。将构建正确的质粒命名为pGCsil-miR-126-ASOs。
1.5 慢病毒颗粒的制备
调整293T细胞密度为1.2×107/mL,接种于20 cm培养皿,37℃,5%CO2全湿度培养24 h,待细胞汇合度达70%~80%时,将pGCsil-miR-126-ASOs、pHelper 1.0、pHelper 2.0 3种质粒利用LipofectamineTM2000共转染293T细胞,8 h后更换为完全培养基,培养48 h后,收集上清液,于4℃,4000×g离心10 min,悬液用0.45μm滤器过滤,进行浓缩处理后于-80℃保存。
1.6 有限稀释法测定病毒滴度
将100μL 293T细胞接种于96孔培养板,每孔4×104个,37℃、5%CO2全湿度培养36 h后进行病毒滴度测定。取8个无菌EP管,编为1~8号,每管中加90μL的Opti-MEM,1号管加10μL病毒颗粒,混匀后吸取10μL加入2号管混匀,依次倍比稀释至8号管,选择对应的培养孔,吸取90μL培养液,加入对应稀释的病毒颗粒90μL,放入培养箱培养,24 h后,更换为100μL完全培养基,继续培养72 h,倒置荧光显微镜下观察GFP的表达情况,根据表达GFP的293T细胞数目,计算病毒滴度。
1.7 感染CD4+CD62L+初始T细胞
MACS磁珠法分选CD4+CD62L+初始T细胞,用CD3e(2 mg/mL)抗体包被培养板,合并可溶性CD28抗体(2 mg/mL)、IL-2(100 U/mL)、TGF-β(10 ng/mL),在含10%胎牛血清、100 U/mL青霉素、100 mg/mL链霉素、1 mmol/L L-谷氨酰胺的RPMI 1640培养基中,诱导培养24 h,按MOI=100加入相应体积的miR-126ASOs慢病毒颗粒,37℃、5%CO2全湿度培养12 h,更换为新鲜的培养基,继续培养60 h,流式细胞术检测Foxp3的表达,同时设立3个对照组:PBS组、pGCsil-对照组、TGF-β组。
1.8 统计学方法
2 结果
2.1 Tregs中miR-126的表达
实时PCR特异性探针法检测Tregs和CD4+CD25-T细胞中miR-126成熟体的表达水平,结果显示miR-126在Tregs中的表达水平明显高于CD4+CD25-T细胞(t=2.93,P<0.01)。见图1。
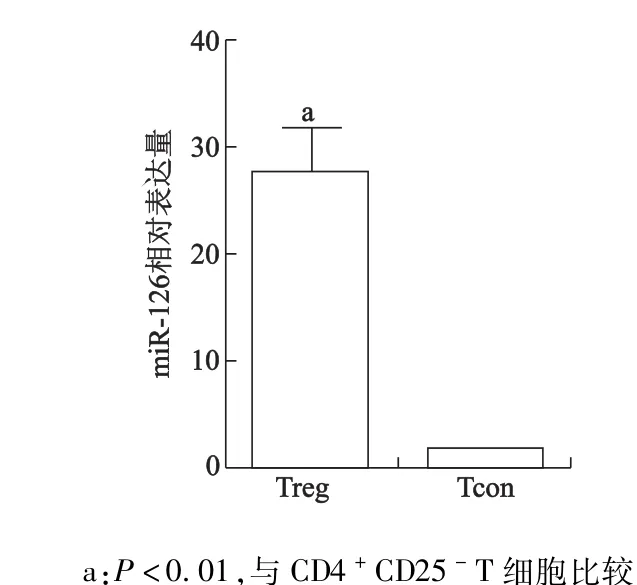
图1 实时荧光定量PCR检测Tregs和CD4+CD25-T细胞m iR-126的表达Fig 1 Real-time PCR analysis of expression ofm iR-126 inTregs and CD4+CD25-T cells
2.2 pGCsil-LV-GFP载体的线性化
对pGCsil-LV-GFP载体用限制性内切酶AgeⅠ和Eco RⅠ进行双酶切,进行琼脂糖凝胶电泳,酶切片段大小应为7 352 bp,结果显示酶切片段大小正确(图2)。
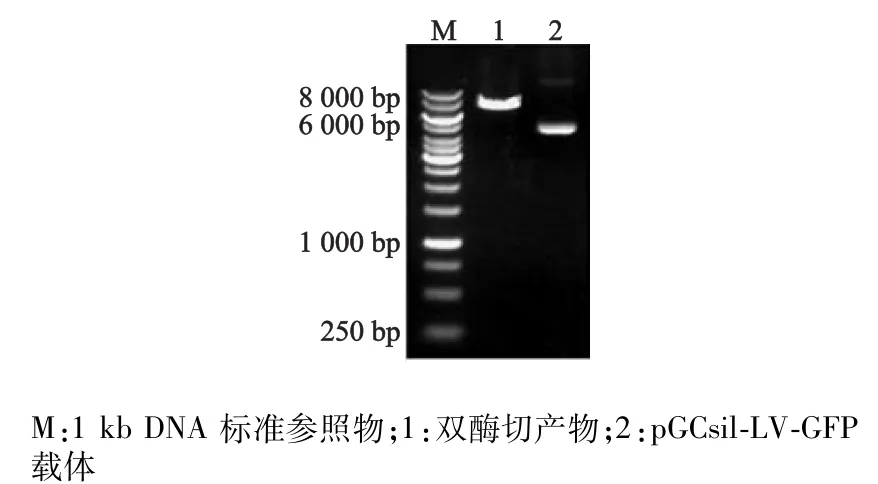
图2 pGCsil-LV-GFP载体的线性化Fig 2 Enzyme cutting production of pGCsil-LV-GFP vector
2.3 重组质粒pGCsil-miR-126-ASOs的鉴定
线性化的pGCsil-LV-GFP载体和miR-126 ASOs插入片段的连接产物经转化,挑选出阳性克隆,进行菌液PCR。琼脂糖电泳结果显示,8个克隆中只有2号克隆为阴性,其余克隆均为阳性,且产物大小正确(274 bp)(图3)。筛选出的阳性克隆经摇菌、抽提质粒进行测序,与设计序列完全一致(图4),结果表明成功构建pGCsil-miR-126-ASOs重组质粒。

图3 阳性克隆PCR产物琼脂糖凝胶电泳Fig 3 Agarose gel electrophoresis of the positive clone PCR product

图4 重组质粒pGCsil-m iR-126-ASOs的DNA序列Fig 4 DNA sequencing analysis of the recombinant plasm id pGCsil-m iR126-ASOs
2.4 慢病毒颗粒的包装及滴度
将pGCsil-miR-126-ASOs、pHelper 1.0和pHelper 2.0这3种质粒体外共转染293T细胞,48 h后,逐步收集培养上清。浓缩慢病毒颗粒后,采用有限稀释法感染293T细胞,倒置显微镜下观察,可见GFP的表达(图5),计数各培养孔表达GFP的阳性细胞数,计算得到病毒的滴度为9×108TU/mL。

图5 pGCsil-m iR-126-ASOs慢病毒颗粒感染293T细胞后GFP的表达(×100)Fig 5 Expression of GFP in 293T cells infected by pGCsilm iR-126-ASOs lentivirus
2.5 miR-126 ASOs对Tregs的外周诱导的抑制
按文献[9]报道建立Tregs的体外诱导体系,将表达pGCsil-miR-126-ASOs的慢病毒颗粒加入培养体系中,继续培养72 h后,流式细胞术检测Foxp3的表达。结果显示PBS组、pGCsil-对照组、TGF-β组和pGCsil-miR-126-ASOs组中CD4+T细胞的Foxp3表达比例分别为(0.93±2.02)%、(5.94± 0.02)%、(6.01±0.04)%、(1.55±0.02)%。分析发现,与TGF-β组比较,pGCsil对照对Tregs的外周诱导未产生明显影响(t=1.48,P>0.05),而pGCsil-miR-126-ASOs Foxp3组的相对比率明显降低(t=97.5,P<0.001),见图6。
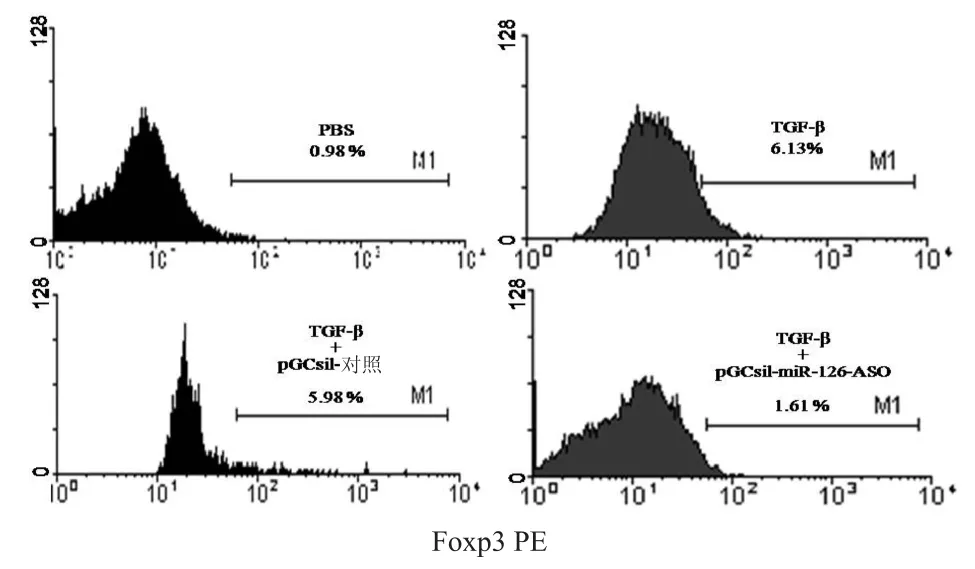
图6 m iR-126-ASOs对Tregs外周诱导的影响Fig 6 Effects ofm iR-126-ASOs on the peripheral induction of Foxp3
3 讨论
Tregs是能抑制免疫系统激活的独特T细胞功能亚群,在维持机体的免疫自稳和自身耐受中具有重要的作用。目前认为Tregs主要包括从胸腺T细胞发育分化而来的nTreg和在特定的外周微环境中,由成熟CD4+CD25-T细胞经诱导生成的iTreg[10]。大量研究显示,iTreg在肿瘤免疫、黏膜免疫耐受和过敏性反应中均具有重要的作用[11]。因此,Tregs的外周诱导机制引起了研究者们的广泛关注。已有的研究显示,TGF-β-Smad信号途径在Tregs的外周诱导中发挥了关键作用[12-13]。然而,在TGF-β诱导Foxp3表达过程中,如果PI3K-Akt信号途径的磷酸化水平升高,则会抑制Foxp3的诱导表达,相反,提前抑制PI3K-Akt信号途径的传递,则可上调Foxp3的表达[14-15]。由此可见,PI3K-Akt信号途径在Tregs的外周诱导中也具有重要的调控作用。此外,还有研究显示IL-2或CD28分子信号途径也参与了Tregs的外周诱导过程[16-17]。然而,这些与Tregs外周诱导密切相关的关键信号途径的调控分子至今仍未阐明。
近年来,越来越多的证据显示多种miRNAs分子参与了Tregs的发育、分化和功能调节[6]。Cobb等[18]发现在Dicer-/-小鼠体内,Tregs的数量和功能明显降低。Jiang等[19]的研究也发现miR-17和miR-19b通过作用于靶基因TGFβ-RⅡ、CREB1和PTEN调节Tregs的诱导分化过程。这些研究表明,特定的miRNAs在Tregs的外周诱导和功能发挥中起了关键的调控作用。然而,由于miRNAs分子家族成员的庞大和Tregs外周诱导机制的复杂性,只有深入研究特定miRNAs分子参与调控Tregs外周诱导的作用及机制才能为Tregs外周诱导机制的阐明提供帮助。
miR-126是新近报道的miRNAs家族成员,位于鼠的2号染色体EGFL7基因7号内含子[7]。大量研究显示,miR-126在机体多种组织发育和临床疾病如肿瘤发生中起了关键的调控作用。新近的研究[8]还发现系统性红斑狼疮患者CD4+T细胞高表达miR-126,后者通过作用于靶分子Dnmt1调控CD4+T细胞的功能。更重要的是,miR-126是PI3K-Akt信号途径传递的重要调节分子[20]。鉴于PI3K-Akt的信号途径在Tregs外周诱导中的重要性,我们首先通过实时荧光定量PCR法检测Tregs中miR-126的表达水平。结果显示,Tregs中miR-126的表达水平明显高于CD4+CD25-T细胞。多项研究表明,特定的miRNAs在T细胞的不同亚群中的差异表达对于T细胞的发育或功能具有重要意义。Zhou等[21]研究显示miR-150在胸腺T细胞的CD4-CD8-双阴性阶段低表达,在CD4+CD8+双阳性阶段和CD8+T细胞中适度表达,而在CD4+T细胞中则高表达,提示miR-150的这种动态的变化可能对T细胞的发育具有调控作用。Curtale等[22]发现,miR-146a在初始T细胞中低表达,而在记忆性T细胞中高表达,进一步的研究发现初始T细胞在TCR信号刺激下,能诱导miR-146a的表达,期间需要NF-κB和c-ETS的结合位点参与。此外,该研究还发现miR-146a能影响除炎症外的多种信号通路,能作为抗凋亡因子调控活化诱导的细胞死亡并作用于Fas相关死亡域蛋白,上调miR-146a的表达能削弱TCR刺激引起的AP-1(activator protein 1)和IL-2的产生。此外,微阵列技术分析表明,bic/miR-155缺失的小鼠CD4+T细胞表现出Th2偏向的分化,进一步研究显示小鼠的c-Maf和Itk表达升高,而c-Maf和Itk是Th2细胞分化的正向调节因子,这可能是miR-155缺失小鼠出现Th2分化偏向的原因之一[23]。因此,我们推测miR-126可能参与了Tregs外周诱导的调节过程。
作为抑制目的基因表达的手段之一,反义核酸技术也是研究miRNAs功能的有效工具,该技术是通过结合特异miRNAs,阻止其与靶基因的结合,抑制后者功能的发挥[24]。为进一步探讨miR-126是否参与Tregs的外周诱导过程,我们通过分子克隆技术构建了基于慢病毒的miR-126 ASOs表达载体,测序结果表明载体构建成功。我们进一步将miR-126 ASOs表达载体和pHelper 1.0、pHelper 2.0共转染293T细胞,将病毒收集浓缩后,通过有限稀释法测定其滴度为9×108TU/mL。然后,我们将病毒加入Tregs的体外诱导体系中,结果显示,当miR-126被特异性ASOs抑制后,Tregs的外周诱导比例明显降低。我们推测该效应可能与miR-126被抑制后,增强了PI3K-Akt信号途径的传递,从而削弱了Tregs的诱导。然而,其具体的分子机制仍待后续研究阐明。
总之,通过本实验,我们发现Tregs高表达miR-126。更重要的是,通过构建的miR-126 ASOs慢病毒表达载体,我们发现,抑制miR-126可以有效地削弱Tregs的诱导,提示miR-126可能在Tregs外周诱导中发挥了重要作用。
[1]Bartel DP.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
[2]Kim VN,Han J,Siomi MC.Biogenesis of small RNAs in animals[J].Nat Rev Mol Cell Biol,2009,10(2):126-139.
[3]Wu H,Neilson JR,Kumar P,et al.miRNA profiling of naïve,effector and memory CD8 T cells[J].PloS one,2007,2(10):e1020.
[4]Salaun B,Yamamoto T,Badran B,et al.Differentiation associated regulation ofmicroRNA expression in vivo in human CD8+T cell subsets[J].J Transl Med,2011,9:44.
[5]Tang Q,Bluestone JA.The Foxp3+regulatory T cell:a jack of all trades,master of regulation[J].Nat Immunol,2008,9(3):239-244.
[6]Zhou L,Park JJ,Zheng Q,et al.MicroRNAs are key regulators controlling iNKT and regulatory T-cell development and function[J].Cell Mol Immunol,2011,8(5):380-387.
[7]Meister J,Schmidt MH.miR-126 and miR-126*:new players in cancer[J].ScientificWorldJournal,2010,10:2090-2100.
[8]Zhao S,Wang Y,Liang Y,et al.MicroRNA-126 regulates DNAmethylation in CD4+T cells and contributes to systemic lupus erythematosus by targeting DNA methyltransferase 1[J].Arthritis Rheum,2011,63(5):1376-1386.
[9]Chen W,Jin W,Hardegen N,etal.Conversion of periph-eral CD4+CD25-naive T cells to CD4+CD25+regulatory T cells by TGF-βinduction of transcription factor Foxp3[J].JExp Med,2003,198(12):1875-1886.
[10]Sakaguchi S,Yamaguchi T,Nomura T,et al.Regulatory T cells and immune tolerance[J].Cell,2008,133(5):775-787.
[11]Curotto de Lafaille MA,Lafaille JJ.Natural and adaptive Foxp3+regulatory T cells:more of the same or a division of labor?[J].Immunity,2009,30(5):626-635.
[12]Takimoto T,Wakabayashi Y,Sekiya T,et al.Smad2 and Smad3 are redundantly essential for the TGF-betamediated regulation of regulatory T plasticity and Th1 development[J].J Immunol,2010,185(2):842-855.
[13]Gu AD,Wang Y,Lin L,et al.Requirements of transcription factor Smad-dependent and-independent TGF-beta signaling to control discrete T-cell functions[J].Proc Natl Acad Sci U SA,2012,109(3):905-910.
[14]Sauer S,Bruno L,Hertweck A,et al.T cell receptor signaling controls Foxp3 expression via PI3K,Akt,and mTOR[J].Proc Natl Acad Sci U SA,2008,105(22):7797-7802.
[15]Haxhinasto S,Mathis D,Benoist C.The AKT-mTOR axis regulates de novo differentiation of CD4+Foxp3+cells[J].JExp Med,2008,205(3):565-574.
[16]Davidson TS,DiPaolo RJ,Andersson J,et al.Cutting Edge:IL-2 is essential for TGF-beta-mediated induction of Foxp3+T regulatory cells[J].J Immunol,2007,178(7):4022-4026.
[17]Soligo M,Camperio C,Caristi S,et al.CD28 costimulation regulates FOXP3 in a RelA/NF-kappaB-dependent mechanism[J].Eur J Immunol,2011,41(2):503-513.
[18]Cobb BS,Hertweck A,Smith J,et al.A role for Dicer in immune regulation[J].J Exp Med,2006,203(11):2519-2527.
[19]Jiang S,Li C,Olive V,et al.Molecular dissection of themiR-17-92 cluster′s critical dual roles in promoting Th1 responses and preventing inducible Treg differentiation[J].Blood,2011;118(20):5487-5497.
[20]Guo C,Sah JF,Beard L,et al.The noncoding RNA,miR-126,suppresses the growth of neoplastic cells by targeting phosphatidylinositol 3-kinase signaling and is frequently lost in colon cancers[J].Genes Chromosomes Cancer,2008,47(11):939-946.
[21]Zhou B,Wang S,Mayr C,et al.miR-150,a microRNA expressed in mature B and T cells,blocks early B cell developmentwhen expressed prematurely[J].Proc Natl Acad Sci U SA,2007,104(17):7080-7085.
[22]Curtale G,Citarella F,Carissimi C,et al.An emerging player in the adaptive immune response:microRNA-146a is amodulator of IL-2 expression and activation-induced cell death in T lymphocytes[J].Blood,2010,115(2):265-273.
[23]Turner M,Vigorito E.Regulation of B-and T-cell differ
entiation by a single microRNA[J].Biochem Soc Trans,2008,36(Pt3):531-533.
[24]WacheckV,Zangemeister-Wittke U.Antisensemolecules for targeted cancer therapy[J].Crit Rev Oncol Hematol,2006,59(1):65-73.
Construction of a lentiviral vectors of antisense oligonucleotide targeting on them iR-126 and its signficance
YANG Xue-yi1,2,LU Xiao-dong1,SHAO Qi-xiang1,LIU Jia-xiu2,LIU Juan3
(1.Department of School of Medical Science and Laboratory Medicine,Jiangsu University,Zhenjiang Jiangsu 212013;2.Departmentof Laboratory&Pharmacy,Huaiyin Advanced Vocational&Technical School Of Health,Huai′an Jiangsu 223300;3.Departmentof Laboratory Medicine,the Forth People′s Hospital of Huai′an,Huai′an Jiangsu 223002,China)
Objective:To evaluate the expression of miR-126 in human peripheral blood CD4+CD25+regulatory T cells(Tregs),construct a lentiviral vector of antisense oligonucleotides(ASOs)againstmiR-126.M ethods:The expression level ofmiR-126 in Tregs and CD4+CD25-T cellswas determined by real-time PCR respectively.The ASOs againstmiR-126 were synthesized and inserted into the pGCsil-LV-GFP plasmid and constructed the pGCsil-miR-126-ASOs plasmid which was indentified by RT-PCR and DNA sequencing.Additional,pHelper 1.0,pHelper 2.0 and pGCsil-miR-126-ASOs vectors were cotransfected into 293T cells by LipofectamineTM2000.After 48 h cultrue,the supernatantwas harvested and the titer of pGCsil-miR-126-ASOs lentivirus was determined by limiting dilution analysis.Finally,CD4+CD62L+naïve T cellswere infected with pGCsil-miR-126-ASOs lentivirus at MOI(multiplicity of infection)=100 and cultured in the presence of anti-CD3 antibody and anti-CD28 antibody plus IL-2 and TGF-βfor another 72 h,the expression of Foxp3 was analyzed by flow cytometry.Results:The expression level ofmiR-126 in Tregswas significantly higher than CD4+CD25-T cells(P<0.01).Furthermore,themiR-126 ASOs inhibited the induction of Tregs in vitro(P<0.05).Conclusion:The lentiviral vector ofmiR-126 ASOswas constructed successfully and laid the foundation for the further re- search on themiR-126 ASOs in regulation of Treg functions.
miR-126;CD4+CD25+regulatory T cells;antisense oligonucleotides;lentiviral vector
R392.1
A
1671-7783(2014)01-0012-06
10.13312/j.issn.1671-7783.y130116
杨学艺(1980—),男,硕士研究生;邵启祥(通讯作者),教授,博士研究生导师,E-mail:shao-qx@mail.ujs.edu.cn
2013-05-31 [编辑]陈海林

