罗氏HIV-1定量检测引物SK145和SKCC1B的评估及优化
樊路娟,张春霞,徐庆刚,张驰宇
(1.江苏大学生命科学研究院,江苏镇江212013;2.中国科学院上海巴斯德研究所,上海200025)
罗氏HIV-1定量检测引物SK145和SKCC1B的评估及优化
樊路娟1,2,张春霞1,徐庆刚1,张驰宇1,2
(1.江苏大学生命科学研究院,江苏镇江212013;2.中国科学院上海巴斯德研究所,上海200025)
目的:评估罗氏HIV-1检测系统中引物SK145和SKCC1B对不同亚型HIV-1病毒定量检测的广谱性及准确性,并在此基础上对该引物进行优化。方法:下载并分析5个主要HIV-1流行亚型(B、C、A、01_AE、D)在引物SK145和SKCC1B扩增区段的对应序列,从各亚型筛选出所占比例最高的5条序列构建定量标准品。用梯度稀释的HIV-1各亚型标准品来评估引物SK145和SKCC1B的扩增效率。为改善引物SK145和SKCC1B对HIV-1不同亚型扩增的准确性和广谱性,我们重新设计了一对简并引物并分析其对不同亚型病毒的扩增效果。结果:引物SK145、SKCC1B对于B亚型病毒的扩增效果最好,而对非B亚型病毒的扩增效果并不理想,简并引物能显著改善对各亚型HIV-1病毒扩增的效果。结论:罗氏引物SK145和SKCC1B不适用于非B亚型HIV-1病毒载量的定量检测,而优化设计的简并引物能改善对各亚型HIV-1病毒的扩增效率,因而可用于中国等HIV-1多亚型共流行国家的HIV-1病毒载量检测。
人类免疫缺陷病毒1型;实时荧光定量PCR;SK145;SKCC1B
人类免疫缺陷病毒1型(human immunodeficiency virus type 1,HIV-1)是导致全球艾滋病(acquired immunodeficiency syndrome,AIDS)流行的主要病原体。HIV-1的遗传异质性是影响病毒载量定量可靠性的一个重要因素,而所有的核酸扩增或信号扩增技术都依赖于HIV-1序列特异性的引物和(或)探针,引物(探针)结合区的核苷酸不匹配会干扰杂交从而影响定量结果的可靠性。
罗氏分子系统(Roche Molecular Systems)的HIV-1病毒载量检测技术中,AMPLICOR®HIV-1 MONITOR Test version 1.5和COBAS®AMPLICOR HIV-1 MONITOR Test version 1.5都获得美国食品和药物管理局(Food and Drug Administration,FDA)认证,是临床监控正在进行抗病毒治疗HIV-1患者病毒载量的金标准[1-2]。这两种检测方法使用相同的引物SK145、SKCC1B,得到155 bp的扩增产物。
本实验目的在于评估引物SK145、SKCC1B对高度变异型病毒HIV-1定量检测的广谱性及准确性,并且在此基础上设计了一对广谱性更高、特异性更强的简并引物de-F、de-R。
1 材料与方法
1.1 材料
1.1.1 细胞和载体 JM109感受态细胞、pGH载体(上海捷瑞生物工程有限公司)。
1.1.2 主要试剂盒及试剂 柱式质粒DNAout(北京天恩泽基因科技有限公司);ScaⅠ购自宝生物工程(大连)有限公司;DNA片段纯化试剂盒(TaKaRa公司);快捷型琼脂糖凝胶DNA回收试剂盒(离心柱型)Ⅱ型(北京百泰克生物技术有限公司);实时PCR试剂盒SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)购自宝生物工程(大连)有限公司。
1.1.3 主要仪器 One DropTMOD-1000分光光度计(南京五义科技有限公司)、Mx3000P/3005P实时荧光定量PCR仪(美国安捷伦公司)。
1.2 方法
1.2.1 序列筛选与合成 根据HIV数据库(http:/www.hiv.lanl.gov/components/sequence/HIV/geo/geo.comp)中全球HIV-1序列分布情况,选取所占比例最高的5个亚型:B(58.2%),C(15.1%),A(7.5%),01_AE(4.7%),D(3.7%)。这5个亚型的病毒占感染样本总比例的89.2%,可用来全面准确地评估引物SK145、SKCC1B对不同亚型HIV-1病毒的扩增效率。由于引物SK145(1359→1388)、SKCC1B(1513→1486)的扩增产物位于HIV-1基因组1359→1513区段,因此本实验从HIV数据库中下载这5个亚型病毒在HIV基因组1359→1513区段的所有序列,用MEGA5处理并经DAMBE比对后从各亚型分别筛选出占比例最高的5条序列,并统计数据。用MEGA5处理上述25条序列并删除上下游引物间区域(1389→1485)只保留上下游引物对应区序列,用DAMBE继续比对后得到15条独特序列。找到这15条序列所对应原始序列并在1359→1513区段前后各延伸5 bp得到长165 bp(1354→1518)的15条序列:A1,A3,A5,B1,B2,B4,C2,C4,D1,D3,D4,01_AE1,01_AE2,01_AE4,01_AE5。由上海捷瑞生物工程有限公司合成这15条序列并克隆到pGH载体。
1.2.2 简并引物设计和合成 处理并统计上述各亚型毒株在引物SK145、SKCC1B扩增区段(1359→1513)所占比例最高的5条序列(5个亚型×5条),分别只保留上游和下游引物对应区序列,比对所得的25条上游(1359→1388)和下游(1513→1486)引物区对应序列,并统计各一致序列条数,根据上下游引物区序列比对结果并充分考虑GC含量、3′末端序列等因素后设计出上下游简并引物:de-F(AGTGGGGGGACAYCARGCAGC)、de-R(TACTAGTAGTTCCTGCTATRTCACTTCC),并由上海生工公司合成。
1.2.3 制备重组质粒 将克隆到pGH载体的重组质粒转化到JM109感受态细胞,挑单菌落扩大培养后用菌液PCR筛选阳性克隆,按照柱式质粒DNAout试剂盒的操作说明提取质粒。
1.2.4 Sca I酶切质粒 pGH载体上有一个ScaⅠ酶切位点,可使环状质粒变为线性质粒。酶切体系:ScaⅠ2.5μL,10×H缓冲液5μL,质粒DNA≤2.5μg,加灭菌水补足50μL总体系,37℃酶切4 h后,取4μL酶切反应液电泳观察其条带,判断酶切是否完全。
1.2.5 纯化线性质粒 将所得线性质粒的酶切反应液按快捷型琼脂糖凝胶DNA回收试剂盒(离心柱型)Ⅱ型操作说明进行纯化。
1.2.6 制备15个亚型线性质粒储存液 用超微量紫外分光光度计测纯化后线性质粒的纯度和浓度,纯度要求D(260 nm)/D(280 nm)的值介于1.8~2.0,质粒拷贝数(拷贝/mL)=D(260 nm)× 50μg/mL×10-6×6.02×1023/[650(dolton/bp)×碱基对数目],计算得到质粒浓度。用pH 8.0的1× TE将各亚型线性质粒浓度调整到109拷贝/mL,每管100μL分装多管,-20℃储存备用。
1.2.7 评估引物SK145、SKCC1B对15个亚型线性质粒的扩增效率 用pH 8.0的1×TE对15个亚型线性质粒的储存液(每次定量时各取出一管冰上融化)进行10倍梯度连续稀释,选取1×108拷贝/mL、1×107拷贝/mL这两个梯度的稀释液为模板,SK145、SKCC1B为上下游引物,B1亚型线性质粒109~105copies/mL的稀释液为标准品,进行SYBR Green荧光定量,各亚型各浓度梯度重复定量3次。冰上配置PCR体系(20μL):SYBR®Premix Ex TaqTMⅡ10.0μL,SK145(10μmol/L)0.8μL,SKCC1B(10 μmol/L)0.8μL,ROX参比染料0.4μL,质粒模板2.0μL,灭菌蒸馏水6.0μL。PCR反应程序:预变性95℃30 s;两步法扩增95℃5 s,60℃34 s,循环40次;熔解曲线95℃15 s,60℃1 min,每30 s升温0.5℃,循环71次后达95℃,95℃15 s。反应结束后系统自动生成标准曲线和熔解曲线,并给出各亚型线性质粒的拷贝数(即实验值)。计算荧光定量实验值/理论值的百分比,并汇总分析。
1.2.8 评估简并引物de-F、de-R对15个亚型线性质粒的扩增效率 以de-F、de-R为上下游引物,采用SYBR Green荧光定量(方法同1.2.7)对15个亚型线性质粒的扩增效率进行评估。
2 结果
2.1 线性质粒的电泳结果
将各亚型的重组质粒单酶切并纯化后得线性质粒,电泳后得到3 082 bp的条带(图1),和预期产物结果一致。
图1 线性质粒和环状质粒
2.2 B1亚型线性质粒标准品的扩增曲线、标准曲线和熔解曲线结果
将梯度稀释的B1亚型线性质粒标准品(109~105拷贝/mL),用荧光定量PCR重复测定3次,每次每个稀释度重复3管,荧光定量PCR结束后系统会自动生成扩增曲线、标准曲线和熔解曲线,见图2。如图所示各梯度扩增曲线间隔分布均匀,且标准曲线的相关系数R2=0.997,说明线性质粒在此稀释范围内有良好的线性关系。回归方程:Y=-3.490× Log(X)+39.25,扩增效率为93.4%,说明反应体系及反应条件适宜且扩增效率较高。熔解曲线结果为单峰,产物T m值(熔解温度)一致(均为85℃),说明引物特异性强,无非特异性扩增。
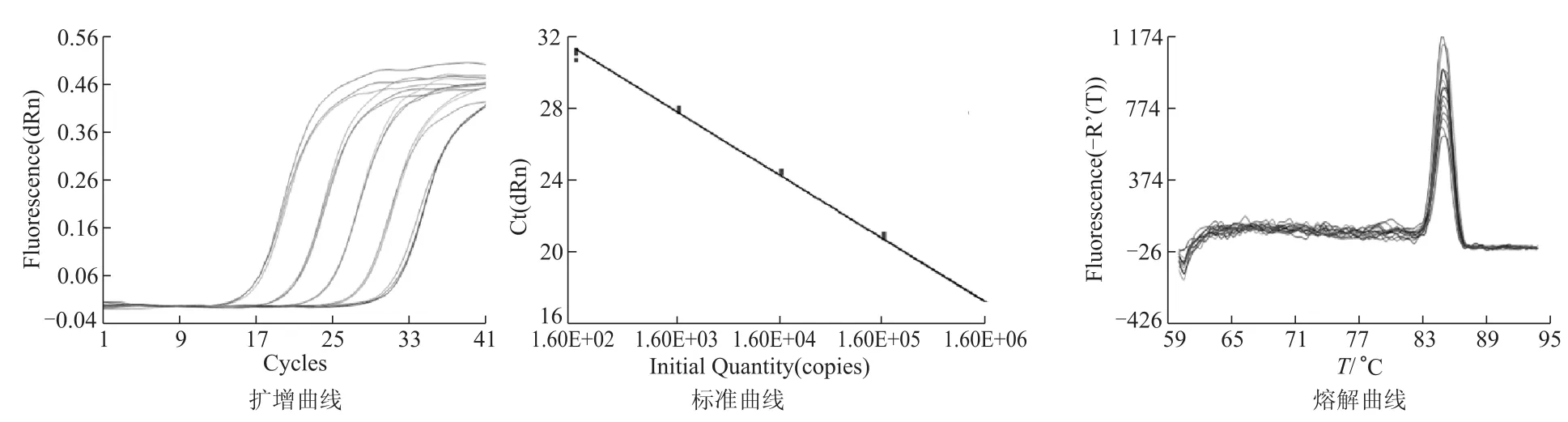
图2 扩增曲线、标准曲线和熔解曲线
2.3 简并引物设计
各亚型毒株分别在引物SK145(1359→1388)、SKCC1B(1359→1513)对应区域所占比例最高的5条序列(5个亚型×5条),汇总结果如图3所示。分别比对这25条上游和下游引物对应区序列,并统计各一致序列条数,结果见图3。
在充分考虑上述5种流行亚型序列特征的基础上设计简并引物,其序列如下:de-F:AGTGGGGGGACAYCARGCAGC,de-R:TACTAGTAGTTCCTGCTATRTCACTTCC。
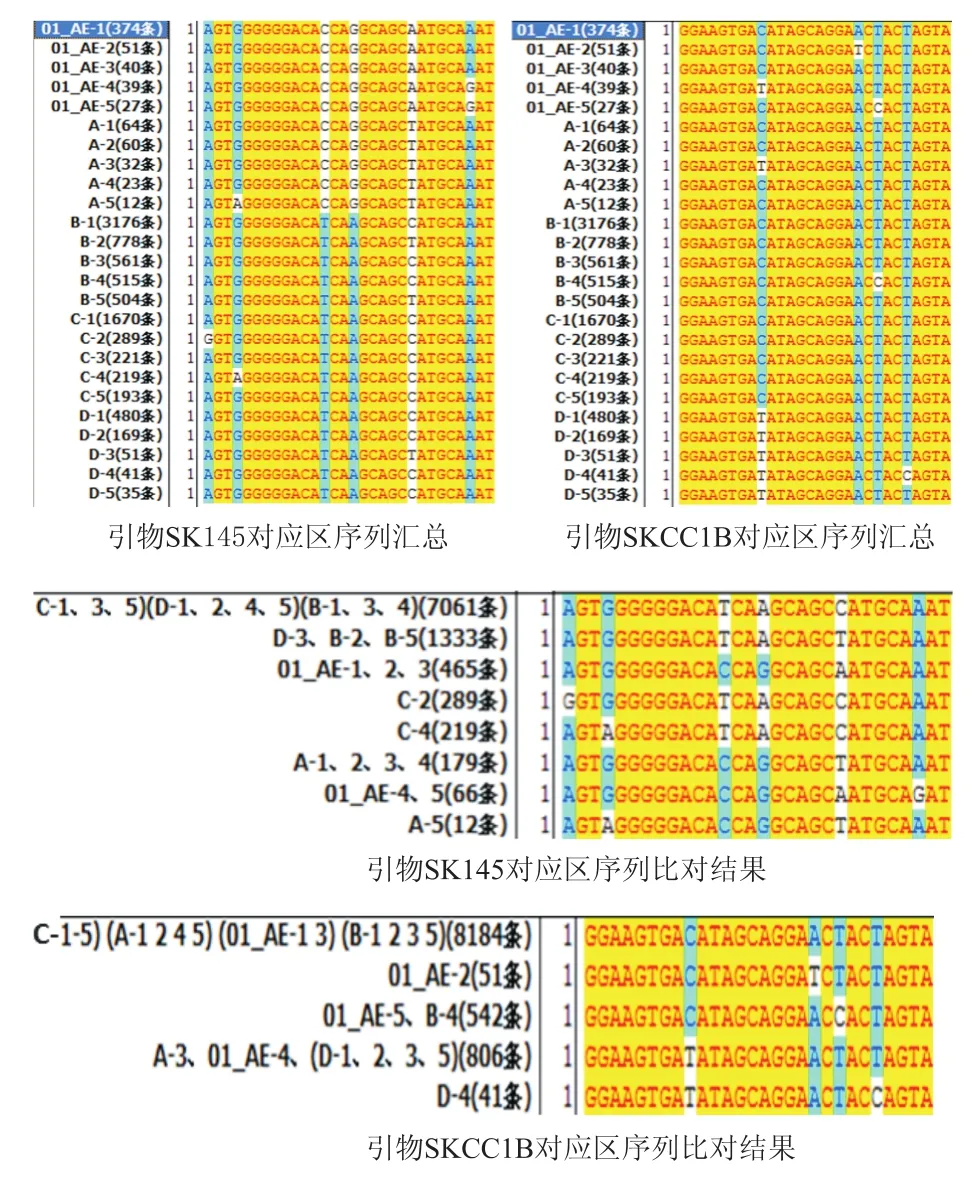
图3 引物SK145、SKCC1B对应区序列比对及简并引物设计
2.4 各引物对15个亚型基因片段定量的可靠性比较
分别以SK145、SKCC1B和简并引物de-F、de-R为上下游引物,对15个亚型基因片段的标准品(1×108拷贝/mL、1×107拷贝/mL)进行SYBR Green实时定量,计算所得实验值/理论值,各亚型各浓度分别重复定量3次,将实验值/理论值的数据汇总并计算平均值与标准差(图5),结果显示引物SK145、SKCC1B对于B亚型的扩增最为有效,而对其他亚型的扩增效果则不太理想(对A、C、D、01_AE亚型病毒的扩增效率分别为25.3%、44.39%、42.43%、35.9%),这可能造成在对非B亚型HIV-1病毒定量时低估其病毒载量。使用简并引物de-F、de-R后,除少部分D亚型和01_AE亚型的线性质粒外,其余大部分亚型的线性质粒扩增效果都有显著改善(对A、C、D、01_AE这4个亚型病毒的扩增效率分别提高到31.58%、58.41%、47.82%、43.12%),说明所设计的简并引物对各亚型HIV-1病毒的扩增效果比引物SK145、SKCC1B更好,用于病毒载量测定也会使定量结果更加准确可靠。
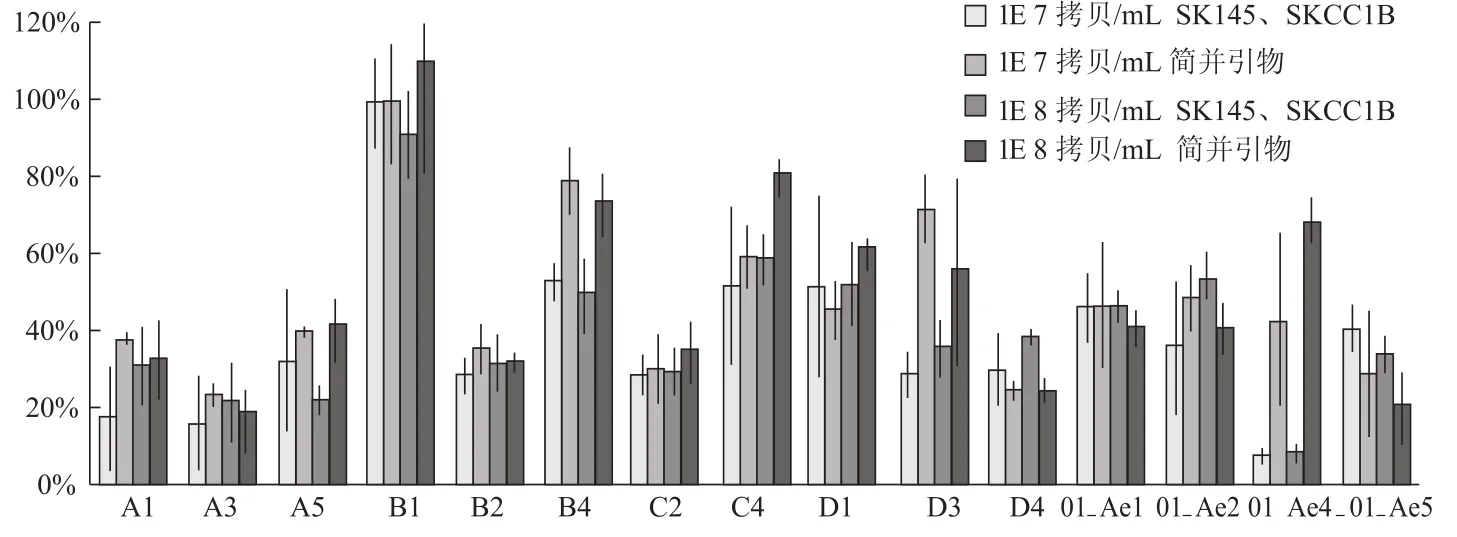
图5 两对引物对15个亚型基因片段扩增效果的比较
3 讨论
血浆病毒载量对于疾病恶化的预测以及治疗药物和疫苗潜能的评估至关重要,并且血浆中HIV RNA的定量已经成为HIV-1感染者预后以及监控抗病毒治疗效果的主要工具[3-4],也是治疗方案的一大重要组成部分[5]。HIV-1亚型间的遗传变异以及同一HIV亚型内的极端变异显著影响了临床样本中病毒RNA的检测和定量能力,而HIV-1血浆病毒血症无论是假阴性还是过低定量甚至是过高定量都可能对患者的治疗产生严重影响。目前现有的HIV-1病毒载量检测技术能够对HIV-1病毒载量进行较好的定量,罗氏分子系统的AMPLICOR®HIV-1 MONITOR Test version 1.5和COBAS®AMPLICOR HIV-1 MONITOR Test version 1.5更成为定量的金标准。
比较对这两种诊断方法进行评估的国内外研究结果,发现他们大多采用对一定数量临床样品进行定量,然后比较这两种方法所得定量结果与其他商业化检测方法定量结果之间的一致性和相关性的策略。该评估策略不够系统和全面,其缺陷主要有两个方面,首先所用临床样品不能涵盖大多数流行亚型,且样品量不够丰富;其次,虽与其他检测方法进行了比较,但是并没有与样品中真正所含病毒载量进行比较,因而无法判断其定量结果的准确可靠性。
为解决上述问题,本实验精心设计实验方案并全面搜集数据,对AMPLICOR®HIV-1 MONITOR Test version 1.5和COBAS®AMPLICOR HIV-1 MONITOR Test version 1.5中所使用的引物SK145、SKCC1B进行了全面而系统的评估,结果发现该对引物对B亚型病毒的扩增最为有效,而对其他亚型病毒的扩增效果并不理想,尤其是对A亚型病毒的定量结果显著偏低。为改善引物的扩增效果,我们在原引物的基础上设计了一对简并引物de-F、de-R。使用简并引物后,除少部分D亚型和01_AE亚型的质粒标准品外,其余大部分亚型的扩增效果都有显著改善。
由于罗氏HIV-1检测系统中的引物SK145和SKCC1B只对B亚型毒株有良好的扩增效果,因而适用于北美洲(B亚型流行比例为98.0%)、中美洲(B亚型流行比例为99.6%)等B亚型毒株盛行区域的HIV-1病毒载量检测,但是对于中国(B亚型31.3%、07_BC占28.3%、01_AE占23.5%)等HIV-1多亚型共流行国家的HIV-1病毒载量检测则不够适用。我们优化设计的简并引物对各亚型毒株的扩增效率都有显著改善,可用于中国等HIV-1多亚型共流行国家的HIV-1病毒载量的检测。然而由于HIV-1病毒的高度变异性,我们所设计的简并引物并不能改善所有亚型的扩增效率,还需要继续寻找更加保守的区段、采用更为缜密的方法来设计更为理想的引物与探针,以进一步改善HIV-1定量检测方法的准确度和广谱性。
[1]Cobb BR,Vaks JE,Do T,etal.Evolution in the sensitivity of quantitative HIV-1 viral load tests[J].JClin Virol,2011,52(Suppl 1):S77-S82.
[2]Palmer S,Wiegand AP,Maldarelli F,et al.New realtime reverse transcriptase-initiated PCR assay with single-copy sensitivity for human immunodeficiency virus type 1 RNA in plasma[J].JClin Microbiol,2003,41(10):4531-4536.
[3]Triques K,Coste J,Perret JL,etal.Efficiencies of four versions of the AMPLICOR HIV-1 MONITOR test for quantification of different subtypes of human immunodeficiency virus type 1[J].JClin Microbiol,1999,37(1):110-116.
[4]Luft LM,Gill MJ,Church DL.HIV-1 viral diversity and its implications for viral load testing:review of current platforms[J].Int J Infect Dis,2011,15(10):e661-e670.
[5]Skidmore SJ,Zuckerman M,Parry JV.Accuracy of plasma HIV RNA quantification:a multicentre study of variability[J].JMed Virol,2000,61(4):417-422.
Assessment and optim ization of Roche SK 145 and SKCC1B primers for quantification of human immunodeficiency virus type 1
FAN Lu-juan1,2,ZHANG Chun-xia1,XU Qing-gang1,ZHANG Chi-yu1,2
(1.Institute of Life Sciences,Jiangsu University,Zhenjiang Jiangsu 212013;2.Institute Pasteur of Shanghai,Chinese Academy of Sciences,Shanghai200025,China)
Objective:To assess and optimise applicability and accuracy of primers SK145 and SKCC1B for different HIV-1 subtypes in viral load quantification assay.M ethods:We downloaded and analyzed genomic sequences of fivemain HIV-1 subtypes(B,C,A,01_AE,D)with the primers SK145 and SKCC1B target.The top five dominant sequenceswere selected from each subtype sequences for the construction of quantification standards.We evaluated amplification efficiency of primers SK145 and SKCC1B for serially diluted standards of each HIV-1 subtype.To improve the amplified spectrum primers SK145 and SKCC1B for different HIV-1subtypes,re-designed this primer pair into degenerate primers according to the top dominant sequences of different HIV-1 subtypes.Results:The amplification efficiency of primers SK145 and SKCC1B was best on quantification HIV-1 subtype B,but not ideal for the non-B subtypes,indicating that primers SK145 and SKCC1B were not able to quantify accurately the viral load of non-B HIV-1 subtypes.When the degenerate primerswere used,we obtained relatively consistent amplification efficiency for various HIV-1 subtypes.Conclusion:Roche SK145 and SKCC1B primerswere unsuitable for viral RNA quantification of HIV-1 non-B subtypes.Compared to Roche SK145 and SKCC1B primers,the optimized degenerate primers can efficiently amplify various HIV-1 subtypes,suggesting that they can be used for HIV-1 viral load assay in China and other countrieswhere various HIV-1 subtypes are co-criculating.
human immunodeficiency virus type 1;real-time PCR;SK145;SKCC1B
樊路娟(1988—),女,硕士研究生;张驰宇(通讯作者),研究员,博士,E-mail:zhangcy1999@ips.ac.cn
R512.91
A
1671-7783(2014)01-0026-05
10.13312/j.issn.1671-7783.y130207
国家自然科学基金资助项目(81071391)
2013-09-16 [编辑]何承志

