布洛芬固体脂质纳米粒的制备及家兔体内药动学研究
车成凯,宋真玉,梁荣才,孙考祥,王爱萍
(1.烟台大学药学院,山东 烟台 264005; 2.山东绿叶制药有限公司,山东 烟台 264003)
近年来,微载体透皮给药研究取得较大进展.固体脂质纳米粒(solid lipid nanoparticle,SLN)以其生理相容性好、体内可降解、适宜工业化生产等特点而日益受到重视[1].SLN用于经皮给药具有独特优势[2],如皮肤附着性强,释药缓慢使皮肤表面长时间保持较高浓度,药物易吸收;在皮肤表面成膜,通过封闭效应减少表皮水分流失,增强角质层水合作用提高药物透皮率;纳米级粒度使其易于通过融合和穿透机制经皮渗透;皮肤刺激性小等.SLN作为新型经皮给药微载体,可用于乳剂、霜剂及膜控储库型贴剂等多种经皮给药系统的设计,在提高药物的生物利用度、提高药物的经皮吸收并控制药物释放方面具有广阔应用前景.
布洛芬(ibuprofen,IB)具抗炎、镇痛和解热作用,临床上用于风湿及类风湿性关节炎和强直性脊椎炎等,其抗炎、镇痛作用强.但IB生物半衰期短,患者须频繁给药以保持有效治疗浓度;口服生物利用度低,长期服用对胃肠道刺激作用较大[3],因此,关于布洛芬的透皮吸收制剂的研究方兴未艾[4-5],本研究旨在将布洛芬包埋于固体脂质纳米粒中,并将其制成透皮给药系统:(1)可避免胃肠道刺激和肝脏首过效应,提高生物利用度;(2)通过缓释长效特性获得持续稳定血药浓度,提高治疗效能、安全性和患者依从性.
本课题采用乳化分散-超声法制备布洛芬固体脂质纳米粒(IB-SLN),并进行IB-SLN家兔体内经皮渗透研究,为基于SLN的经皮给药系统设计和临床应用奠定基础.
1 仪器与材料
Angilent 1100高效液相色谱仪,DF-101S集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司),SK250HP型超声清洗器(上海科导超声仪器有限公司),Biofuge Primo-R 离心机(SORVALL),ZLS380激光粒径仪(PSS.NICOMP公司 USA).布洛芬(湖北百科亨迪药业有限公司),肝素(天津生物化学制药厂),卵磷脂(上海太伟药业),羧甲基纤维素钠(安徽山河药用辅料有限公司),1,2-丙二醇(上海光华试剂厂),甲醇(色谱纯,天津市博迪化工有限公司);葡聚糖凝胶G-50(北京经科宏达生物技术有限公司);其他试剂均为市售分析纯试剂.
Wistar大鼠(体重200~300 g),合格证号:SCXK(鲁)2009-0009,健康家兔6只(体重2.5~3.5 kg),动物合格证号SYXK(鲁)20090015,均由山东绿叶制药有限公司提供.
2 实验方法
2.1 HPLC色谱条件
色谱柱:CenturySIL C18 ODS 柱(200×4.6 mm,5 μm),流动相:甲醇-0.01 mol/L KH2PO4-H3PO4(400∶100∶1.2),检测波长:228 nm,流速:1.0 mL/min,柱温:30 ℃;进样量:10 μL.该色谱条件下,IB的保留时间为7 min左右,血浆中的杂质成分、皮肤渗出物杂质及处方成分对其测定无干扰.
2.2 IB-SLN及凝胶剂的制备
IB-SLN的制备:参考文献[6],采用乳化分散-超声法制备IB-SLN.称取布洛芬0.06 g、磷脂0.1 g和单硬脂酸甘油脂0.05 g置少量无水乙醇中,加热溶解,得油相.另称取处方量吐温-80 0.1 g和F-68 0.1 g溶于水中,构成水相.于70 ℃,1 000 r/min搅拌转速下,将油相加入水相中,并继续搅拌20 min除去乙醇,得蓝色透明状微乳.将微乳迅速分散到4 ℃水中,搅拌10 min,超声1 h,0.45 μm微孔滤膜过滤,即得IB-SLN.
IB及IB-SLN凝胶剂的制备:将羟丙甲基纤维素2.4 g分散至IB水溶液或IB-SLN水分散液中,充分溶胀后搅拌均匀,依次加入甘油0.5 g、丙二醇20%及薄荷醇5%,搅匀,即得.
2.3 IB-SLN体外评价
2.3.1 粒径及zeta电位测定 取适量IB-SLN,加入U型电泳池中,用激光粒度仪测定其粒径及zeta电位.
2.3.2 载药量及包封率的测定 参考文献[7],采用微柱离心法测定IB-SLN的包封率.取IB-SLN 0.5 mL 置Sephadex G 50葡聚糖凝胶微柱中,离心,收集离心液,以PBS (pH=7.4)洗脱分离游离药物和SLN,合并收集的4份SLN离心液于5 mL量瓶中,用甲醇破乳并定容,HPLC法测定.另取同体积的IB-SLN不经柱处理,甲醇破乳并稀释,HPLC法测定.
2.3.3 体外透皮实验研究 大鼠麻醉后,用电动剃毛刀除去腹部毛,剥取腹部皮肤,并除去皮下脂肪组织,生理盐水冲洗干净,备用.将鼠皮固定在Franz扩散池中间,以角质层侧对向供给室.以PBS为接收液,液面恰好与皮肤内层接触.然后分别取IB-SLN凝胶剂及IB凝胶置于皮肤表面,保持恒速搅拌和37 ℃的水浴恒温,分别于1,2,4,6,8,10,12,24 h取样2 mL,同时补充等体积释放液.HPLC法测定IB含量,计算累积渗透量.有效透过面积为1.33 cm2,接受室体积为17.5 mL.
2.4 兔体内药动学研究
2.4.1 试验方案及血浆样品的处理 实验用家兔6只,随机分为2组(IB-SLN组和IB组),于给药前一天耳部内侧脱毛.按剂量96 mg/kg分别给予IB-SLN凝胶剂或IB凝胶剂,并于经皮给药后10,20,30 min及l,2,4,6,8,12,24 h于另一侧耳耳缘静脉取血1 mL,置肝素化试管中,3 000 r/min离心10 min,分离血浆样品,并于-20 ℃冰箱中保存待用.
血浆样品于离心管中3 000 r/min离心15 min,取上层血浆0.5 mL,加入0.1 mL盐酸(1 mol·L-1)酸化后,以正己烷与乙醚(8∶2) 3 mL萃取,涡旋混匀后,3 000 r/min离心15 min,吸取上层置另一试管中,残液同法再提取一次,合并两次提取液,40 ℃水浴条件下,氮气流吹干,然后用100 μL流动相溶解,10 000 r/min离心15 min,上清液HPLC测定药物含量.
2.4.2 方法学考察
(1)线性范围及定量下限.精密称取布洛芬对照品适量,加甲醇配成浓度为0.1 g·L-1的标准溶液,然后以流动相稀释成系列浓度的溶液.取家兔空白血浆,分别加入各标准溶液配制成相当于布洛芬浓度依次为1,2,4,10,20,40 μg·mL-1的血浆样品,按血浆样品处理方法处理后,HPLC进样,记录色谱图和峰面积.以布洛芬浓度为横坐标,峰面积为纵坐标,进行回归分析.回归方程为y=7.86x-43.7(r=0.999 2),即布洛芬在1~40 μg/mL浓度范围内与峰面积线性关系良好,最低定量限为1 μg/mL.
(2)精密度.取家兔空白血浆,按2.4.2(1)项下的方法配制布洛芬浓度分别为1,10,40 μg/mL的低、中、高3个浓度样品,以血浆预处理的方法提取,复溶后HPLC进样测定,每一浓度样品平行操作6份,连续测定3 d,根据测定结果计算高中低3个浓度的日内和日间RSD分别为2.3%,2.5%,3.1%和3.7%,2.2%,3.2%.
(3)回收率试验.取家兔空白血浆4份各0.5mL,分别加入8、16、24 μL布洛芬标准溶液(0.1g·L-1),以血浆预处理的方法提取,复溶后进样测定,计算平均回收率为94.7%,RSD为3.7%.
3 实验结果
3.1 IB-SLN质量评价结果
所制备的IB-SLN测得其平均粒径为(100±20) nm,多分散指数值为0.689,zeta电位为-43.9 mV,载药量为3.33%,包封率为92.6%.
3.2 体外经皮渗透实验结果
IB-SLN及IB凝胶剂体外透过大鼠皮肤累积渗透量-时间曲线见图1.从图1可以看出,与IB凝胶剂相比,SLN显著增强了布洛芬的经皮透过率,增渗倍数为5.1.IB-SLN凝胶剂24 h内累积透过量达1 417 μg/cm2,透过率达42.7 %,而IB凝胶剂仅为278 μg/cm2和8.1%.
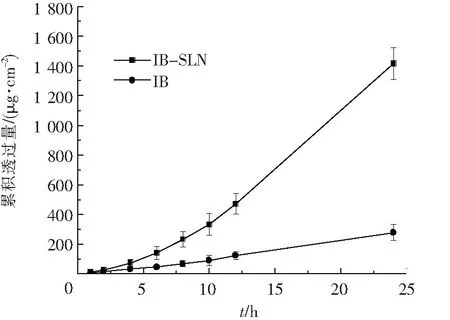
图1 IB凝胶剂及IB-SLN凝胶剂经皮渗透累积渗透量-时间曲线
3.3 体内药动学结果
IB-SLN凝胶剂及IB凝胶剂透皮给药后,不同时间点测定血药浓度,绘制药物浓度-时间曲线见图2,药动学参数见表1.
由IB-SLN及IB凝胶剂经皮给药后兔体内血药浓度-时间曲线及药动学参数可知:(1)IB-SLN可有效促进布洛芬的经皮吸收,IB-SLN组Cmax和AUC分别为65.94 ng·h/mL和640.86 ng/mL,是IB组的4.5和12.6倍.(2)IB-SLN给药后达峰快,起效迅速;(3)IB-SLN前期适当突释后持续缓慢释放,提供持续平稳的血药浓度.以上结果表明,SLN作为IB经皮给药的载体可有效促进其透皮吸收,提高药物的生物利用度,且可达到长效缓释作用.
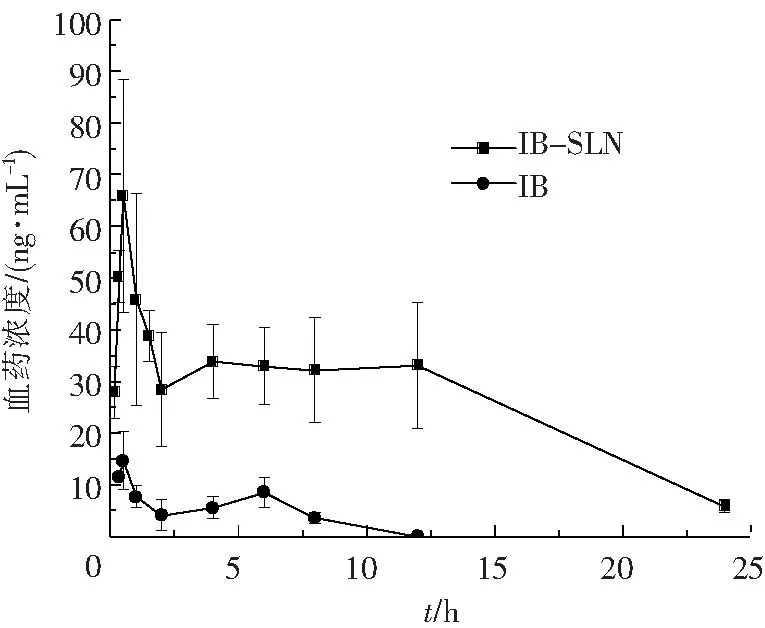
图2 IB凝胶剂及IB-SLN凝胶剂经皮给药后兔体内药-时曲线
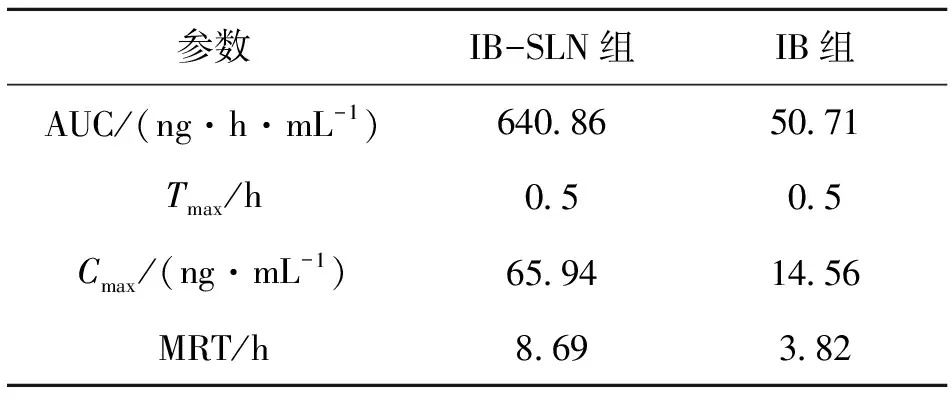
表1 IB凝胶剂及IB-SLN凝胶剂经皮给药后体内药动学参数
4 讨 论
本研究采用乳化分散-超声法制备布洛芬固体脂质纳米粒,在制备过程中,磷脂的状态对固体脂质纳米粒的载药量有很大影响.因此研究采用乙醇做为溶剂,对主药及磷脂溶解较好,有效提高了磷脂的乳化效果,所制备的固体脂质纳米粒包封率较高,达92.6%.
本研究将布洛芬包埋于固体脂质纳米粒中,经皮给药后:(1)IB-SLN凝胶剂药时曲线下面积明显增加,表明IB被SLN包埋后可明显增加其透皮效率,解决局部用药时单纯被动扩散透皮吸收少,不易达到治疗浓度的问题,从而提高了布洛芬的生物利用度;(2)IB-SLN给药初期具适当的突释,可能是由于吸附于纳米粒表面或近表面的药物在接触到释放介质之后快速扩散所致,这一突释可使IB-SLN快速达到有效血药浓度从而快速达到有效治疗效果;(3)IB-SLN随后持续平稳释放,主要是药物均匀分散在固体骨架中缓慢扩散所形成,达到了缓释效果.
本研究将布洛芬制成固体脂质纳米粒后达到了预期的促渗及缓释效果,提高了药物经皮给药后的局部浓度,有利于对局部炎症和疼痛的治疗;延长了药物作用时间,减少了用药次数,提高了患者的顺应性;血药浓度平稳,避免了口服布洛芬出现的“峰谷”现象,减少了全身不良反应,有望开发成为新的布洛芬外用制剂.
参考文献:
[1] 王建新,张志荣. 固体脂质纳米粒的研究进展[J]. 中国药学杂志,2001,36(2): 73-76.
[2] Souto E B,Wissing S A,Barbosa C M,et al. Evaluation of the physical stability of SLN and NLC before and after incorporation into hydrogel formulations [J]. Eur J Pharm Biopharm,2004,58(1): 83-90.
[3] 边清国.布洛芬的不良反应[J]. 中国医院药学杂志,1988,8 (12):550.
[4] 陈华兵,翁婷,常雪灵,等.布洛芬微乳的制备及其透皮吸收研究[J]. 中国药学杂志,2004,39(1):43-45.
[5] 张莉,齐刚,朱辉. 布洛芬透皮吸收制剂的家兔体内药代动力学研究[J]. 中国药学杂志,2000,35(3):189-191.
[6] 余克富,逄秀娟,马英杰,等. 布洛芬固体脂质纳米粒的制备及性质考察[J]. 中国药剂学杂志,2009,7(30):91-99.
[7] 洪慧,龙晓英,李力任,等. 葡聚糖微型凝胶柱测定辣椒碱柔性脂质体包封率的条件探讨[J]. 广东药学院学报,2005,21(2):120-123.

