舒林酸对人胰腺癌细胞PANC1增殖凋亡及Wnt通路的影响
邹金艳 商建 易三凤 伍威 林军
Wnt/β-catenin信号通路直接影响胰腺癌细胞的增殖、分化和迁移。研究发现,在许多肿瘤组织中Wnt/β-catenin信号通路异常激活[1-4]。β-catenin在胰腺上皮内瘤变(pancreatic intraepithelial neoplasia, PanIN)及胰腺癌蛋白的核内高度积聚[5]。文献报道[6],非甾体抗炎药(non-steroidal anti-inflammatory drugs, NASIDs)能抑制结肠癌组织中Wnt/β-catenin信号通路,抑制β-catenin的核聚集及β-catenin/TCF靶基因的转录。但NASIDs对胰腺癌的作用目前少有研究。本研究应用NASIDs的舒林酸处理人胰腺癌细胞PANC1,观察其对PANC1细胞增殖、凋亡及Wnt信号通路成员β-catenin表达的影响。
一、材料和方法
1.细胞增殖测定:人胰腺癌细胞PANC1购于中国科学院典型培养物委员会细胞库(上海),常规培养、传代。取对数生长期细胞接种于96孔板,应用0.25、0.5、1.0、1.5、2.0 mmol/L的舒林酸(美国Enzo公司)分别处理PANC1细胞24、48、72 h,以不加舒林酸的细胞作为对照组。应用MTT法检测细胞的增殖,按MTT试剂盒(江苏碧云天生物科技有限公司)说明书操作。最后上酶标仪测各孔在波长490 nm处的吸光度值(A490值)。生长抑制率=实验组A490值/对照组A490值×100%。
2.细胞凋亡测定:取不同浓度舒林酸处理48 h的PANC1细胞,常规消化制备细胞悬液,按照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书操作。染色完成后1 h内上流式细胞仪检测。
3.β-catenin mRNA表达检测:利用Primer Express1.5软件设计β-catenin引物,序列为5′-GTGCTATCTGTCTGCTCTAGTA-3′及5′-CTTCCTGTTTAGTTGCAGCATC-3′;内参GAPDH引物序列为5′-GAAGGTGAAGGTCGGAAGT-3′及5′-GGAAGATGGTGATGGGATT-3′。 引物由上海生工合成。取不同浓度舒林酸处理24 h的PANC1细胞以及2 mmol/L舒林酸处理12、24、48、72 h的PANC1细胞,采用Trizol(美国Invitrogen公司)提取细胞总RNA,采用RT-PCR法检测β-catenin mRNA表达。先逆转录成cDNA。PCR条件:94℃ 5 min,94℃ 45 s、58℃ 30 s、72℃ 45 s,35个循环,最后72℃ 10 min。PCR产物在1%琼脂糖凝胶电泳分离后扫描,以目的条带与内参条带灰度比值表示mRNA表达量。
4.β-catenin蛋白表达检测:取不同浓度舒林酸处理24、48 h的PANC1细胞,制作细胞爬片,采用免疫组化SP法检测β-catenin蛋白。兔抗人β-catenin多抗购自Santa Cruz公司,生物素化羊抗兔IgG购自武汉天兴生物科技有限公司,免疫组化试剂盒及DAB显色试剂盒购自武汉天兴生物科技有限公司。在400倍显微镜下阅片,按“米”字形随机选择5个视野,计算每个视野内胞质和胞核呈棕黄色的阳性肿瘤细胞,根据阳性细胞占总细胞数的百分数及染色强度进行半定量。无阳性细胞计0分,阳性细胞1%~30%计1分,31%~70%计2分,71%~100%计3分;根据着色强度依次计0、1、2、3分,两分相加,0分为阴性(-),1~2分为弱阳性(+),3~4分为阳性(++),5~6分为强阳性(+++)[7]。

二、结果
1.舒林酸对PANC1细胞增殖的影响:应用0.5、1.0、1.5、2.0 mmol/L舒林酸处理后,PANC1细胞生长均受到不同程度抑制,与阴性对照组相比,差异均具有统计学意义(F值分别为80.755、91.701、134.087,P值均<0.05),但1.5和2.0 mmol/L舒林酸处理48、72 h时的抑制率差异无统计学意义(P值分别为0.348、0.843),其余各组间差异有统计学意义(P值均<0.05,表1、图1)。

表1 舒林酸作用PANC1细胞后A490均值及抑制率
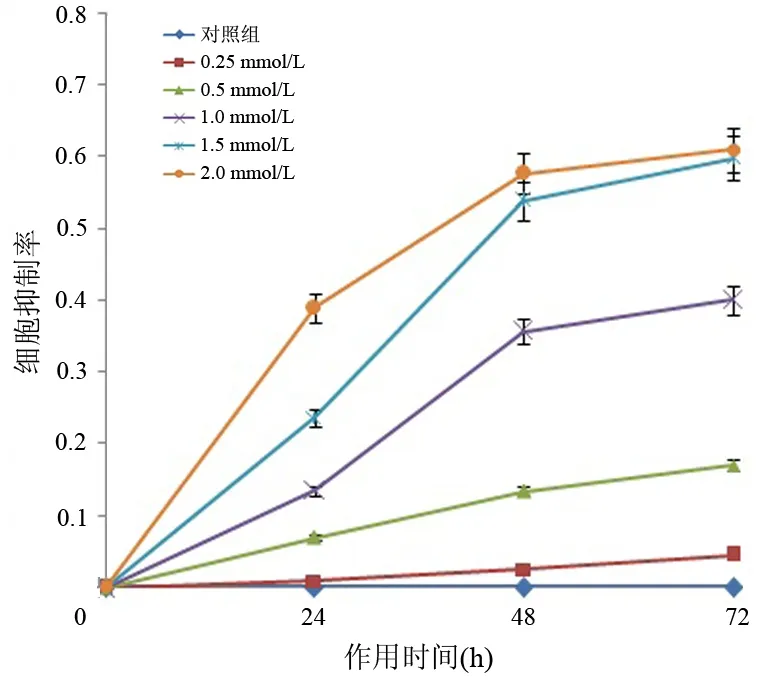
图1 不同浓度舒林酸处理后PANC1细胞的生长曲线
2.舒林酸对PANC1细胞凋亡的影响:应用0.5、1.0、1.5、2.0 mmol/L舒林酸处理PANC1细胞48 h后,细胞早期凋亡率分别为(6.6±0.7)%、(9.3±1.4)%、(23.7±1.2)%、(29.4±0.9)%,随舒林酸浓度增加,凋亡率亦随之增加,其中0.5、1.0 mmol/L处理组与对照组的(6.5±0.3)%相比,差异无统计学意义(P值分别为0.792、0.288),1.5、2.0 mmol/L组与对照组相比,差异有统计学意义(F值分别为189.432、164.400,P值均<0.05,图2)。
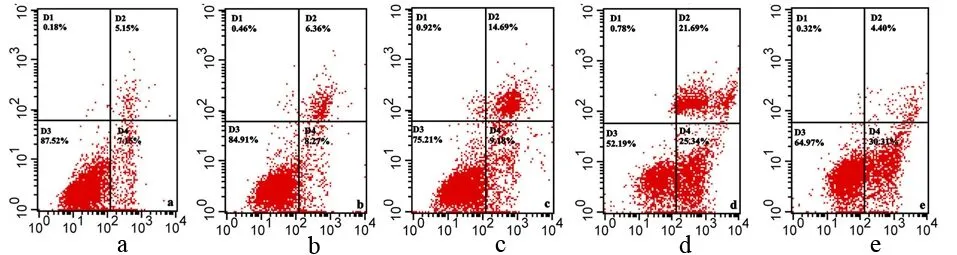
图2 对照组(a)及0.5、1.0、1.5、2.0 mmol/L舒林酸(b、c、d、e)处理48 h后PANC1细胞的凋亡
3.舒林酸对细胞β-catenin mRNA及蛋白表达的影响:PANC1细胞β-catenin mRNA表达量随着舒林酸浓度的增加而下调,对照组及0.5、1.0、1.5、2.0 mmol/L组的β-catenin mRNA表达量分别为1.00±0.03、0.96±0.03、0.92±0.04、0.52±0.09、0.35±0.09,0.5、1.0 mmol/L组与对照组的差异无统计学意义(P值分别为0.322、0.074),而1.5、2.0 mmol/L组与对照组的差异具有统计学意义(P值均<0.05)。2.0 mmol/L舒林酸处理PANC1细胞12、24、48、72 h,细胞β-catenin mRNA表达量分别为0.44±0.02、0.30±0.05、0.16±0.01、0.16±0.04,随着处理时间延长而逐渐降低,均较对照组的0.60±0.02下调,差异有统计学意义(F=192.408,P<0.05,图3)。
细胞的β-catenin蛋白表达亦随着舒林酸浓度的增加逐渐降低,其中0.25、0.5 mmol/L处理组与对照组间的差异无统计学意义(P值分别为0.472、0.586),而1.0、1.5、2.0 mmol/L处理组与对照组间的差异均有统计学意义(P值均<0.05,表2,图4)。
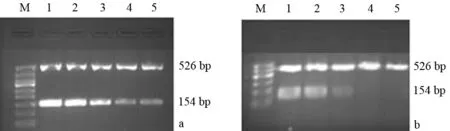
图3 0、0.5、1.0、1.5、2.0 mmol/L舒林酸(1、2、3、4、5)处理24 h后(a)及2.0 mmol/L舒林酸处理0、12、24、48、72 h(1、2、3、4、5)后(b)细胞β-Catenin mRNA的表达
表2 不同浓度舒林酸对人胰腺癌PANC1细胞β-catenin表达影响
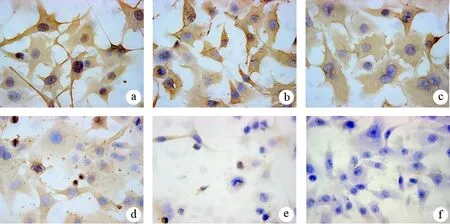
图4 对照组(a)及0.25、0.5、1.0、1.5、2.0 mmol/L舒林酸(b~f)处理24 h后细胞β-catenin蛋白的表达(免疫组化 ×400)
讨论NSAIDs是常用的解热镇痛消炎药物,近年来研究证明NSAIDs还能对肿瘤有化学预防的作用,尤其是在结、直肠癌预防方面。Peter等对17 285名需要口服阿司匹林预防心血管疾病的患者平均随访6.5年,结果发现阿司匹林能降低肿瘤的远处转移,尤其是结直肠腺瘤的远处转移[8]。Stein等[9]应用舒林酸处理不同结肠癌细胞系,结果能降低细胞β-catenin的表达及核聚集,在动物体内实验中舒林酸能降低肿瘤的转移,其机制与β-catenin及其下游转录激活基因S100A4表达减少有关。他们认为舒林酸通过调节β-catenin信号通路具有抗肿瘤细胞转移的潜质。
本研究结果显示,舒林酸呈浓度依赖及时间性抑制PANC1细胞的增殖,诱导细胞的凋亡。但在药物处理48 h后的细胞增殖抑制效果不如48 h前明显,可能与药物消耗及细胞内β-catenin表达下降相关。RT-PCR及免疫细胞化学结果显示,经舒林酸处理后PANC1细胞的β-catenin mRNA及蛋白表达均明显下调,在1.5及2.0 mmol/L舒林酸处理后细胞基本不表达β-catenin蛋白,与舒林酸对肝癌细胞及结肠癌细胞的影响相似。
[1] White BD, Chien AJ, Dawson DW. Dysregulation of Wnt/β-catenin signaling in gastrointestinal cancers[J]. Gastroenterology, 2012, 142(2): 219-232.
[2] Vermeulen L, De Sousa E Melo F, Van der Heijden M, et al. Wnt activity defines colon cancer stem cells and is regulated by the microenvironment[J]. Nat Cell Biol, 2010, 12(5): 468-476.
[3] Hoshida Y, Nijman SM, Kobayashi M, et al. Integrative transcriptome analysis reveals common molecular subclasses of human hepatocellular carcinoma[J]. Cancer Res, 2009, 69(18): 7385-7392.
[4] MacDonald BT,Tamai K,He X.Wnt/beta-catenin signaling:components,mechanisms,and diseases[J].Dev Cell,2009,17(1):9-26.
[5] 满晓华, 王伟, 郑建明, 等. β-连环蛋白在不同胰腺病变中的表达[J]. 中华胰腺病杂志, 2012, 12(1): 26-29.
[6] Din FV, Theodoratou E, Farrington SM, et al. Effect of aspirin and NSAIDs on risk and survival from colorectal cancer[J]. Gut, 2010, 59(12): 1670-1679.
[7] Kirikoshi H, Katoh M. Expression of WNT7A in human normal tissues and cancer, and regulation of WNT7A and WNT7B in human cancer[J]. Int J Oncol, 2002, 21(4): 895-900.
[8] Rothwell PM, Wilson M, Price JF, et al. Effect of daily aspirin on risk of cancer metastasis: a study of incident cancers during randomised controlled trials[J]. Lancet, 2012, 379(9826): 1591-1601.
[9] Stein U, Arlt F, Smith J, et al. Intervening in β-catenin signaling by sulindac inhibits S100A4-dependent colon cancer metastasis[J]. Neoplasia, 2011, 13(2): 131-144.

