高脂血症性胰腺炎20年发病率和临床特征的分析
黄耀星 贾林 聂玉强 江舒曼 欧娅
严重高三酰甘油血症(hypertriglyceridemia, HTG)与急性胰腺炎(AP)的发生、发展和预后密切相关,成为继胆道疾病和酗酒以外AP的常见病因,称为高三酰甘油血症性AP(hypertriglyceridemia acute pancreatitis, HLAP),临床上仍多称为高脂血症性胰腺炎。随着近20年来中国经济的快速发展,国人生活方式和膳食呈明显的西方化趋势,HTG发病率10年间提高了3倍[1],有关HLAP的临床报道也明显增多,但对HLAP的年度发病率变化的研究尚未见报道。本研究回顾性分析广州市第一人民医院近20年HLAP患者的临床资料,旨在进一步阐明HLAP的发病趋势、临床特征及其预后的变化,以提高临床医师对HLAP的诊疗水平。
对象和方法
一、研究对象
选取广州医科大学附属广州市第一人民医院1991年至2010年间资料相对完整,并在入院时检测了血脂项目的AP患者纳入研究。采用中华医学会消化病学分会胰腺疾病学组等单位制定的《中国急性胰腺炎诊治指南》[2]对AP进行定义和分型。具有AP的临床表现,通过影像学(腹部B超、上腹部CT或MRI、ERCP)检查发现胆囊和(或)胆管结石,或影像学检查未发现胆囊或胆管结石,但血清ALT≥75 U/L、ALP>125 U/L、总胆红素>39.3 μmmol/L中有两项达标并排除肝脏疾患者可诊断为胆源性AP。具有AP的临床表现,入院时(治疗前)的血TG≥11.3 mmol/L,或TG在5.6~11.3 mmol/L并伴血清脂浊,排除胆道疾患、酗酒、药物、肿瘤、外伤等病因者可诊断为HLAP。如同时存在HTG的继发因素或其他家族性脂蛋白异常则有助于HLAP 的诊断。患者体温>38℃或<36℃,心率>90次/min,呼吸>20次/min或PaCO2<32 mmHg(1 mmHg=0.133 kPa),白细胞计数>12×109/L或<4×109/L或未成熟粒细胞>10%的4项指标中至少2项达标可诊断为全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)。
二、方法
详细记录患者的临床资料,包括年龄、性别、发病诱因、生活习惯和既往疾病史、临床表现、实验室指标、Ranson评分和CT严重指数(CT severity index,CTSI)、重度急性胰腺炎(SAP)发生率、病死率和住院时间。根据不同年代,将AP患者分为4个年度段(1991年至1995年,1996年至2000年,2001年至2005年,2006年至2010年),比较不同年度段间HLAP占AP的构成比、临床特征及其预后。
三、统计学处理
结 果
一、病例资料
1991年至2010年广州医科大学附属广州市第一人民医院共收治AP住院患者 1 752例,其中入院24 h内行血脂检测者 1 362例,男性691例,女性671例,男女比例1.02∶1,平均年龄(57±18)岁(11~98岁)。其中胆源性AP患者共788例,男性346例,女性442例,男女比例0.78∶1,平均年龄(61±16)岁(13~98岁);HLAP患者共99例,男性61例,女性38例,男女比例1.61∶1,平均年龄(44±12)岁(26~85岁)。
二、构成比的变化
HLAP占AP总构成比的7.3%,4个年度段的构成比分别为5.4%、5.7%、6.7%和8.3%,HLAP第4年度的构成比为第1年度的1.5倍。与此同时,胆源性AP总构成比为57.9%,4个年度段构成比分别为58.1%、60.4%、60.6%和55.4%,差异无统计学意义(χ2=3.56,P>0.05)。
进一步细分年龄和性别,HLAP的平均发病年龄低于胆源性AP患者,82%的HLAP患者发病年龄在30~59岁,60岁以上患者仅占9%;20年间HLAP发病年龄未显示出时间改变的趋势(F=0.13,P>0.05)。与胆源性AP患者女性占多数不同,HLAP患者以男性为主,40岁以下患者中,男性(74%)患者比例更显著高于女性(26%),而在40岁以上患者中,男女比例相仿。
三、临床特征
HLAP中SAP发生率为20.2%(20/99),显著高于胆源性AP的8.5%(67/788)(χ2=13.6,P<0.05)。99例HLAP患者的血淀粉酶活性平均为(513.3±462.7)mmol/L,TG为(12.7±7.0)mmol/L,Ranson评分为(1.2±1.1)分,CTSI为(2.2±1.1)分,SIRS发生率为36.4%(36/99),脏器功能衰竭发生率为18.2%(18/99),胰腺假性囊肿发生率为5.1%(5/99)。尽管20年来HLAP的临床表现和严重程度改变差异无统计学意义,但HLAP患者的TG均值、Ranson和CTSI分值、SAP和脏器功能衰竭的发生率仍随年代变化逐渐升高(表1)。
四、治疗和预后
HLAP的总体病死率为6.1%(6/99),显著高于胆源性AP的2.8%(22/788,χ2=307,P<0.05);1991年至1995年段无HLAP患者死亡,此后3个年度段HLAP病死率分别为7.7%、7.7%和5.4%,病死率随年代变化有下降,但改变未显示出统计学意义。20年来,应用血液净化技术(血浆置换或血液滤过)清除HLAP患者的HTG也在增多,从第1个10年未予使用,发展至近10年间使用率从3.8%上升至10.7%。与此同时,HLAP的住院时间也从第1年度段的26 d逐渐下降至第4年度段的14 d,住院时间显著缩短(χ2=8.95,P<0.05,表1)。
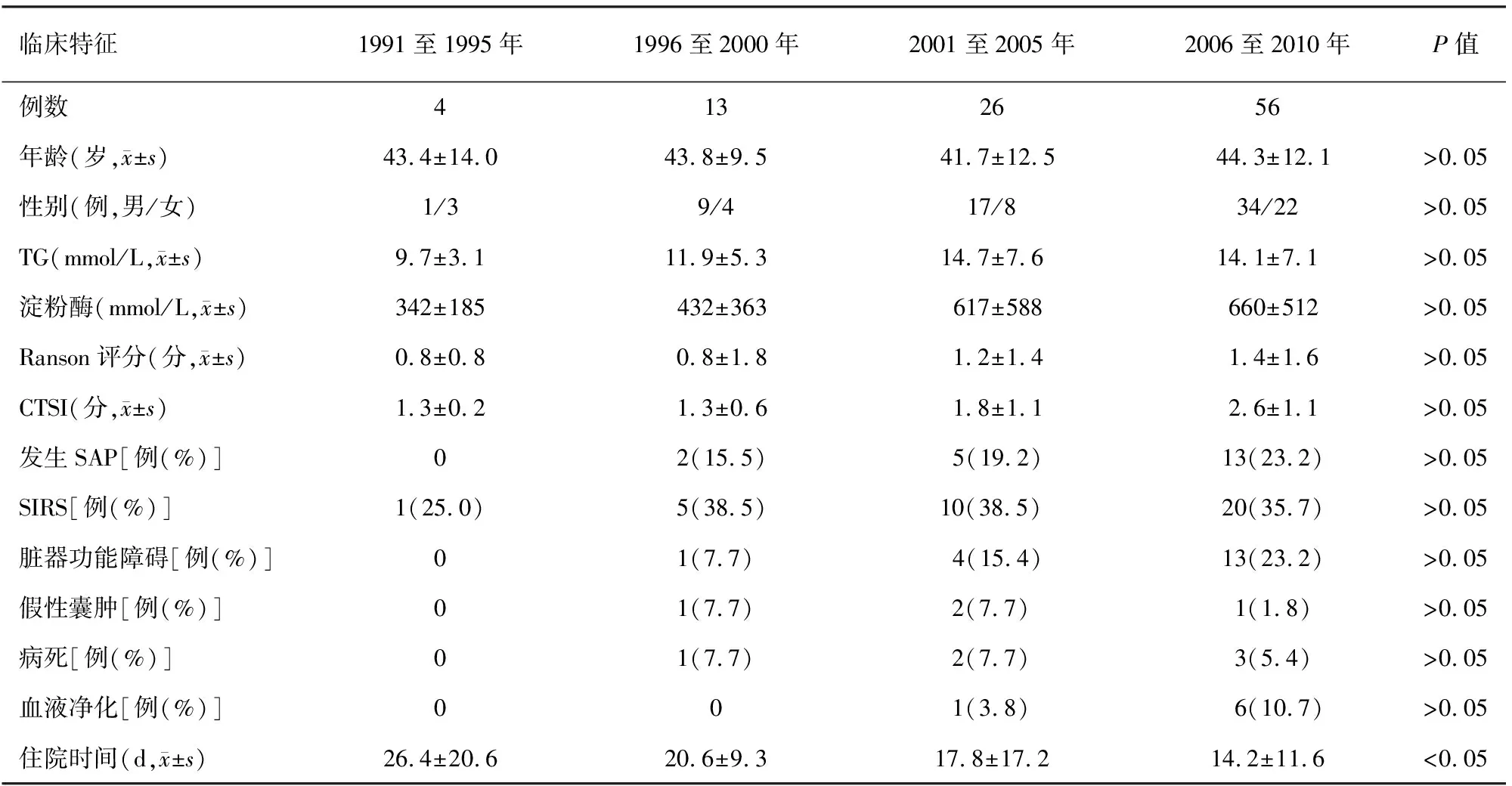
表1 1991年至2010年间 HLAP患者的临床特征变化
讨 论
自1952年国外学者首次报道原发性高脂血症可致AP反复发作以来,HTG与AP关系越来越受到临床重视。目前认为,AP可引起TG轻度升高,当TG严重升高超过11.3 mmol/L,或在5.6~11.3 mmol/L之间并伴血清脂浊,可认为HTG是AP的直接病因。HLAP的人群发病率尚不清楚,统计学多使用HTG占AP病因的构成比对其发生率进行描述。西方国家如美国、欧洲等报道HLAP占AP构成比为1.3%~7.0%,国内多中心流行病学调查报道HLAP发生率为12.6%[3-5]。此前广东省多中心的AP流行病学调查结果的HALP构成比为7.8%[6]。本研究结果为7.3%,与广东省多中心研究结果相仿,略低于全国数据,考虑与不同地域和饮食等诸多因素影响有关。
欧美的调查显示,AP发病率在过去数十年间增长明显,其中又以胆源性AP增长为主,但未见有HLAP的相关报道[7]。日本在1970年仅有4例HLAP报道,随后逐步增多至1980年的12例,1990年的17例,作者认为这与日本生活方式逐步西化有密切关联[8]。本研究数据与日本研究相似,HLAP数量从第1年度段的4例逐步上升到第4年度段的56例,20年来HLAP患者数量增长迅速。同样,HTG占总体AP病因构成比亦呈上升趋势,第4年度段HLAP构成比是第1年度段的1.5倍。这可能与我国近20年来经济飞速发展,生活和饮食方式西化改变明显有关。王淼等[1]报道,北京地区青年人HTG的发生率从1992年的13.3%升至2002年的30.2%[1]。另一方面,随着国内外各种AP指南的发布,临床也重视了对AP患者的血脂检测,减少HTG漏诊,提高了HLAP的检出率。
Sekimoto等[9]认为,HLAP患者平均年龄低于其他病因的AP患者。一项日本研究报道了33例高脂血症相关胰腺炎,大多数患者发病年龄在20~30岁,女性的发病率高于男性,考虑与妊娠因素相关。对HLAP行队列研究的结果显示,80%的HLAP患者为男性,平均年龄为37.5岁[9-10]。本研究的HLAP患者平均年龄显著低于胆源性AP患者,大多数患者的发病年龄集中在30~59岁,且发病年龄并未随时间推移发生改变,男性患者多于女性,40岁以下患者中更有74%是男性,男性患者数增长速度高于女性,这与国外大样本队列研究结果相似。
HTG在AP发生、发展中的作用机制仍未阐明,目前认为游离脂肪酸起重要作用,TG水平与胰腺损伤程度呈正相关,甚至可引发胰外脏器损伤,并已在动物实验中得到证实。然而临床上对HTG与AP严重程度间的关系尚存争论。有学者认为HLAP临床特征与其他病因的AP相似。但近年多个研究则报道,与非高脂AP相比,HLAP患者的并发症多,病死率高,住院时间长[4,11]。国内一项SAP回顾性调查中HTG甚至占SAP病因的38.5%[12]。本研究显示,HLAP患者SAP比例亦显著高于胆源性AP,提示HLAP有更为明显的重症化倾向。尽管近年AP治疗手段不断进步,但HLAP临床特征并无太大改变,TG均值、Ranson和CTSI评分、SAP和脏器功能障碍的发生率甚至出现逐渐增加的势头。HLAP的总体病死率仍显著高于胆源性AP,虽然已开始随年度改变逐渐下降,但仍未显示出统计学意义,仍值得临床医师重视。
早期快速降低HTG水平一直是避免HLAP病情恶化和预防复发的有效治疗手段。由于传统禁食、去除诱因和降脂药物等手段降脂起效速度较慢,而血液净化可迅速清除血中TG和炎症递质,故近10年国人应用血浆置换或血液滤过治疗HALP的比例不断增加,10年间使用率增加近3倍。有研究表明[13]血液净化可缩短住院时间、改善预后。本研究中HLAP患者的住院时间在20年间显著缩短,证实血液净化可作为降低血脂和治疗HLAP的有效方法。当然,血液净化疗法的治疗时机和净化材料选择等问题还需要今后临床进一步深入研究。
[1] 王淼,王薇,赵冬,等.北京地区青年人群心血管病危险因素10年变化趋势[J].心肺血管病杂志,2005,24(2):65-67,70.
[2] 中华医学会消化病学分会胰腺疾病学组,《中华胰腺病杂志》编辑委员会,《中华消化杂志》编辑委员会.中国急性胰腺炎诊治指南(2013,上海)[J].中华胰腺病杂志,2013,13(2):73-78.
[3] Fortson MR, Freedman SN, Webster PD 3rd, et al. Clinical assessment of hyperlipidemic pancreatitis[J]. Am J Gastroenterol, 1995,90(12):2134-2139.
[4] Athyros V, Gioulene OI, Nikolaidis NL, et al. Long-term follow-up of patients with acute hypertriglyceridemia-induced pancreatitis[J]. J Clin Gastroenterol, 2002,34(4):472-475.
[5] 急性胰腺炎协作组.中国6223例急性胰腺炎病因及病死率分析[J].胰腺病学, 2006,6(6):321-325.
[6] 贾林,黄耀星,杨琪玫,等.广东地区高脂血症性胰腺炎的临床特征分析[J]. 现代消化及介入诊疗,2007,12(3):145-147.
[7] Lowenfels AB, Maisonneuve P, Sullivan T. The changing character of acute pancreatitis: epidemiology, etiology, and prognosis[J]. Curr Gastroenterol Rep, 2009,11(2):97-103.
[8] Ohmoto K, Neishi Y, Miyake I, et al. Severe acute pancreatitis associated with hyperlipidemia: report of two cases and review of the literature in Japan[J]. Hepatogastroenterology, 1999,46(29):2986-2990.
[9] Sekimoto M, Takada T, Kawarada Y, et al. JPN Guidelines for the management of acute pancreatitis: epidemiology, etiology, natural history, and outcome predictors in acute pancreatitis[J]. J Hepatobiliary Pancreat Surg, 2006,13(1):10-24.
[10] Lloret Linares C, Pelletier AL, Czernichow S, et al. Acute pancreatitis in a cohort of 129 patients referred for severe hypertriglyceridemia[J]. Pancreas, 2008,37(1):13-18.
[11] 李维勤,童智慧,全竹富,等.1033例重症急性胰腺炎治疗经验总结[J]. 中华外科杂志,2009,47(19):1472-1474.
[12] Anderson F, Thomson SR, Clarke DL, et al. Dyslipidaemic pancreatitis clinical assessment and analysis of disease severity and outcomes[J]. Pancreatology, 2009,9(3):252-257.
[13] Kyriakidis AV, Karydakis P, Neofytou N, et al.Plasmapheresis in the management of acute severe hyperlipidemic pancreatitis: report of 5 cases[J].Pancreatology, 2005,5(2-3):201-204.

