单壁碳纳米管固相萃取-气相色谱-质谱联用法测定茶油中6种邻苯二甲酸酯
张 帆, 李忠海, 张 莹, 黄志强*, 王小淞
(1.中南林业科技大学食品科学与工程学院,湖南 长沙410004;2.湖南省检验检疫科学技术研究院,湖南 长沙410004;3.长沙环境保护职业技术学院,湖南 长沙410004;4.岛津企业管理(中国)有限公司,广东 广州510010)
茶油是我国特有的木本油脂,其凭借超高的不饱和脂肪酸含量以及丰富的维生素、角鲨烯、茶多酚等多种活性成分,可以起到预防心血管疾病和延缓衰老的营养和保健作用[1,2]。另外茶油自身固有的清香气味,烹调过程中产生的氧化产物也比较少,越来越受到消费者的青睐[3]。
邻苯二甲酸酯(phthalate esters,PAEs)是一类广泛应用于塑料包装材料和塑料制品中以增大塑料的可塑性和韧性的重要有机化合物[4]。邻苯二甲酸酯在塑料中属于游离状态,随着周围环境温度变化和储存的食品极性等的影响极易从塑料迁移到食品中[5]。目前,国内市场上售卖的茶油基本上使用塑料容器包装,茶油在与含有PAEs的塑料包装长时间接触后,很容易受到塑料包装中迁移的PAEs污染,污染程度随着接触时间的延长而增加[6,7]。研究表明,具有雌激素特性的PAEs属于脂溶性物质,一旦进入人体后便不断在人体脂肪中富集,极不易排泄出去,从而影响人体正常的内分泌功能,严重时会导致畸形、癌变和突变[8-10]。
目前有关食用油中邻苯二甲酸酯的检测方法主要气相色谱法[11]、液相色谱法[12]、气相色谱-质谱联用法(GC-MS)[13-15]、液相色谱-质谱联用法[16]等,由于茶油基质比较复杂,干扰物质比较多,现有的这些检测方法大都采用凝胶渗透色谱、商品化固相萃取小柱等净化,消耗了大量的有机试剂或较为昂贵的前处理耗材。Lijima[17]于1991年发现的碳纳米管(carbon nanotubes,CNTs)是继1985年Kroto和Smalley等[18]发现C60以来碳化学领域的又一个重大发现。碳纳米管因具有独特的理化性能,对重金属和有机化合物表现出极强的吸附能力,在样品前处理应用中成为科学研究的热点[19-21]。CNTs存在两种结构形式:单壁碳纳米管(single-walled carbon nanotubes,SWCNTs)和多壁碳纳米管(multiwalled carbon nanotubes,MWCNTs)[22]。SWCNTs的直径通常为0.6~2 nm,相对 MWCNTs而言,其直径分布的范围更窄,缺陷更少,从而具有更高的均匀一致性[23]。本研究利用单壁碳纳米管的强吸附性,自制单壁碳纳米管玻璃固相萃取小柱对茶油中邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸丁基苄基酯(BBP)、邻苯二甲酸二(2-乙基)己酯(DEHP)、邻苯二甲酸二正辛酯(DNOP)等6种已经被美国国家环保署(EPA)列为优先控制污染物的典型PAEs进行富集净化[12],结合 GC-MS测定,建立了一种简便、廉价、准确、环保的茶油中6种PAEs的分析检测方法。
1 实验部分
1.1 仪器、试剂与材料
GCMS-QP2010 Plus气相色谱-质谱联用仪,配有电子轰击离子源(日本岛津公司);SA300振荡器(日本 YAMATO公司);XS20电子天平(瑞士METTLER TOLEDO公司);CNW固相萃取装置(上海安谱科学仪器有限公司);MTN-2800D氮吹仪(上海笛柏实验设备有限公司)。
DMP、DEP、DBP、BBP、DEHP、DNOP标准品购自德国Dr.Ehrenstorfer公司,纯度均大于97%。丙酮、正己烷、甲苯(色谱纯,美国TEDIA公司),甲醇、二氯甲烷(色谱纯,美国MERCK公司),有机溶剂均重蒸馏,经检测不含上述增塑剂,实验用水均为超纯水。6 mL玻璃固相萃取空柱管(上海安谱科学仪器有限公司);单壁碳纳米管:外径1~2 nm,长度0.5~2μm,纯度大于90%,-COOH含量为2.73%,比表面积大于380 m2/g(中国科学院成都有机化学有限公司);N-丙基乙二胺(PSA)、C18玻璃固相萃取小柱(1.0 g/6 mL,美国 DIKMA公司)。茶油样品购于湖南某大型超市。
1.2 标准工作液的配制
准确称取6种邻苯二甲酸酯标准品各10 mg(精确到0.000 1 g),分别置于10 mL容量瓶中,加少量丙酮溶解后定容至刻度线,配制成1.0 g/L的单标储备液,于4℃冰箱中保存。使用前根据检测需要移取一定体积的各单标储备液混合后,用甲苯逐级稀释成适当浓度的混合标准工作液,标准工作液需现用现配。
1.3 实验方法
1.3.1 SWCNTs SPE柱的制备
准确称取0.6 g SWCNTs于6 mL空玻璃SPE柱管中,SPE小柱中填料用配套的6 mL小柱筛板上下固定,压紧SWCNTs,使填装柱高度保持在1.5 cm左右。
1.3.2 样品前处理
准确称取1.00 g茶油样品于玻璃螺纹管中,用5 mL正己烷溶解稀释后于振荡器上振荡混匀1 min,待净化。先后用5 mL丙酮溶液、5 mL正己烷溶液活化SWCNTs固相萃取小柱,然后将稀释的样品溶液加入到活化后的SWCNTs SPE小柱上,控制流速约为1 mL/min,不收集流出液。为了除去茶油中的油脂,加入20 mL正己烷淋洗,弃去淋洗液,增塑剂吸附在纳米管上,达到净化的目的。最后用5 mL甲苯溶液洗脱,收集全部洗脱溶液,于氮吹仪上40℃浓缩至1 mL,供GC-MS分析。
1.4 仪器使用条件
1.4.1 色谱条件
色谱柱:HP-5MS石英毛细管柱(30 m×0.25 mm,0.25μm);载气:氦气(纯度大于99.999%),流速为1 mL/min,恒流;进样口温度:280℃,不分流进样,进样量为1μL;升温程序:初始温度为100℃,保持1 min,以15℃/min升至300℃,保持5 min。
1.4.2 质谱条件
离子源:电子轰击离子源(EI);电子能量:70 eV;溶剂切除时间:4 min;离子源温度:250℃;接口温度:280℃。采用选择离子监测(SIM)模式进行数据的采集。6种PAEs的保留时间、定量离子、定性离子见表1。

表1 6种PAEs的保留时间、定量离子和定性离子Table 1 Retention times,quantitative ions and qualitative ions of the six phthalate acid esters(PAEs)
2 结果与讨论
2.1 前处理条件的优化
2.1.1 正己烷稀释体积的优化
茶油样品比较黏稠,不能直接过固相萃取小柱进行净化,需要用正己烷进行溶解稀释。稀释比例过小(即油脂过浓)时,黏度大,流速过慢;比例过大(即油脂过稀)时,溶剂用量大,也浪费时间。经过实验比较,正己烷的稀释体积对实验结果影响不大,综合考虑过柱时间和溶剂用量,最终选定正己烷稀释体积为5 mL。
2.1.2 吸附材料的选择
由于碳纳米管存在两种结构形式,实验比较了单壁碳纳米管和多壁碳纳米管两种吸附材料对茶油中6种PAEs的吸附效果,经检测发现单壁碳纳米管更容易吸附油脂中的PAEs;且单壁碳纳米管比多壁碳纳米管更具均匀一致性,使得所填充的固相萃取小柱填料更均匀,里面空洞更少。另外分别添加0.1 mL10 mg/L混合标准溶液到3份空白茶油样品中,按照1.3.2节所述步骤进行样品前处理,比较了经单壁碳纳米管玻璃固相萃取小柱、PSA玻璃固相萃取小柱和C18玻璃固相萃取小柱净化后洗脱液中的PAEs含量,并计算回收率。SWCNTs SPE对选取的6种PAEs的回收率范围为86.7%~114.6%,PSA SPE为77.9%~120.1%,C18SPE为74.5%~104.8%,实验结果表明自制SWCNTs SPE对茶油中PAEs的富集和净化效果不亚于商业的固相萃取小柱,且对茶油本身的色素吸附性更强,进一步降低了干扰。
2.1.3 SWCNTs用量的优化
实验中发现制备的SWCNTs SPE柱中单壁碳纳米管的填充质量对实验结果有一定的影响,SWCNTs用量过少不能将所有目标物完全吸附,过多则会影响上样速率和洗脱效率。实验考察了单壁碳纳米管用量分别为0.2、0.4、0.6、0.8、1.0 g的SWCNTs SPE玻璃小柱,称取了5份空白茶油样品各1.00 g并添加0.1 mL 10 mg/L的混合标准溶液,按照1.3.2节所述步骤进行样品前处理,检测洗脱液中增塑剂的含量,计算回收率。由图1可知,DMP、BBP吸附性较强,需要较少的吸附剂,吸附剂用量大时难以洗脱下来,因此回收率反而降低;DBP、DEHP、DNOP吸附性相对较弱,需要较多的吸附剂。当吸附剂用量为0.6 g时,所有增塑剂回收率均较好。

图1 SWCNTs用量对6种PAEs回收率的影响Fig.1 Effect of SWCNTs dosage on the recoveries of the six PAEs
2.1.4 淋洗溶剂用量的优化
因为正己烷具有很好的溶解脂肪的能力,为了进一步降低样品中脂肪杂质对分析结果的干扰,上样后,每次用5 mL正己烷清洗,并收集淋洗流出液,经检测发现流出液中均不含增塑剂,淋洗液经N2吹干后,发现含油量越来越少,上样后的SPE小柱经20 mL正己烷淋洗之后收集的淋洗液中看不出有油脂存在。所以实验最终确定固相萃取柱的淋洗液体积为20 mL。
2.1.5 洗脱溶剂类型及洗脱溶剂体积的选择
洗脱溶剂对目标物的洗脱效果也是影响回收率的一个重要因素。将0.1 mL10 mg/L标准溶液直接上样到活化的SWCNTs SPE柱上,实验选取5 mL不同的溶剂(丙酮、甲醇、二氯甲烷、甲苯)进行洗脱,计算洗脱液中增塑剂的回收率。从图2中可以发现,甲苯对6种PAEs的洗脱效果最佳,尤其是对BBP,而其他3种溶剂对BBP的洗脱能力很弱。洗脱溶剂的体积也对目标物能否完全从吸附剂上洗脱下来有着至关重要的影响。实验比较了2~7 mL甲苯溶液对上样0.1 mL10 mg/L混合标准溶液的SWCNTs SPE柱的洗脱效果,由图3可知,随着甲苯体积的增加,PAEs的回收率也逐渐增加;当甲苯的用量大于5 mL时,回收率增长缓慢;继续增加甲苯用量,PAEs的回收率变化不明显;另外甲苯沸点较高,浓缩速度稍慢,综合考虑洗脱溶剂体积和回收率两个因素,实验最终选择5 mL甲苯溶液来洗脱固相萃取小柱。
2.2 PAEs测定条件的优化

图2 洗脱溶剂类型对6种PAEs回收率的影响Fig.2 Effect of elution solvent types on recoveries of the six PAEs

图3 洗脱溶剂体积对6种PAEs回收率的影响Fig.3 Effect of elution volume on recoveries of the six PAEs
邻苯二甲酸酯是一类含有苯环的弱极性化合物,为了使6种邻苯二甲酸酯得到有效的基线分离,对色谱柱、程序升温、进样口温度、进样方式等条件进行了优化。如图4所示,在选定的色谱条件下,6种PAEs在非极性的HP-5MS石英毛细管柱上能够有效分离,并获得满意的响应。在选定了合适的色谱分离条件后,为了进一步提高灵敏度和降低基质对目标物分析的干扰,选取干扰较小、响应较好的碎片离子作为定量离子和定性离子,采用SIM模式进行测定。
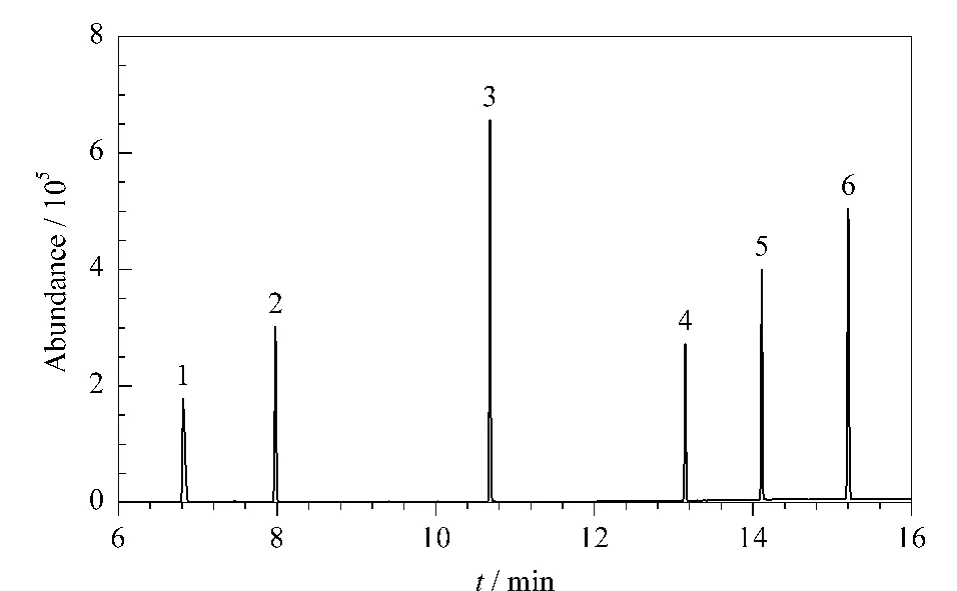
图4 6种邻苯二甲酸酯的选择离子监测色谱图(1 mg/L)Fig.4 SIM chromatogram of the six PAEs(1 mg/L)
2.3 方法的线性范围和定量限
将6种PAEs的混合标准储备液用甲苯稀释得到质量浓度分别为0.05、0.1、0.2、0.5、1.0 mg/L的标准工作溶液,在优化的仪器条件下测定。以标准品的质量浓度为横坐标,相应浓度对应的峰面积为纵坐标进行线性回归,建立标准曲线。6种PAEs的定量限(LOQ)以空白样品中添加一定浓度的标准溶液按10倍信噪比(S/N)确定。各被测组分的线性方程、相关系数及定量限见表2。结果表明,6种PAEs在0.05~1.0 mg/L范围内,相关系数(r)均大于0.999 9,线性关系良好。本方法的所有目标组分的定量限约0.01~0.03 mg/kg,显著低于国际限量要求。当样品中6种邻苯二甲酸酯被检出且其浓度超过此线性范围时,需要适当稀释至此线性范围内。

表2 6种PAEs的线性范围、回归方程、相关系数和定量限Table 2 Linear ranges,linear equations,correlation coefficients(r)and limits of quantitation(LOQs)of the six PAEs
2.4 加标回收率和精密度
为了验证方法的准确度,在经检测不含有上述6种PAEs的茶油样品中加入一定量的PAEs的混合标准溶液,使样品中6种PAEs的添加水平为0.05、0.20、1.0 mg/kg,每个添加水平取6个平行样,按照前述最终优化的方法和仪器条件进行检测,回收率范围和相对标准偏差(RSD)如表3所示。在3个添加水平下6种PAEs的回收率为86.4%~111.7%,RSD为4.2%~10.4%,表明本方法的准确度和精密度满足痕量分析要求。图5为空白茶油样品和添加6种PAEs的茶油样品的选择离子色谱图。

表3 茶油中6种PAEs的加标回收率和方法的精密度(n=6)Table 3 Recoveries and precisions of the six PAEs spiked in camellia oil(n=6)

图5 空白样品和加标样品经SWCNTs SPE净化后6种PAEs的SIM色谱图Fig.5 SIM chromatograms of the six PAEs in blank and spiked samples after SWCNTs SPE clean up
2.5 实际样品的测定
采用所建立的方法检测了市售多个品牌和不同批次的30个茶油样品,有4个样品检出DBP和DEHP,其中一个阳性样品中DBP检出量为1.04 mg/kg,DEHP检出量为1.89 mg/kg,超过了 GB 9685-2008《食品容器、包装材料用添加剂使用卫生标准》中规定的DBP和DEHP所允许的在食品中的特定迁移量限值0.3 mg/kg和1.5 mg/kg。
3 结论
本文成功地将SWCNTs作为玻璃SPE柱吸附剂用于茶油中PAEs的富集和净化,能够有效地去除油脂等大分子的干扰,并结合GC-MS进行分析,建立了一种新的快速、准确测定茶油中6种邻苯二甲酸类增塑剂含量的分析方法。实验发现,所制备的SWCNTs玻璃SPE小柱净化效果不亚于常用的商业PSA、C18SPE小柱,且SWCNTs SPE小柱经5 mL甲苯洗涤后,可多次重复使用,大大降低了分析成本。该方法简便、经济、省溶剂、污染小、实用性强,能够满足茶油中PAEs检测的需要,也同样适用于花生油、菜籽油、橄榄油等食用油中PAEs的检测。
[1] Gong H P,Xia A P,Zheng R X,et al.Farm Machinery(龚鸿萍,夏爱萍,郑睿行,等.农业机械),2012(33):58
[2] Ma L,Chen Y Z.Chinese Agricultural Science Bulletin(马力,陈永忠.中国农学通报),2009,25(8):82
[3] Long Q Z,Huang Y H,Zhong H Y,et al.Journal of the Chinese Cereals and Oils Association(龙奇志,黄永辉,钟海雁,等.中国粮油学报),2009,24(1):70
[4] Fasano E,Bono-Blay F,Cirillo T,et al.Food Control,2012,27:132
[5] Marega M,Grob K,Moret S,et al.J Chromatogr A,2013,1273:105
[6] Yao W R,Yu Y,Yan W,et al.China Oils and Fats(姚卫蓉,俞晔,阎微,等.中国油脂),2010,35(6):38
[7] Yang Y C,Zhang M M,Sun Y M,et al.Journal of the Chinese Cereals and Oils Association(杨艺超,张明明,孙远明,等.中国粮油学报),2012,27(6):110
[8] Zheng X H,Lin L Y,Fang E H,et al.Chinese Journal of Chromatography(郑向华,林立毅,方恩华,等.色谱),2012,30(1):27
[9] De Orsi D,Gagliardi L,PorràR,et al.Anal Chim Acta,2006,555:238
[10] Li R W,Cheng G H,Wang T,et al.China Brewing(李仁伟,成桂红,王涛,等.中国酿造),2011(7):180
[11] Holadova K,Prokupkova G,Hajslova J,et al.Anal Chim Ac-ta,2007,582:24
[12] Zhang C Y,Wang H,Zhang X H,et al.Chinese Journal of Chromatography(张春雨,王辉,张晓辉,等.色谱),2011,29(12):1236
[13] Wang P G,Gao M X,Cheng G,et al.Food Science(王鹏功,高明星,程刚,等.食品科学),2012,33(18):246
[14] Hu Y C,Li M Y,Xu J,et al.Journal of Food Science and Biotechnology(胡银川,李明元,徐锦,等.食品与生物技术学报),2011,30(4):583
[15] Chen Z M,Xu X F,Ding Y P,et al.Chinese Journal of Health Laboratory Technology(陈志民,徐晓枫,丁永萍,等.中国卫生检验杂志),2013,23(2):304
[16] Xu D M,Deng X J,Fang E H,et al.J Chromatogr A,2014,1324:49
[17] Lijima S.Nature,1991,354:56
[18] Kroto H W,Heath J R,O′Brien S C,et al.Nature,1985,318:162
[19] Li H F,Yang H Y,Zhang Y,et al.Chinese Journal of Chromatography(李海芳,杨红云,张英,等.色谱),2014,32(4):413
[20] Zhang B T,Zheng X X,Li H F,et al.Anal Chim Acta,2013,784:1
[21] Zhang F,Li Z H,Huang Y Y,et al.Food &Machinery(张帆,李忠海,黄媛媛,等.食品与机械),2013,29(5):87
[22] Pyrzynska K.Chemosphere,2011,83:1407
[23] He S W,Huang Z P,Zhu Y.Chinese Journal of Chromatography(何世伟,黄忠平,朱岩.色谱),2013,31(12):1146

