同时提取五味子色素、多糖和木脂素的研究
王 东,徐 菡,赵镇雷,冯咏梅,常秀莲,周 红
(1. 烟台大学生命科学学院,山东 烟台 264005;2. 青岛鹏远康华天然产物有限公司,山东 莱西 266612)
五味子(SchisandrachinensisBaill.)又名山花椒,因其果实具有甘、苦、酸、辛、咸而得名[1].五味子是双子叶植物门、木兰亚纲、八角目、五味子科植物[2],根据五味子醇甲和五味子酯甲的含量,五味子又分北五味子属(Schisandra)和南五味子属(Kadsura)2个属,北五味子(Schisandrachinensis(Turcz.) Baill.)的特征成分为五味子醇甲,其含量不少于0.4%,南五味子又名华中五味子特征成分为五味子酯甲,其含量不少于3.0%[3].
五味子含有木脂素、有机酸、维生素、色素、挥发油及多糖等多种成分[4-6],自从1970年发现它具保肝降酶作用以来,研究还发现其具有抗癌、抗溃疡、镇静、抗艾滋病毒、拮抗血小板活化因子和抑制醛糖还原酶等多种活性[7].五味子作为一种新型的“药食同源”功能性保健食品,应用范围愈来愈广,其果实已成为新兴食品工业的一种重要原料.但目前的研究多数仅限于对其中一种成分的研究,缺少对五味子多种活性成分的综合提取研究,造成五味子资源的浪费.因此如何提高五味子资源的利用率,综合利用五味子资源是目前亟待解决的问题之一.
1 料料与方法
1.1 实验仪器
Agilent 1200高效液相色谱仪,美国安捷伦公司;RE52CS-2旋转蒸发仪,上海亚荣生化仪器厂;752S紫外可见分光光度计,上海棱光技术有限公司;TU-1900双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;DL-5型低速大容量离心机,上海安亭科学仪器厂.
1.2 实验试剂
五味子果实,吉林鹏远生物科技有限公司提供;葡萄皮色素,青岛鹏远康华天然产物有限公司提供;五味子醇甲、五味子醇乙、五味子酯甲、五味子甲素、五味子乙素标准品,上海顺勃生物制药公司;甲醇,色谱纯;其他试剂为分析纯;SP207树脂,日本三菱化学树脂,北京慧德易科技有限责任公司供应.
1.3 分析方法
1.3.1 木脂素含量的测定 采用高效液相色谱法测定五味子醇甲、五味子醇乙、五味子酯甲、五味子甲素、五味子乙素的含量.木脂素含量以上述六种木脂素含量之和来计算[8].
1.3.2 多糖含量的测定 采用苯酚-硫酸法[9].
1.3.3 花青素含量的测定 采用示差法[10],按矢车菊-3-葡萄糖苷来计算.
1.3.4 色价测定 通过测定吸光度值来计算[11].
1.4 实验方法
1.4.1 样品预处理 将五味子果实于40 ℃下烘干,粉碎,粒度为40~60目.
1.4.2 提取流程 2种同时提取五味子木脂素、色素和多糖的实验流程,见图1、图2.

图1 同时提取色素、多糖和木脂素流程Ⅰ
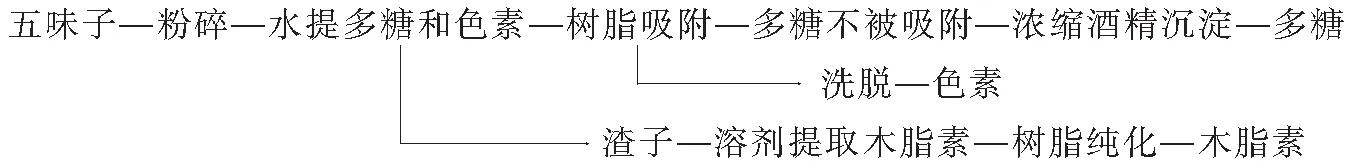
图2 同时提取色素、多糖和木脂素流程Ⅱ
1.4.3 五味子色素和多糖的提取 称取上述五味子粉末50 g,加入10倍体积的蒸馏水,于80 ℃水浴中搅拌提取2 h.离心后的残渣重复提取5次,测定每次提取的多糖和色素的含量,计算多糖的提取率.
1.4.4 大孔树脂吸附分离色素和多糖 经过预处理的SP207树脂采用排水法装柱.由1.4.2项图2得到的色素粗提液,以1 BV/h的流速上柱,待树脂吸附饱和,将流出液浓缩、醇沉,用于提取多糖.
当树脂吸附饱和后,先用蒸馏水洗柱去除杂质,直到流出液澄清.然后用含有0.3%柠檬酸的70%乙醇水溶液(1 BV/h)洗脱,收集洗脱液.收集洗脱液在旋转蒸发仪上进行浓缩,然后60 ℃干燥,称重,计算色素的得率.
1.4.5 正交试验优化回流提取五味子木脂素 取提取完色素和多糖的五味子干渣20 g,9份,按1∶10的固体和乙醇水溶液料液比加入乙醇水溶液,乙酸乙酯和乳化剂EM的加入量均按占乙醇水溶液的体积百分比计算.设计L9(34)正交实验,如表1所示.表1中,A指乙醇水溶液的浓度,B、C分别指加入的乙酸乙酯、EM与乙醇水溶液的体积百分比.超声30 min,回流提取2次,每次2 h.将上清液混合、浓缩至浸膏,以原溶液1/2体积蒸馏水溶解,分别用HPLC法和分光光度法测溶液木脂素含量和透光率.

表1 试验因素水平表
2 结果与分析
2.1 同时提取色素、多糖和木脂素实验流程优化
采用图1和图2所示的实验流程同时提取木脂素、色素和多糖,2种流程的结果比较如表2所示.
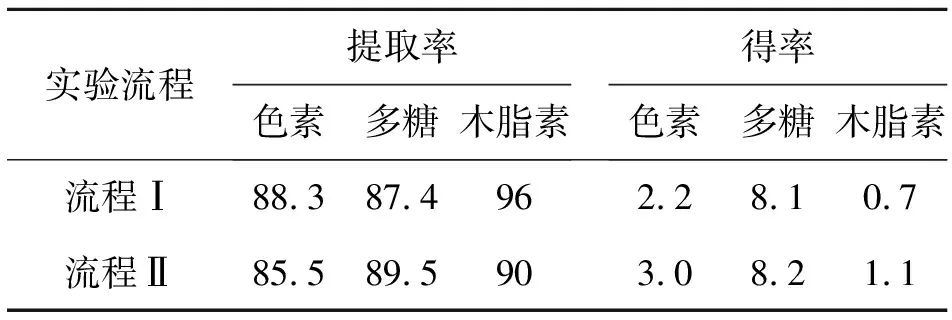
表2 2种流程的实验结果
如表2所示,流程Ⅰ的木脂素虽然提取率高于流程Ⅱ,但得率低;流程Ⅱ的色素得率也高于流程Ⅰ.实验流程Ⅰ提取液中含有大量的色素等杂质,在树脂纯化之前,先去除提取液中的乙醇,加入少量的水进行混合,然后用乙酸乙酯萃取,得到的下相是含有大量色素的水相,上相乙酸乙酯相是主要含有木脂素和少量色素,基本上将色素和木脂素进行了有效的分离,但与实验流程Ⅱ相比,流程Ⅰ比较复杂,增加了乙酸乙酯的萃取步骤,而且乙酸乙酯相中仍然含有少量的色素;流程Ⅱ先采用热水提取法,将色素和多糖分离出去,剩余的残渣中主要含有木脂素,这样提取的木脂素纯度得到提高,木脂素是3种目标产品中最有价值的,因此后续实验均采用方案Ⅱ.
2.2 五味子色素和多糖提取
综合考虑到五味子色素的稳定性和多糖的提取率,前期实验得到适宜的提取温度为80 ℃,研究提取次数对五味子多糖和色素提取率的影响.以提取次数为横坐标,多糖提取率和色素在520 nm处的吸光度值为纵坐标,得出多糖提取率和色素量随提取次数的变化曲线,如图3所示.

图3 提取次数对五味子多糖和色素提取率的影响
从图3可以看出,随着提取次数的增加,五味子色素和多糖的提取率越来越低.当提取次数超过3次时,多糖的提取率和色素的含量变化不显著.前3次多糖的提取率为89.47%,色素的提取率为85.45%,考虑到实际应用的生产成本和工作量,水法提取五味子色素和多糖的最佳提取次数为3次.
2.3 SP207树脂分离多糖和色素
将色素和多糖的提取液上SP207树脂柱,多糖不被吸附,流出柱子,色素被吸附并得到纯化.当上料液体积达到120个柱体积时,色素树脂吸附饱和.真空浓缩流出液,用4倍体积的95%乙醇醇沉得到粗多糖沉淀,无水乙醇洗涤3次后干燥,得粗多糖8.2 g,粗多糖得率8.2%,和多数文献报道的最佳提取条件(100 ℃提取多糖的得率11.3%)接近[12].
五味子含有大量有机酸,pH值约为3.0,提取5次后pH值仍为3.0~3.2,说明五味子在此pH下缓冲能力很好,可采用水法直接提取色素和多糖,不需要调节pH.此法成本低,无毒、无污染,产品后处理简单,提取率高,可用于工业生产.
当洗脱液为2个柱体积时,大部分色素被洗脱下来.洗脱液真空浓缩,60 ℃烘干后得到色素3 g,得率3%,色价2.87,花青素为2.75mg/g,干燥物粘稠,色价和花青素含量较低,可能色素吸附后,用水清洗不充分,使糖类的残留量高.考虑到色素收率较低,工业化生产不建议从五味子中提取色素.
2.4 从渣子中提取五味子木脂素
文献[13]中优化的乙醇和乳化剂EM联合提取木脂素的方法得到的粗提液比较混浊,长时间放置,溶液有沉淀产生,采用乙酸乙酯进行二次萃取纯化虽然可以改善溶液的澄清度,但过程比较麻烦,而且木脂素损失较大.因此尝试在提取过程中加入乙酸乙酯进行提取,以木脂素含量和透光率为指标考察溶剂组成对木脂素提取效果的影响,结果见表3.
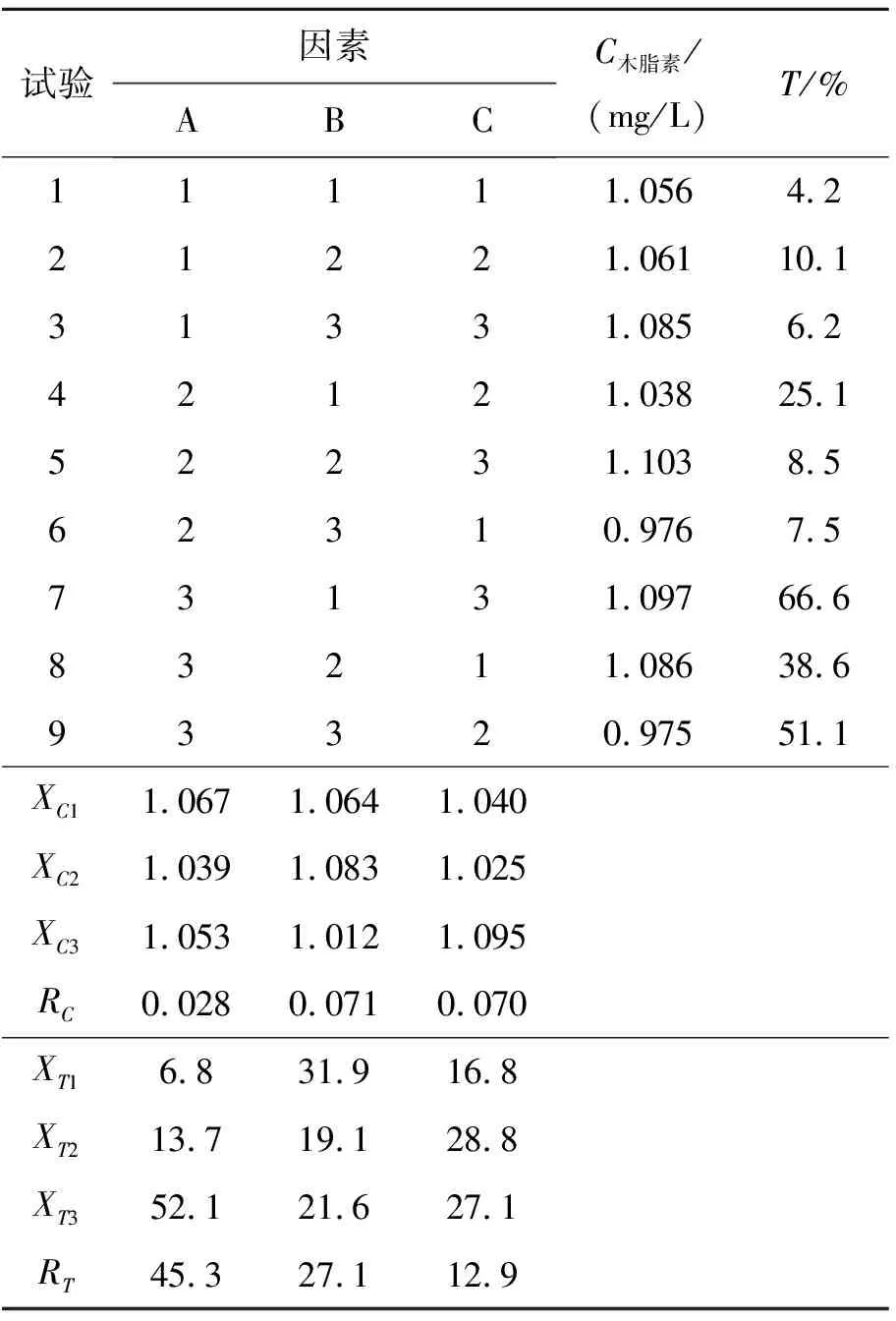
表3 正交试验结果表
由表3透光率极差值大小可知,各因素作用主次为A>B>C,最佳溶剂配比为A3B1C2,即乙醇水溶液浓度为80%,乙酸乙酯和EM的加入量分别为乙醇水溶液体积的10%和2%.由木脂素含量极差值大小可知,各因素作用主次为A>B>C,最佳溶剂配比为A1B2C3,即:乙醇水溶液浓度为60%,乙酸乙酯和EM的加入量分别为乙醇水溶液体积的10%和3%.可见,以提取液透光率和木脂素含量为指标得出的最佳条件不一致,所以在上述2个最佳提取条件下,补充实验,提取五味子木脂素,测定样液的木脂素含量和透光率,结果见表4.

表4 验证试验结果
由表4可知,透光率高的试验组五味子木脂素含量也高,说明溶液的澄清度对五味子木脂素含量的测定有影响.通过表4的分析结果,发现各因素对五味子木脂素含量无显著影响,因此可忽略其影响效果,只考察溶液透光率的影响.通过观察实验现象,发现提取液放置一段时间后,实验组1~3出现沉淀,说明其乳化效果不佳.而用液相色谱法测定木脂素含量时,样液必须用0.45 μm滤膜过滤,沉淀的木脂素不能透过滤膜,对实验结果造成影响.
综合以上结果,采用第4组实验结果提取五味子木脂素,即乙醇水溶液浓度为80%、乙酸乙酯和EM的加入量分别为乙醇水溶液体积的10%和2%时,粗提液比较澄清,稳定性较好,无沉淀,木脂素含量高,有利于进一步纯化五味子木脂素.
3 结 论
(1)建立了同时提取五味子多糖和木脂素的最佳工艺流程:
五味子—粉碎—水提多糖和色素—树脂吸附脱色—多糖不被吸附—浓缩酒精沉淀—多糖;
渣子—溶剂提取木脂素—树脂纯化—木脂素.
(2)从五味子中提取天然色素,工业化生产意义不大.
(3)多种溶剂混合的回流提取法提取五味子木脂素的最佳溶剂组成为:乙醇水溶液浓度为80%,乙酸乙酯和乳化剂EM的加入量分别为乙醇水溶液体积的10%和2%.
参考文献:
[1]张兰杰, 张维华, 赵珊红. 北五味子果实中多糖的提取与纯化研究[J]. 鞍山师范学院学报, 2002, 4(1): 58-60.
[2]中国科学院华南植物研究所. 海南植物志(第一卷)[M].北京:科学出版社, 1964: 232.
[3]Zhao Yangyun. Berryfruit: Value-added products for health promotion[M]. CRC Press: Boca Raton, 2007.
[4]王慕邹. 常用中草药高效液相色谱分析[M]. 北京:科学出版社, 1999: 55-56.
[5]倪立东, 陈延西. 五味子药理作用研究概况[J]. 暨南大学学报:医学版, 1996, 17(2): 125-128.
[6]刘国宇, 陈旭. 五味子木脂素类化学成分及其含量分析方法的研究现状[J]. 黑龙江医药, 2010, 3(2): 228-230.
[7]郑占虎, 董泽宏,佘靖,等. 中药现代研究与临床应用[M]. 北京:学苑出版社, 1997: 148-156.
[8]Lu Yan, Chen Daofeng. Analysis of Schisandra chinensis and Schisandra sphenanthera[J]. Journal of Chromatography A, 2009, 1216: 1980-1990.
[9]Dubois M, Gilles K A, Hamilton J K, et al. Colorimetric method for determination of sugars and related substancesm[J]. Analytical Chemistry, 1956, 28: 350-356.
[10]Lee J, Durst R W, Wrolstad R E. Determination of total monomeric anthocyanin pigment content of fruit juices, beverages, natural colorants, and wines by the pH differential method: Collaborative study[J]. Journal of AOAC international, 2005, 88(5): 1269-1278.
[11]王清滨, 陈国良. 食品着色剂及其分析方法[M]. 北京: 化学工业出版社, 2004: 211-214.
[12]范荣军, 任涛, 刘成柏, 等. 五味子多糖提取工艺的比较研究[J]. 中成药, 2008, 30(6): 827-831.
[13]陈碧云,王东,常秀莲,等.乳化剂辅助提取五味子木脂素的研究[J].食品科技,2011,36(9):247-250.

