不同电子受体除磷污泥相似性与菌群结构研究
吕小梅 ,李 继 ,2,3*,李朝林 ,刘洞阳 ,邵明非 ,2,3,夏 雪 (.哈尔滨工业大学深圳研究生院,广东 深圳 58055;2.深圳水资源利用与环境污染控制重点实验室,广东 深圳 58055;3.深圳市城市废弃物能源再生公共技术服务平台,广东 深圳 58055)
强化生物除磷(EBPR)被认为是最经济有效且环境友好的生物除磷技术.在该工艺中,通过交替的厌氧-好氧环境,除磷菌(PAO, phosphorus accumulating organisms)能够得到富集并发挥除磷效能.除了厌氧-好氧条件外,厌氧-缺氧条件下磷同样能够得到去除[1-3].人们将这类在厌氧-缺氧条件下能够除磷的微生物称之为反硝化除磷菌(DPAO,denitrifying phosphorus accumulating organisms),因其能够实现同步脱氮除磷,因而对低碳氮污水的处理具有重要的意义.
目前对于反硝化除磷的研究主要集中在以硝态氮为电子受体的反硝化除磷的研究,结果表明,硝态氮是合适的反硝化除磷污泥电子受体,且有利于节约曝气,降低除磷脱氮对碳源的需求[4-5],节约运行成本.因而,研究人员致力于开发反硝化除磷工艺或在原有除磷工艺基础上最大化实现反硝化除磷[6-7,3].另一方面,作为反硝化过程的中间产物,亚硝氮同样可以作为反硝化除磷污泥的电子受体[8-11].不同形式的基于亚硝氮反硝化除磷工艺均具有良好的脱氮除磷效果,亚硝氮为电子受体的反硝化除磷工艺的研究对强化生物除磷技术的革新具有重要意义.
尽管反硝化除磷得到了广泛的研究,然而,由于环境中绝大部分微生物是不可培养的,而采用现代分子生物学技术的研究也主要是针对厌氧-好氧环境中的好氧除磷污泥.利用不同电子受体吸磷的除磷菌是否属于同一类细菌,目前仍然存在较大争议.针对除磷菌分类,目前研究主要是通过宏观表现出来的吸磷特性进行定性[12-14],不能从本质上揭示原因.为此,本研究采用基于高通量测序的分子生物学技术,研究采用不同电子受体(硝酸盐,亚硝酸盐,氧气)除磷污泥的相似性与菌群结构,为除磷污泥的分类与研究提供理论基础.
1 材料与方法
1.1 试验装置
采用3个平行的SBR反应器(图1),分别以硝酸盐(RN03),亚硝酸盐(RN02),氧气(R02)为电子受体培养不同除磷污泥.RN03与 RN02采用厌氧-缺氧方式运行,R02采用厌氧-好氧方式运行.SBR反应器有效体积为6.5L,每天运行3个周期(8h/周期),包括:进水(0.25h),厌氧(2.5h),缺氧或好氧(4.0h),沉淀(1.0h),排水(0.25h).对于厌氧-缺氧反应器(RN03与 RN02),厌氧释磷后,采用蠕动泵在缺氧段的前 1.0h连续投加硝酸盐或亚硝酸盐进行反硝化吸磷.对于厌氧-好氧反应器(R02),好氧段采用曝气泵进行曝气(流量为 0.3m3/h).为保证污泥充分混合,在厌氧与缺氧(或好氧)阶段,采用搅拌器进行搅拌(转速为 40r/min).进水、搅拌、曝气、沉淀、排水等操作均采用时间控制器进行程序切换.厌氧初,将泥水混合液pH值调节至7.0左右,其他阶段不再调节,出水pH值一般为7.6~7.8.
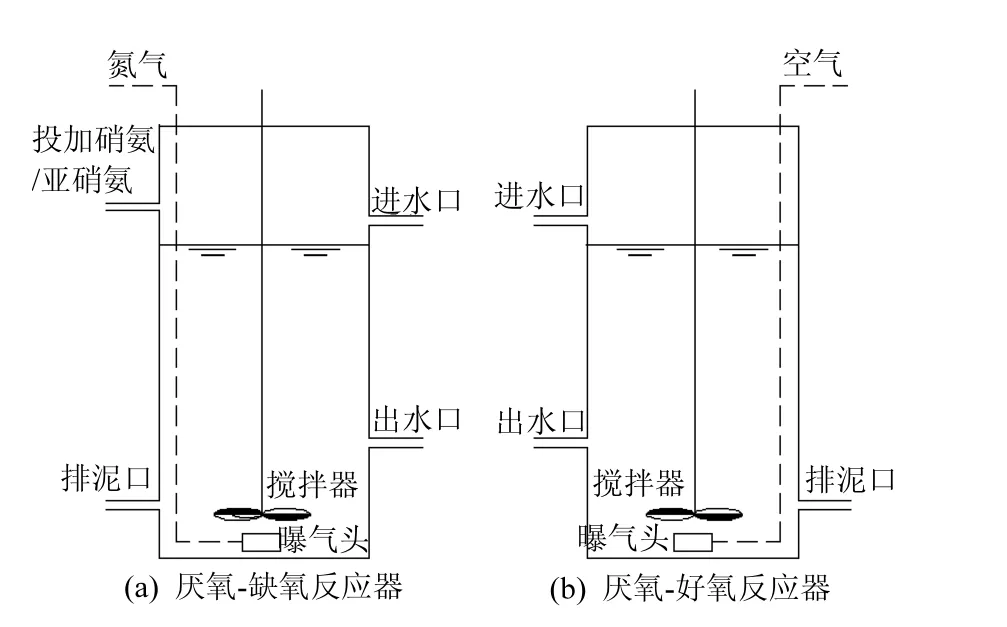
图1 SBR装置示意Fig.1 SBR equipment
每个运行周期结束后,从反应器排出 4L上清液,并补充等量的人工配水,因而反应器水力停留时间(HRT, hydraulic retention time)为13h.RN03,RN02,R023个反应器污泥停留时间(SRT, sludge retention time)控制在15~20d.反应器在室温条件下运行(平均 14.4~27.7℃),运行过程中连续取样监测反应器运行效能.
1.2 接种污泥与进水水质
SBR反应器的接种污泥取自深圳市罗芳污水处理厂(A2/O 工艺)二沉池回流污泥.接种污泥的 SVI(sludge volume index)为105mL/g,以硝酸盐,亚硝酸盐,氧气为电子受体时吸磷量分别为0.80, 0.38, 1.3mgP/gVSS.
进水采用人工配水,每2天配水1次,以保证配水水质不会发生明显变化.每 1L配水中包括:200mg CH3COONa, 14mg NH4Cl, 20mg NaH2PO4与0.3mL微量元素溶液.每1L微量元素包 括 :10g EDTA, 0.12g ZnSO4·7H2O, 0.12g MnSO4·7H2O, 0.03g CuSO4·5H2O, 1.0g FeCl3,0.06g (NH4)2Mo4O13·2H2O, 0.15g CoCl2·6H2O,0.15g H3BO3与0.18g KI.另外,按1:10的体积比例向配水中补加经过初级沉淀后的生活污水(深圳大学城校区内生活污水,其水质见文献[15]).配水中,COD约150mg/L, NH4+-N约5.0mg/L, TP约6.0mg/L.
1.3 水质分析方法
1.3.1 常规指标分析方法 COD, TP, MLSS采用国家标准方法测定.COD测定采用重铬酸钾滴定法, TP测定采用钼酸盐分光光度法, MLSS测定采用重量法.NH4+-N, NO3--N与NO2--N浓度测定采用 Cleverchem200自动化水质分析仪(DeChem-Tech.Gmbh, Germany).
1.3.2 DNA提取,PCR扩增与高通量测序 污泥样品包括接种污泥(Seed),接种运行第100d时3个SBR中污泥.采用FastDNA®土壤试剂盒(MP Biomedicals, Illkirch, France)进行细菌组DNA提取.16S rRNA基因V6区序列采用引物对967F(CAACGCGAAGAACCTTACC)与1046R (CGACAGCCATGCANCACCT)进行扩增[16].30uL PCR反应体系包括: 0.75uL的 MightyAmp®DNA 聚合酶(TaKaRa,大连), 15μL 的 2×Buffer,1.5μL 的前后引物,以及 20~50ng 细菌组 DNA,最后采用 ddH2O补足至 30uL.PCR扩增采用i-Cycler (BioRad, USA),扩增条件为: 98℃首次变性2min,然后是28个循环(98℃ 20s, 55℃ 20s,68℃ 1min),最后在 68℃延伸 5min.为减少 PCR扩增前期的潜在错误,每个DNA样品同步进行3个平行扩增,最后再进行混合与后续分析.扩增后采用 2.0%的琼脂糖凝胶电泳对扩增产物进行验证.最后,PCR 扩增产物采用纯化试剂盒(天根,北京)进行纯化,并采用光度法(NanoDrop-1000)测定产物浓度.为满足测序时样品混合的需要,前后引物分别增加相同的标签(tag)引物.根据不同样品的浓度进行取样混合,保证最后混合样中各样品核酸浓度相同.最后采用 Illumina-HiSeq 2000(深圳华大基因科技有限公司)高通量测序技术进行测序.
2 结果与讨论
2.1 不同反应器运行效能比较
经过39, 54, 27d的连续运行, RN03, RN02与R023个反应器除磷效果分别达到稳定,如图 2所示.
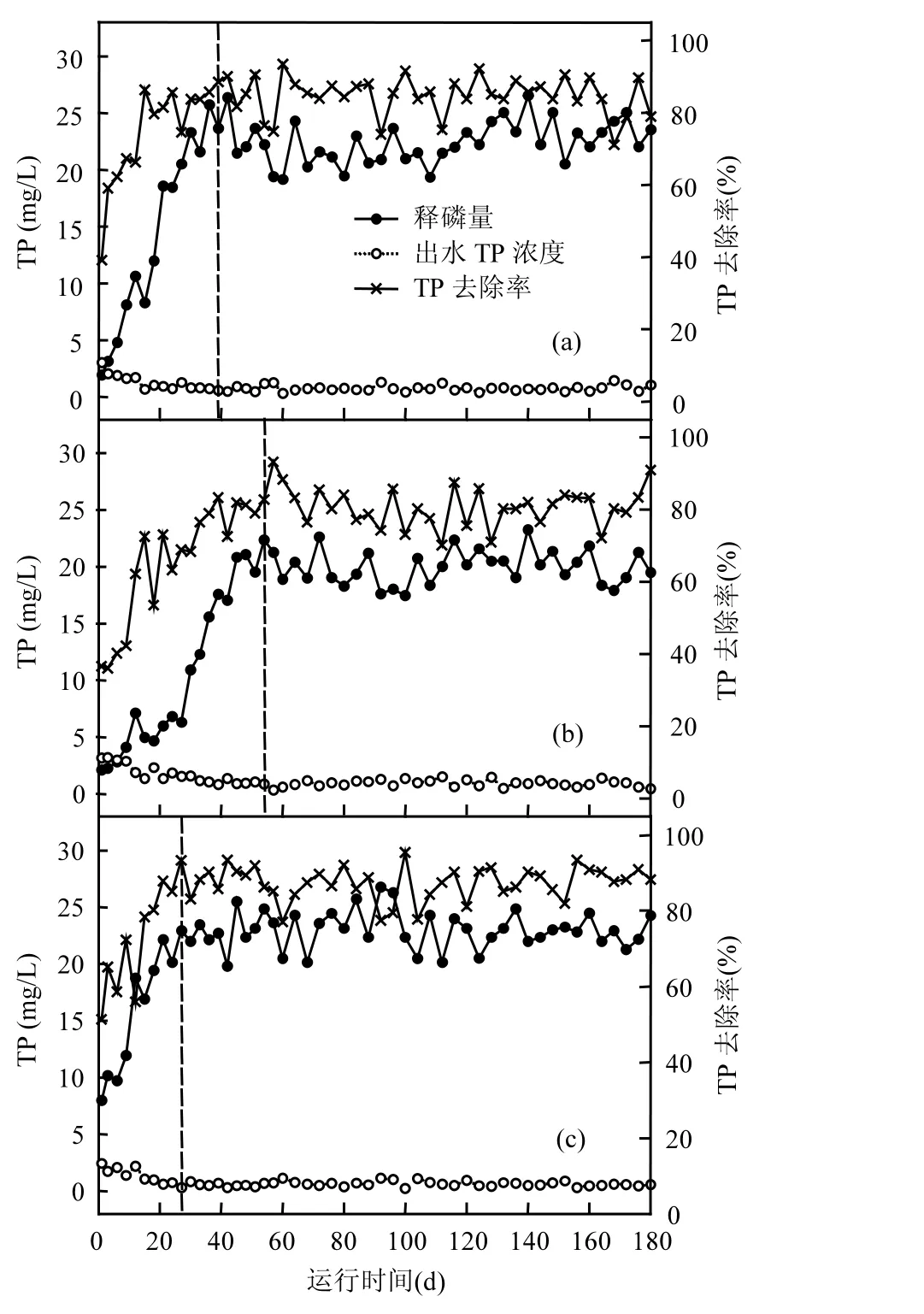
图2 不同电子受体除磷污泥运行效能Fig.2 Operation performance of phosphorus removal sludge with different electron acceptors
从图2可以看出,相比于好氧除磷污泥,反硝化除磷污泥驯化周期相对较长,尤其是以亚硝酸盐为电子受体的反硝化除磷污泥,需要相对较长的适应周期,可能是由于驯化初期亚硝酸盐的抑制作用[17].3个反应器除磷效果稳定后连续126d的运行结果表明,出水 TP浓度平均为 0.85,1.17,0.65mg/L,相应 TP去除率分别为 82.7%,73.5%,86.7%.可见,以硝酸盐为电子受体除磷污泥具有以氧气为电子受体除磷污泥类似的除磷去除率,这与Kapagiannidis等人[18]的研究结果一致.而以亚硝酸盐为电子受体除磷污泥的除磷效率相对较差.
2.2 不同电子受体除磷污泥菌群相似性研究
不同电子受体除磷污泥的菌群相似性采用聚类分析[19]进行评价,图3为基于 3% cutoff-OTUs数目的聚类结果.
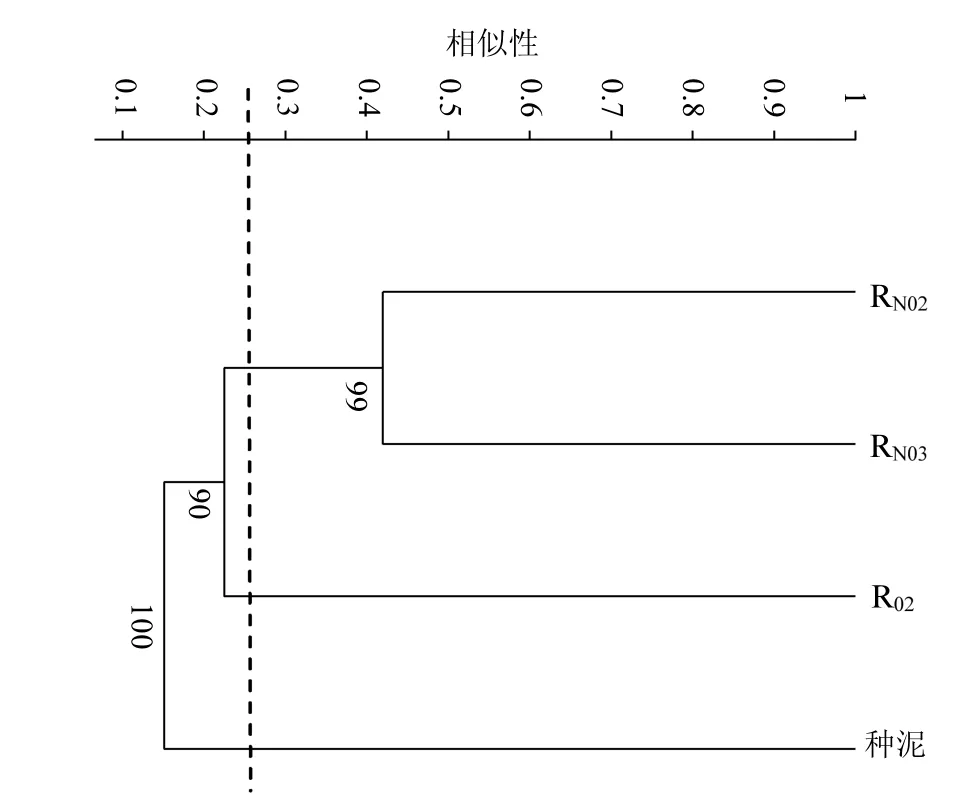
图3 基于3% cutoff OTUs级别的Bray-Curtis距离聚类Fig.3 Cluster analysis based on Bray-Curtis distances of 3% cutoff OTUs level.
从图3可以看出,来自RN03与RN02的反硝化除磷污泥聚为一类,表明以硝酸盐,亚硝酸盐为电子受体的反硝化除磷污泥具有更为相似的菌群结构,而与好氧除磷污泥菌群结构有较大差异.可见,厌氧-缺氧与厌氧-好氧条件分别为反硝化除磷污泥与好氧除磷污泥提供了不同的生长环境.
Candidatus Accumulibacter是目前普遍公认的除磷微生物[20-22].Martin等[23]通过全基因组测序技术发现,Candidatus Accumulibacter基因中无硝态氮还原酶基因,而检测到亚硝氮还原至氮气的酶基因,进而证实了同步脱氮除磷系统中硝态氮的还原是由Candidatus Accumulibacter之外的微生物协助完成,如Dechloromonas相关微生物[22],进而为缺氧条件下反硝化除磷提供电子受体亚硝氮.因而,可以推测以硝酸盐或亚硝酸盐为电子受体的反硝化除磷菌属于同一类微生物.
2.3 不同电子受体除磷污泥的主导菌群研究
不同电子受体除磷污泥中主导 OTUs(序列比例>1.0%)及其在 NCBI基因库中的亲缘微生物的种系发育关系如图4所示.接种污泥,硝酸盐,亚硝酸盐,氧气分别为电子受体除磷污泥的主导OTUs序列比例分别为 41.4%,52.4%,51.5%与69.0%.从图 4中可以看出,不同样品表现出不同的OTUs分布特点,而硝酸盐,亚硝酸盐为电子受体除磷污泥具有更多近似的分布,这一结果同样反映了二者近似的菌群结构.
图4中数据为不同污泥的主导OTUs序列比例.硝酸盐,亚硝酸盐除磷污泥的主导OTUs比例的平均值如图4中左侧圈所示(N*),右侧圈(O)为好氧除磷污泥中主导 OTUs比例.圈尺寸由小到大分别表示序列比例为:<1.0%,1.0~2.0%,2.0~3.0%,3.0~4.0%,>4.0%.基于主导 OTUs 的分布特点,图4中种系发育树可以分为5个簇.第I簇为与Candidatus Accumulibacter或Rhodocyclus purpureus[24]较为近似,主要为除磷相关微生物.且第 I簇中好氧除磷污泥比例高于反硝化除磷污泥,进而可能导致了前述的除磷污泥效能差异.另外,硝酸盐与亚硝酸盐污泥在该簇中 OTUs比例非常近似,再次表明了利用硝酸盐或亚硝酸盐的反硝化除磷污泥可能属于同一类污泥.第II簇为Zoogloea caeni与Thauera aromatic相关微生物,他们是形成污泥絮体的重要微生物,常报道于活性污泥工艺系统.第 III簇与发挥硝化作用的Nitrosococcus halophilus近似.该簇中,好氧除磷污泥与种泥具有近似的比例,且远高于反硝化除磷污泥中比例,这主要是由于厌氧-缺氧条件下氧气受限而抑制了硝化菌的生长繁殖.第IV簇包括了污水处理系统几类常见的微生物,如Desulfonauticus autotrophicus,Halanaerobaculum tunisiense,等.另外,第 V 簇为与 Flavobacterium cheniae相关微生物.Flavobacterium cheniae是一类病原菌微生物[25],以亚硝酸盐为电子受体反硝化除磷污泥中的比例远高于其他污泥,这表明亚硝酸盐反硝化除磷污泥对 Flavobacterium cheniae较强的耐受能力.可见,亚硝氮为电子受体除磷时潜在一定的公共卫生安全隐患.
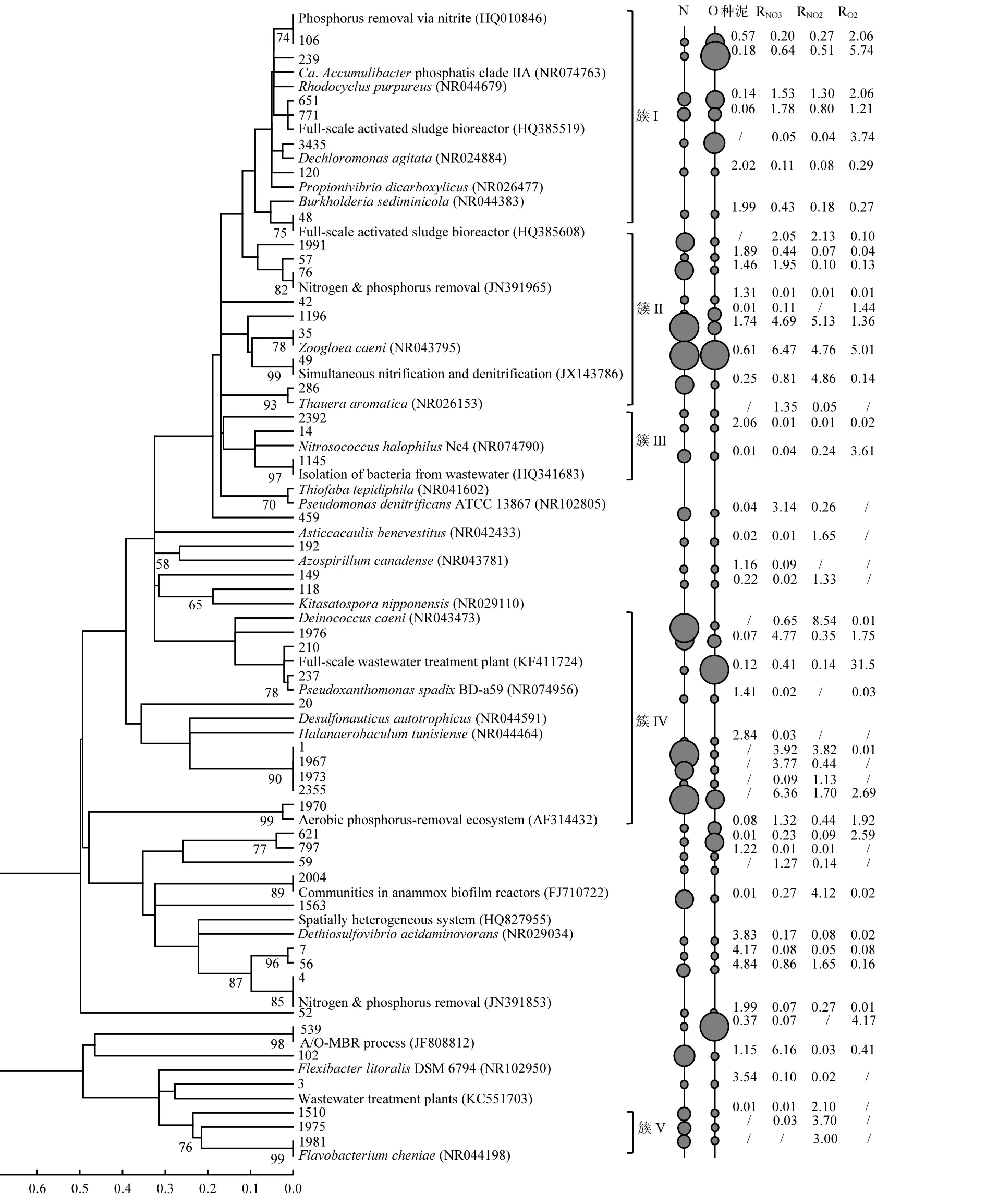
图4 四个污泥样品中主导OTUs(>1.0%)及其NCBI数据库中亲缘微生物的种系发育关系Fig.4 The phylogenetic relationship between the top OTUs (>1.0%) of the four samples and their close relativesretrieved from NCBI Genbank
2.4 聚磷菌与聚糖菌分析
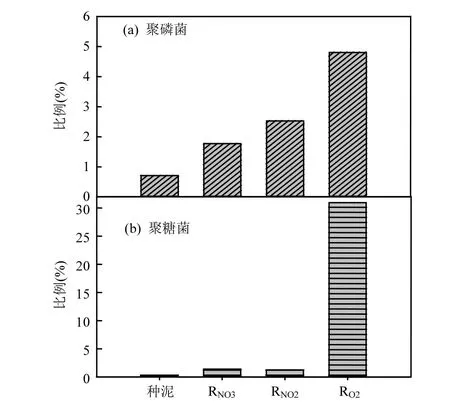
图5 不同样品中聚磷菌与聚糖菌序列比例Fig.5 Proportions of phosphorus accumulating bacteria and glycogen accumulating bacteria in different samples
不同反应器污泥中聚磷菌的分析,主要基于与已鉴定聚磷菌的序列进行比对.Candidatus Accumulibacter是目前普遍公认的聚磷菌[20-22].通过广泛收集基因库中全流程污水处理厂与实验室反应器中除磷菌序列以及种系分析,Kim等[22]将Candidatus Accumulibacter分为4个主要簇,基于 Kim 的序列分析,通过本地 BLAST(Basic Local Alignment Search Tool),得到不同污泥样品中聚磷菌比例[图 5(a)].在 97%的序列相似度条件下,种泥,RNO3,RNO2与 RO2中分别有0.716%,1.78%,2.53%,4.80%的序列可以归于Accumulibacter-like微生物[26-27].这表明,通过厌氧-缺氧或厌氧-好氧驯化后聚磷菌明显得到了富集,且厌氧-好氧条件下聚磷菌比例明显高于厌氧-缺氧条件.尽管如此,以硝酸盐为电子受体除磷污泥与以氧气为电子受体除磷污泥仍然表现出相近的 TP去除率[18].另一方面,Candidatus Accumulibacter具有不同形态与表现型多样性[22,28],厌氧-缺氧条件下有可能存在有别于厌氧-好氧条件下尚未得到鉴定的除磷菌,进而表现出厌氧-缺氧条件下较低的除磷菌比例.因而,需要对更多潜在的除磷菌进行鉴定与分析.
采用了类似的方法对不同电子受体除磷污泥中聚磷菌的竞争者[29-30]聚糖菌(GAO)进行了分析[图5(b)],在97%的序列相似度条件下,种泥,RNO3,RNO2与RO2中分别有0.368%,1.44%, 1.32%,30.9%的序列可以归于GAO-like序列.比较而言,厌氧-好氧条件有利于富集聚磷菌,厌氧-缺氧条件更有利于抑制聚糖菌的大量繁殖.
3 结论
3.1 以硝酸盐,亚硝酸盐,氧气为电子受体除磷污泥对 TP平均去除率分别为84.8%,78.7%,87.4%,出水TP浓度分别为0.758,0.931,0.632mg/L.
3.2 以硝酸盐,亚硝酸盐为电子受体的反硝化除磷污泥具有相似的菌群结构,与好氧除磷污泥菌群结构差异较大.
3.3 不同污泥样品具有不同的主导OTUs分布,亚硝氮为电子受体除磷时潜在一定的公共卫生安全隐患.
3.4 在 97%的序列相似度条件下,种泥,RNO3,RNO2与 RO2中聚磷菌与聚糖菌序列比例分别为0.716%, 1.78%, 2.53%, 4.80%与0.368%, 1.44%,1.32%, 30.9%.
[1]Lacko N, Drysdale G D, Bux F.Anoxic phosphorus removal by denitrifying heterotrophic bacteria [J].Water Science and Technology, 2003,47(11):17–22.
[2]Tsuneda S, Ohno T, Soejima K, et al.Simultaneous nitrogen and phosphorus removal using denitrifying phosphate-accumulating organisms in a sequencing batch reactor [J].Biochemical Engineering Journal, 2006,27(3):191–196.
[3]张玉秀,张伟伟,薛 涛,等.亚硝酸型反硝化除磷污泥驯化方式的比较 [J].中国环境科学, 2009,29(5):493-496.
[4]Hu J Y, Ong S L, Ng W J, et al.A new method for characterizing denitrifying phosphorus removal bacteria by using three different types of electron acceptors [J].Water Research, 2003,37(14):3463-3467.
[5]Shoji T, Satoh H, Mino T.Quantitative estimation of the role of denitrifying phosphate accumulating organisms in nutrient removal [J].Water Science and Technology, 2003,47(11):23–29.
[6]Guerrero J, Taya C, Guisasol A, Baeza J A.Understanding the detrimental effect of nitrate presence on EBPR systems: effect of the plant conf i guration [J].Journal of Chemical Technology and Biotechnology, 2012,87(10):1508–1511.
[7]曾 薇,李博晓,王向东,等.MUCT短程硝化和反硝化除磷系统中 Candidatus Accumulibacter的代谢活性和菌群结构 [J].中国环境科学, 2013,33(7):1298-1308.
[8]蒋轶锋,朱润晔,郑建军,等.亚硝酸盐为电子受体的反硝化除磷工艺特征 [J].中国环境科学, 2008,28(12):1094–1099.
[9]王爱杰,吴丽红,任南琪,等.亚硝酸盐为电子受体反硝化除磷工艺的可行性 [J].中国环境科学, 2005,25(5):515–518.
[10]Marcelino M, Wallaert D, Guisasola A, et al.A two-sludge system for simultaneous biological C, N and P removal via the nitrite pathway [J].Water science and technology, 2011,64(5):1142–1147.
[11]Ma B, Wang S Y, Zhu G B, et al.Denitrification and phosphorus uptake by DPAOs using nitrite as an electron acceptor by step-feed strategies [J].Frontiers of Environmental Science and Engineering, 2013,7(2):267–272.
[12]李勇智,彭永臻,王淑滢,等.强化生物除磷体系中的反硝化除磷[J].中国环境科学, 2003,23(5):543–546.
[13]Zeng R J, Saunders A M, Yuan Z G, et al.Identification and comparison of aerobic and denitrifying polyphosphateaccumulating organisms [J].Biotechnology and Bioengineering,2003,83(2):140–148.
[14]Freitas F, Temudo M, Reis M A M.Microbial population response to changes of the operating conditions in a dynamic nutrient-removal sequencing batch reactor [J].Bioprocess and Biosystems Engineering, 2005,28(3):199–209.
[15]李 继,吕小梅,董文艺,等.A2N/BAF组合工艺深度除磷脱氮研究 [J].哈尔滨工业大学学报, 2012,44(2):80-84.
[16]Turnbaugh P J, Hamady M, Yatsunenko T, et al.A core gut microbiome in obese and lean twins [J].Nature, 2009,457(7228):480–487.
[17]刘建广,付昆明,杨义飞,等.不同电子受体对反硝化除磷菌缺氧吸磷的影响 [J].环境科学, 2007,28(7):1472–1476.
[18]Kapagiannidis A G, Zafiriadis I, Aivasidis A.Comparison between UCT type and DPAO biomass phosphorus removal efficiency under aerobic and anoxic conditions [J].Water Science and Technology, 2009,60(10):2695–2703.
[19]Zhang T, Shao M F, Ye L.454Pyrosequencing reveals bacterial diversity of activated sludge from 14sewage treatment plants [J].ISME Journal, 2011,6(6):1137–1147.
[20]Crocetti G R, Hugenholtz P, Bond P L, et al.Identification of polyphosphate-accumulating organisms and design of 16S rRNA-directed probes for their detection and quantitation [J].Applied and Environmental Microbiology, 2000,66(3):1175–1182.
[21]Kong Y, Nielsen J L, Nielsen P H.Microautoradiographic study of Rhodocyclus-related polyphosphate-accumulating bacteria in full-scale enhanced biological phosphorus removal plants [J].Applied and Environmental Microbiology, 2004,70(9):5383–5390.
[22]Kim J M, Lee H J, Kim S Y, et al.Analysis of the Fine-Scale Population Structure of “Candidatus Accumulibacter phosphatis”in Enhanced Biological Phosphorus Removal Sludge, Using Fluorescence In Situ Hybridization and Flow Cytometric [J].Applied and Environmental Microbiology, 2010,76(12):3825–3835.
[23]Martin H G, Ivanova N, Kunin V, et al.Metagenomic analysis of two enhanced biological phosphorus removal (EBPR) sludge communities [J].Nature Biotechnology, 2006,24(10):1263–1269.
[24]Zilles J L, Peccia J, Kim M W, et al.Involvement of Rhodocyclus-related organisms in phosphorus removal in full-scale wastewater treatment plants [J].Applied and Environmental Microbiology, 2002,68(6):2763–2769.
[25]Bernardet J-F, Segers P, Vancanneyt M, et al.Cutting a Gordian knot: emended classification and description of the genus Flavobacterium, emended description of the family Flavobacteriaceae, and proposal of Flavobacterium hydatis nom.nov.(basonym, Cytophaga aquatilis Strohl and Tait 1978).International Journal of Systematic Bacteriology, 1996,46(1):128-148.
[26]Jeon C O, Lee D S, Park J M.Microbial communities in activated sludge performing enhanced biological phosphorus removal in a sequencing batch reactor [J].Water Research, 2003,37(9):2195–2205.
[27]Seviour R J, Mcllroy S.The microbiology of phosphorus removal in activated sludge processes- the current state of play [J].Journal of Microbiology, 2008,46(2):115-124.
[28]Carvalho G, Lemos P C, Oehmen A, et al.Denitrifying phosphorus removal: linking the process performance with the microbial community structure [J].Water Research, 2007,41(19):4383–4396.
[29]Whang L M, Park J K.Competition between polyphosphate- and glycogen-accumulating organisms in enhanced-biologicalphosphorus-removal systems: Effect of temperature and sludge age [J].Water Environment Research, 2006,78(1):4–11.
[30]Oehmen A, Saunders A M, Vives M T, et al.Competition between polyphosphate and glycogen accumulating organisms in enhanced biological phosphorus removal systems with acetate and propionate as carbon sources [J].Journal of Biotechnology,2006,123(1):22–32.

