UV体系中3种微量类固醇雌激素的竞争降解及同趋转化
马晓雁,倪梦婷,倪永炯,李青松,张泽华,高乃云,吴荣光 (.浙江工业大学建筑工程学院,浙江 杭州 00;.厦门理工学院水资源环境研究所,福建 厦门 6005;.同济大学环境科学与工程学院,上海 0009;.浙江省浦江县固废管理中心,浙江 浦江 00)
城市周边地表水源中常检出种类繁多的微量污染物,这些物质极易穿透净水工艺进入供水系统,通过多种途径(吸入、接触和饮用等)及多种作用机理对人类的健康造成威胁.其中对人体内分泌系统具有干扰效应的激素类污染物备受关注[1-5],如对生态雌性化潜在影响最大的3种物质雌酮(E1)、17-β雌二醇(E2)和17-α乙炔基雌二醇(EE2)[6-7].E2是雌激素作用最强的一种天然类固醇雌激素,EE2是人工合成雌激素,为避孕药的主要成分[8-9],城市污水、养殖废水等等是水环境类固醇雌激素的重要来源.有调查表明,类固醇雌激素在不同水系的水源水中均有检出[10-14],且现有给水处理工艺的局限性导致出厂水和管网水中时有检出[15-16].德国建议 E2,EE2的环境质量标准分别为 0.5,0.03ng/L[17],与之相比,许多受调查水环境中的类固醇类雌激素普遍偏高[18-21],威胁饮水安全.
活性炭吸附、高级氧化及生物降解等工艺可有效去除水中微量类固醇雌激素[22-25],但目前相关的污染控制研究多关注于方法或工艺对单一物质的去除效果[26],或是将污染原水有机物总量视为竞争影响因素,弱化了水中微量污染混合存在及相互影响的本质.本文采用UV-C(254nm)及相关工艺作为控制手段,对水中存在的 3种微量类固醇雌激素(E1,E2和EE2)进行同时降解,分析了 UV体系中混合污染物竞争降解机制及转化产物的相似性.
1 材料与方法
1.1 试剂与仪器

图1 UV反应器示意Fig.1 Schematic diagram of photoreactor
雌酮(标准品,≥99.5%,Dr.Ehrenstorfor GmbH,德 国 );17α- 乙 炔 基 雌二 醇 (标 准 品 ,≥99.3%,Dr.Ehrenstorfor GmbH,德国);17β-雌二醇(标准品,≥96.8%,Dr.Ehrenstorfor GmbH,德国);乙腈(色谱纯,9%,CNW,美国);甲醇(色谱纯,99%,CNW,美国);纳米级 TiO2(P-25,Degussa,德国);超纯水(18MΩ,Mili-Q,美国);去离子水(实验室自制);其他试剂等均为分析纯.
高效液相色谱仪(Agilent1200,安捷伦,美国)配Eclipse XDB-C18 色谱柱(5 μm,46mm×150mm,美国);12头固相萃取装置(CNW,美国);C18固相萃取小柱(CNW,美国);12孔氮吹仪(OA-SXS,美国);紫外灯管与石英套管(图 1,254nm,亚光照明,杭州);不锈钢紫外光反应器(直径0.24m,容积20L,3支12W紫外灯,分别开启1,2和3支灯管时,紫外辐照强度分别为 168,350,550µW/cm2);离子阱液相质谱联用仪(LCQ Decaxp Max, Finniga,德国).
1.2 试验方法
分别取适量E1、E2和 EE2的储备液(溶于甲醇,1g/L)用超纯水稀释成 1mg/L的使用液,取一定量使用液于反应器中用去离子水配制成50μg/L(以实测为准)20L待反应溶液,采用UV(254nm)光解目标物,改变光强(UV 体系)、H2O2投加量(UV/H2O2体系,固定辐照强度 350µW/cm2)和催化剂投加量(UV/H2O2/TiO2体系,固定辐照强度350 µW/cm2,H2O2投加量10mg/L)等条件,分别在2,5,10,15,30,50,80,120min取样,加入过量 Na2S2O3终止反应.水样经固相萃取预处理后液相色谱进样分析剩余目标物浓度.
液相色谱流动相为乙腈和水,比例 50:50,流速 0.7mL/min,检测波长 220nm,进样体积 20μL,E2、EE2和E1保留时间为5.0,6.2,7.2min.产物分析取自 UV/H2O2体系(辐照强度 350µW/cm2,H2O2投加量 10mg/L).质谱条件鞘气流速 20arb,喷雾电压3kV,毛细管温度300℃,全扫描模式.
2 结果与讨论
2.1 单独UV辐照下E1,E2和EE2的竞争降解
E1,E2和 EE2类固醇雌激素具有感光的酚类结构[27],因此光解对其具有一定的去除效果.由图2可见,UV辐射降解E1,E2和EE2过程均符合一级反应动力学模型,速率常数随着光强的增大而增大.有文献[28-30]指出,E1和E2在UV-C下的光解属于直接光解,即污染物分子吸收了光子能量后,由低能态被激发至高能态,进而引发分子化学键断裂等导致各种不可逆反应,因此 E1和 E2的降解效率主要与光子数量相关.本试验中E1,E2和EE2的降解速率均随着光强的增加而提高,原因为提高光强使得单位时间单位反应体积内光子流量增加,反应速率随之加快.

图2 不同光强条件下UV系统中类固醇雌激素的去除效果及一级反应动力学拟合曲线Fig.2 Steroid estrogens degradations by UV irradiation and first order kinetic models under different light intensities

3种类固醇雌激素同时存在时,紫外光辐照强度 168µW/cm2,反应 50min时,E1去除率为88.7%,120min时去除率可达98.1%;E2的去除率分别为 26.6%和 37.0%;EE2的去除率分别为23.0%和31.3%.E1的去除效果最理想,EE2和E2去除效果较差;光强较低时,E2的降解效果和降解速率高于EE2,但光强提高后,EE2的降解效果和降解速率反优于E2.随着光强的增加,3种目标物去除效果均进一步加强, E1降解速率常数的提高幅度最大,表明 E1具有更强的光降解活性.Liu[28]指出,UV-C可快速降解水溶液中E1和E2,但UV-A仅对E1有降解效果,表明E2化学键断裂所需要的能量高于E1,本试验的同时降解效果也表明竞争条件下,E2更难降解;但在本实验条件下,E2未能快速降解.Whidbey等[31]的研究表明,在直接光降解的条件下 E1的半衰期要远小于E2和EE2,本试验中E1降解优势明显结论与之相符.
2.2 UV/H2O2体系中E1,E2和EE2的竞争降解
UV/H2O2系统对E1、E2和EE2的降解效果优于UV工艺,随着H2O2浓度的增加,去除效果进一步提高.UV/H2O2工艺对E1、E2和EE2的降解过程均很好的符合一级反应动力学模型,反应速率常数随着 H2O2投加量增大而增大.H2O2投加量为 5mg/L时,E1在 50min的去除率达到96.9%;E2和EE2的去除率由32.0%和28.2%(单纯UV工艺)提高至49.2%和51.7%,去除效果仍不理想.E1的降解效果和速率仍远高于 E2和EE2,处于优势降解地位;EE2去除效果优于E2.
UV/H2O2系统对 3种类固醇雌激素的降解实质为光敏化降解过程,H2O2作为电子受体在受到紫外光辐射下,吸收光子后O-O键断裂产生氧化性极强的·OH,·OH氧化还原电位高达2.8eV,对水中有机物有极强的氧化能力[32-35].随着 H2O2投加量增加,产生的·OH数量增加,因此该体系中E1,E2和EE2的去除速率上升.
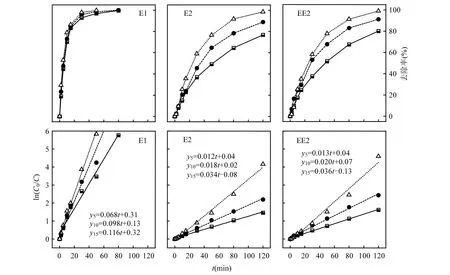
图3 不同H2O2投加量条件下UV/H2O2系统中类固醇雌激素的去除效果及一级反应动力学拟合曲线Fig.3 Steroid estrogens degradation by UV irradiation and first order kinetic models under different H2O2 dosages

2.3 UV/H2O2/TiO2体系中E1,E2和EE2的竞争 降解
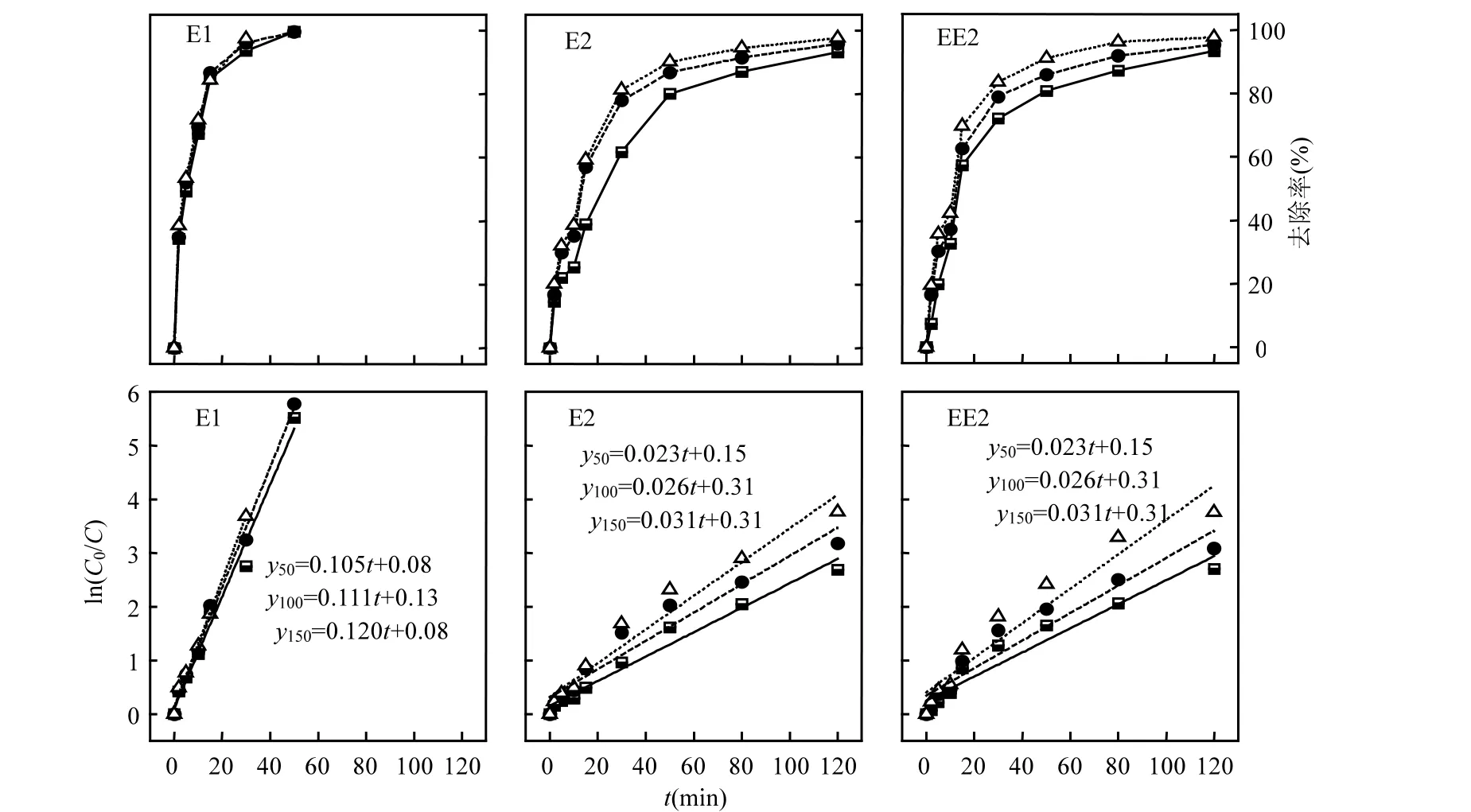
图4 不同浓度TiO2存在条件下UV/H2O2/TiO2系统中类固醇雌激素的去除效果及一级反应动力学拟合曲线Fig.4 Steroid estrogens degradations and first order kinetic models for UV/H2O2/TiO2 process under different TiO2 dosages
UV/H2O2/TiO2体系中(图 4),E1、E2和 EE2的去除率得到进一步提升,E1的去除率和降解速率常数最高.在TiO2浓度50mg/L的条件下,反应50min时E1基本降解,E2和EE2的去除率分别为 80.2%和 80.8%,均优于单纯 UV及 UV/H2O2工艺;TiO2浓度增加到150mg/L,反应50min时E1去除率低于检测限,E2和 EE2的去除率分别为90.1%和91.0%.投加TiO2缩小了3种物质的竞争差距,原因在于该系统中,E1,E2和EE2的降解主要为高效的光催化降解过程,TiO2在受到紫外光照射时价带电子被激发到导带并在价带生成电子空穴(h+),电子空穴会在半导体表面生成具有极强氧化能力的·OH氧化有机污染物[36].此外,有文献[37]报道,当TiO2存在时,E2光解性能会增强,导致其离解能的降低.上述 2方面的促进作用也是本试验中 3种类固醇雌激素降解竞争弱化的原因.
2.4 UV联用工艺中相关因素对类固醇类雌激素降解速率的影响
UV辐照降解E1,E2和EE2的过程中,光强、H2O2和催化剂TiO2的投加均会影响物质的降解速率.由图5可见,光强、H2O2和催化剂TiO2对3种物质降解速率的影响最大的为H2O2,其次是光强,TiO2的影响权重最小.
2.5 3种类固醇类雌激素的同趋降解
在UV体系降解E1,E2和EE2的过程中,发现3种物质均可产生保留时间为9.24min的液相色谱峰,可见 3种类固醇雌激素的光化学降解过程存在类似的转化趋势.3种物质的同趋转化主要是由于它们具有相似的结构及一定的因果关联,如氧化等过程中E2的降解产物为E1[38].为进一步考察降解产物,在 UV/H2O2系统中分别对 3种单一原物质的进行降解,0~30min原物质及降解产物色谱图见图6.
E1的特征离子为 268.8、338.9、339.9和259.9,E1光降解副产物X的特征离子为268.9、269.9、364.5和314.7.类固醇雌激素属于芳香性较强的化合物,由于共轭体系较大分子断键耗能大,因此质谱分析中最强的分子离子峰为基峰(268.9)[39].对比E1和产物X的基峰及特征离子可见二者结构非常相似.Caupos等[40]指出,当水中不存在DOC时,紫外光降解E1只会生成一种唯一的副产物 P1,且该副产物保留时间高于 E1,通过对该副产物的GC-MS、LC-MS、LC-MS2、LC-MS3对比分析指出该副产物 P1很有可能是E1的同分异构体,并推测其结构式见图7.Trudeau等[41]发现在UV-B的照射下,E1会生成一种光降解衍生物,并通过 NMR分析认为这种衍生物为E1的13α-差向异构体(13α-epimer)Lumi雌酮,其结构式见图7.Whidbey等[31]在此基础上继续研究,认为由E1向LumiE1的转换率为53%,且通过YES检测认为其有一定的雌效应但强度小于 E1,E1最重要的变化是其结构上的甲基发生了变化.
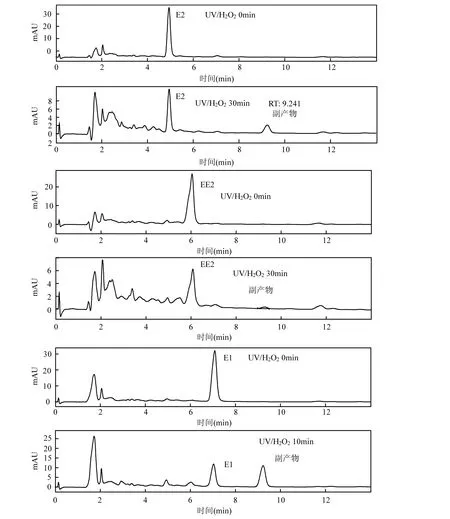
图6 UV/H2O2体系中3种降解类固醇雌激素及可能的降解产物X液相色谱图Fig.6 HPLC chromatogram of steroid estrogens and their possible byproduct X in UV/H2O2

图7 3种降解类固醇雌激素降解产物X质谱图及可能的化学结构Fig.7 Mass chromatogram and structure of byproduct X of steroid estrogens
3 结论
3.1 水环境中 3种微量共存类固醇类雌激素E1,E2和EE2在UV及投加H2O2和催化剂TiO2的 UV系统中的混合降解符合一级动力学模型,E1在竞争降解中处于优势地位,E2和EE2的降解效果相差不大.
3.2 UV系统中,H2O2和催化剂TiO2的投加可提高共存E1,E2和EE2的降解效果及降解速率常数,缩小E1,E2和EE2竞争降解差距.
3.3 E1,E2和EE2的光化学降解过程可产生相同的副产物,副产物与E1结构类似,具有光敏性,可推测3种物质在水环境中的归趋具有相似性.
[1]Hanselman T A, Graetz D A, Wilkie A C.Manure-borne estrogens as potential environmental contaminants:a review [J].Environmental Science and Technology, 2003,37(24):5471-5478.
[2]Maelle C, Daniel P, Asmaa M S,et al.Assessment of river contamination by estrogenic compounds in paris area [J].Science of the Total Environment, 2004,324(1-3)55-66.
[3]Ying G G, Kookaana R S, Ru Y J.Occurrence and fate of hormone steroids in the environment [J].Environent International,2002,28(6):545-551.
[4]Woodruff T J.Bridging epidemiology and model organisms to increase understanding of endocrine disrupting chemicals and human health effects [J].Journal of Steroid and Molecular biology, 2011,127(1/2):108-117
[5]吴世闽,贾 瑷,彭 辉,等.辽东湾海水中甾体雌激素的检测及生态风险评价 [J].中国环境科学, 2011,31(11):1904-1909.
[6]Desbrow C, Routledge J, Brighty C, et al.Identification of estrogenic chemicals in STW effluent:1.chemical fractionation and in vitro biological screening [J].Environmental Science and Technology, 1998,32(11):1549-1558.
[7]Zhang X, Chen P Y, Wu F, et al.Degradation of 17α-ethinylestradiol in aqueous solution by ozonation [J].Journal of Hazard Materials, 2006,133(1-3):291-298.
[8]Fukuhara T, Iwasaki S, Kawashima M, et al.Adsorbability of estrone and 17β-estradiol in water onto activated carbon [J].Water Research, 2006,40(2):241-248.
[9]Nie Y F, Qiang Z M, Zhang H Q, et al.Fate and seasonal variation of endocrine-disrupting chemicals in a sewage treatment plant with A/A/O process [J].Separation and Purification Technology, 2012,84(9):9-15.
[10]邵晓玲,马 军,文 刚.松花江流域某自来水厂中内分泌干扰物的研究调查 [J].环境科学, 2008,378(3):352-365.
[11]常 红,胡建英,邵 兵,等.固相萃取-LC-MS 法检测水中痕量雌激素 [J].环境科学, 2003,22(4):400-403.
[12]Kuch B, Kern F, Metzger J W, et al.Effect-related monitoring:estrogen-like substances in groundwater [J].Environ Sci Pollut Res, 2010,17(2):250-260.
[13]Lu G H, Song W T, Wang C, et al.Assessment of in vivo estrogenic response and the identification of environmental estrogens in the Yangtze River (Nanjing section) [J].Chemosphere, 2010,80(9):982-990.
[14]Chen C Y, Wen T Y, Wang G S.Determining estrogenic steroids in Taipei waters and removal in drinking water treatment using high-flow solid-phase extraction and liquid chromatography/tandem mass spectrometry [J].Science of the Total Environment,2007,378(3):352-365.
[15]郑唯韡,王 霞,田大军,等.固相萃取-气质联用法检测上海市不同水厂各处理工艺环节水中几种除草剂、杀菌剂和雌激素水平[J].中华预防医学杂志, 2010,44(10):899-902.
[16]Khanal S K, Xie B, Thompson M L, et al.Fate, transport, and biodegradation of natural estrogens in the environment and engineered systems [J].Environmental Science and Technology,2006,40(21):6537-6546.
[17]Hansen P D.Risk assessment of emerging contaminants in aquatic systems [J].Trends in Analytical Chemistry, 2007,26(11):1095-1099.
[18]宋文婷,陆光华,李湘鸣,等.长江(南京段)环境雌激素的污染特征 [J].生态环境学报, 2009,18(5):1615-1619.
[19]李青松,高乃云,马晓雁,等.上海市原水及地表水中 SEs调查及风险评估 [J].中国给水排水, 2013,29(15):146-149.
[20]金 涛,吕学敏,曾一凡,等.江苏某地长江、太湖水源水及出厂水中有机物雌激素活性的比较 [J].环境科学, 2013,34(4):1351-1356.
[21]李青松,高乃云,马晓雁,等.南方某水厂处理工艺过程中甾体雌激素的变化规律 [J].四川环境, 2011,30(3):1-4.
[22]Zhou J L, Liu R, Wilding A, et al.Sorption of selected endocrine disrupting chemicals to different aquatic colloids [J].Environmental Science and Technology, 2007,41(1):206-213.
[23]Yeomin Y, Paul W, Shane S A, et al.Removal of endocrine disrupting compounds and pharmaceuticals by nanofiltration and ultrafiltration membranes [J].Desalination, 2007,202(1-3):16-23.
[24]Afzala A, Drzewicza P, Martinb J W, et al.Decomposition of cyclohexanoic acid by the UV/H2O2process under various conditions [J].Science of the Total Environment, 2012,426(1):387-392.
[25]Aleboyeh A, Kasiri M B, Aleboyeh H.Influence of dyeing auxiliaries on AB74dye degradation by UV/H2O2process [J].Journal of Environmental Management, 2012,113(30):426-431.
[26]李青松,高乃云,马晓雁,等.UV/H2O2工艺降解水中 17α-乙炔基雌二醇 [J].中国环境科学, 2006,26(5):515-518.
[27]Mazellier P, Méité L, De Laat J, Photodegradation of the steroid hormones 17β-estradiol (E2) and 17α-ethinylestradiol (EE2) in dilute aqueous solution [J].Chemosphere, 2008,73(8):1216-1223.
[28]Liu B, Liu X L, Direct photolysis of estrogens in aqueous solutions [J].Science of the Total Environment, 2004,320(2/3):269-274.
[29]高乃云,严 敏,赵建夫,等.水中内分泌干扰物处理技术与原理[M].北京:中国建筑工业出版社, 2010:208.
[30]刘 超,强志民,张 涛,等.紫外光和基于紫外光的高级氧化工艺降解农药的研究进展 [J].环境科学学报, 2011,31(2):225-235.
[31]Whidbey C M, Daumit K E, Nguyen T H, et al.Photochemical induced changes of in vitro estrogenic activity of steroid hormones [J].Water Research, 2012,46(16):5287-5296.
[32]邓南圣,吴 峰.环境光化学 [M]北京.化学工业出版社, 2003:296-303.
[33]Liu Z H, Kanjo Y, Mizutani S S.Removal mechanism for endocrine disrupting compounds (EDCs) in wastewater treatment-physical means, biodegradation, and chemical advanced oxidation: A review [J].Science of the Total Environmen, 2009,407(2):731-748.
[34]黎 雷,高乃云,胡 玲,等.阴离子对 UV/H2O2/微曝气工艺降解双酚A的影响 [J].中国环境科学, 2008,28(3):233-236.
[35]徐 涛,肖贤明,刘红英.UV/H2O2光化降解水中邻二氯苯的反应机理 [J].中国环境科学, 2004,24(5):547-551.
[36]Zhang Y, Zhou J L, Ning B.Photodegradation of estrone and 17β-estradiol in water [J].Water Research, 2007,41(1):19-26.
[37]Layton A C, Gregory B W, Seward J R, et al.Mineralization of steroidal hormones by biosolids in wastewater treatment systems in Tennessee USA [J].Environmental Science and Technology,2000,34(18):3925-3931.
[38]Alum A, Yoon Y, Westerhoff P, et al.Oxidation of bisphenol A,17β-estradiol, and 17α-ethynyl estradiol and byproduct estrogenicity [J].Environmental Toxicology, 2004,19(3):257-264.
[39]丛浦珠.质谱学在天然有机化学中的应用 [M].北京:科学出版社, 1987:22-25.
[40]Caupos E, Mazellier P, Croue J P.Photodegradation of estrone enhanced by dissolved organic matter under simulated sunlight [J].Water research, 2011,45(11):3341-3350.
[41]Trudeau V L, Heyne B, Blais J M, et al.Lumiestrone is photochemically derived from estrone and may be released to the environment without detection [J].Frontiers in Endocrinology,2011,2:83.

