shRNA-PTTG对A549肺癌细胞株生物学功能的影响
张泳 王建华 李迎春
shRNA-PTTG对A549肺癌细胞株生物学功能的影响
张泳 王建华 李迎春
目的 探讨shRNA-PTTG对肺癌A549细胞生物学功能的影响。方法 采用shRNA技术沉默PTTG蛋白的表达,使用western blot与RT-PCR检测沉默效率,使用western blot检测沉默PTTG后VEGF蛋白的表达影响,使用MTT检测细胞增殖,使用流式细胞仪检测周期。结果 western blot与PCR结果显示shRNA成功沉默PTTG蛋白的表达,且VEGF表达明显下降,MTT结果显示沉默PTTG后,细胞生长明显收到抑制,流式细胞仪结果显示,沉默PTTG后G2-M期明显延缓。结论 PTTG基因具有促进肺癌A549细胞株增殖的作用,且可能是通过VEGF而发挥作用。
PTTG;VEGF;肺癌;增殖
肺癌是当今世界上对人类健康与生命危害最大的恶性肿瘤之一。世界上许多国家和地区肺癌的发病率和死亡率都有所增加,今后30年内肺癌将成为中国居民的主要死亡原因[1]。目前,肺癌患者的5年生存率为10%[2],非小细胞肺癌早期确诊手术切除率低,对放化疗均不太敏感,因此针对该肿瘤的生物学和基因疗法尤为重要。研究PTTG在肺癌中的表达对于进一步了解非小细胞肺癌的发生、浸润和转移机制,探讨新的有效治疗方法具有重要意义。
1 资料与方法
1.1 一般资料 小量质粒提取试剂盒为中鼎试剂公司产品。Lipofectamine2000购自Invitrogen公司。编码针对PTTG的shRNA由上海吉玛生物工程技术有限公司合成。RNA提取试剂盒及RT-PCR试剂盒为TaKaRa公司产品。一抗分别为兔抗人PTTG抗体,兔抗人VEGF抗体,B-actin抗体购自博奥森生物工程有限公司,二抗为辣根过氧化物酶标记的羊抗兔抗体为北京中山金桥。
1.2 细胞培养与转染 人肺癌细胞株A549(上海细胞生物学研究所),采用DMEM培养基、10%胎牛血清、37℃、5%CO,的条件下培养。针对人PTTG的shRNA质粒的构建委托上海吉玛生物有限公司合成确定三条shRNA-PTTG以及一条NC对照组。严格按照lipofectamine2000(Invitrogen公司)试剂说明说进行细胞的转染,取对数生长期的细胞,接种于6孔板或96孔板内,待细胞达到85%~90%的融合,按照质粒:转染试剂比例为4μg∶6μL分别加入质粒与转染试剂进行细胞转染,6h后换上新鲜的培养液,24h后查看转染效率,转染48h后进行后续检测。
1.3 western blot检测VEGF蛋白表达 取转染效率达较高的细胞,提取细胞蛋白,定量,置于-20%保存,每样品取15μL加入等体积loading buffer,于聚丙烯酰胺凝胶电泳分离蛋白,浓缩胶电压80V,分离胶电压120V,电泳时间约1h。半干转移法,恒流转移2h;电转移后的PVDF膜用依次进行脱脂奶粉封闭,在一抗四度过夜(PTTG与VEGF稀释比例为
1∶200和1∶100),PBST溶液洗膜,二抗室温孵育2h(稀释比例为1∶1000),暗房中用ECL溶液显色,压片,显影。
1.4 RT-PCR检测PTTG mRNA表达 根据PTTG序列在Qiagen公司设计其特异性引物,收集转染48h后的A549肺癌细胞,按Trizol操作说明书提取细胞总RNA,按照RT—PCR试剂盒说明书检测PTT GmRNA含量。取PCR产物进行琼脂糖凝胶电泳检测,凝胶成像系统扫描鉴定。
1.5 MTT测细胞增殖 将实验共分为5组,无质粒阴性对照组,PTTG-shRNA-NC,PTTG-shRNA-1,PTTG-shRNA-2,PTTG-shRNA,3,每组设置5复孔,每孔5×103个细胞接种于96孔培养板中。培养24,48,72h后每孔加入0.5g/L的MTT,孵育4h后,每孔加入150μL二甲基亚砜(DMSO)溶解结晶,选择波长490nm吸光度读取数值,时间为横轴,吸光度值为纵轴绘制细胞生长曲线。重复3次。
1.6 流式细胞仪检测细胞周期 A549细胞转染48h候,取
2×106个细胞,PBS洗涤,70%冰乙醇固定,加入500μg/mL的碘化丙啶(PI)和10mg/mLRNA酶A,37℃避光染色30min,流式细胞仪检测,分别计算出G0/G1期、S期细胞所占的百分比。每组重复实验3次。
1.7 统计学方法 所有数据采用SPSS18.0统计学软件进行处理,正态计量资料采用t检验分析RT-PCR、westemblot,P<0.05为差异有统计学意义。
2 结果
2.1 shRNA-PTTG在体外A549细胞中可以明显降低PTTG蛋白与VEGF蛋白的表达 RT-PCR检测后发现
shRNA-PTTG-1,shRNA-PTTG-2,shRNA-PTTG-3转染组中PTTG 蛋白的表达明显低于对照组,差异有统计学意义(P<0.05,见图1);western blot检测后发现shRNAPTTG-1,shRNA-PTTG-2,shRNA-PTTG-3转染组中PTTG蛋白的表达明显低于对照组,差异有统计学意义(P<0.05,见图2)。表明构建的shRNA-PTTG质粒成功,可有效降低PTTG在肺癌A549细胞中mRNA水平与蛋白水平的表达。而PTTG被沉默后其靶基因VEGF蛋白的表达明显下降。提示PTTG可能是通过VEGF而发挥作用(见图1)。

图1 sh-RNA-PTTG对A549细胞内PTTG蛋白以及VEGF蛋白的影响
2.2 shRNA-PTTG对肺癌细胞株A549细胞增殖的影响MTT结果显示shRNA-PTTG-1,-2,-3组A549肺癌细胞增殖与对照组相比明显降低,细胞生长明显收到抑制,差异有统计学意义(P<0.05,见图2)。

图2 shRNA-PTTG对AS49细胞增值的影响
2.3 shRNA-PTTG对细胞周期的影响 流式细胞仪结果显示shRNA-PTTG组A549肺癌细胞与其对照组相比G2-M明显延缓,且差异具有统计学意义,而S期与G0-G1未见显著差异(见表1)。
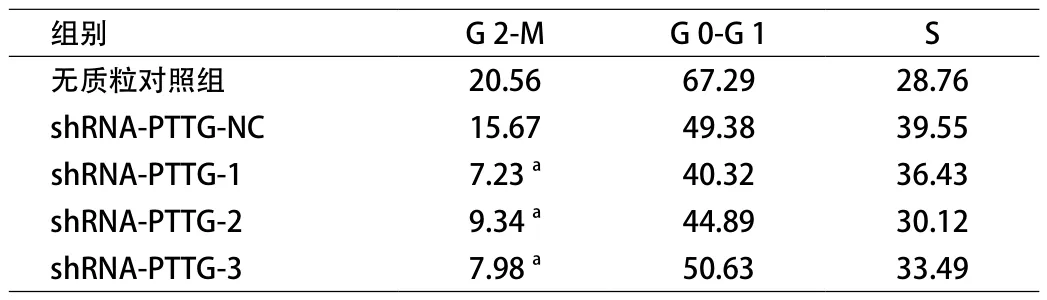
表1 shRNA-PTTG对细胞周期的影响
3 讨论
PTTG是Pei[3]等于1997年采用PCR方法分离出的一种新型原癌基因。该课题组将转染PTTG基因的成纤维细胞种植于无胸腺裸鼠皮下后,发现其于3周后形成肿瘤,因而将这一基因定名为垂体瘤转化基因。在随后的研究中,Zhang[4]等发现PTTG基因(hPTTG)定位于染色体的5q33区,并且含有603个碱基对组成的开放阅读框,编码产生一个26KD的蛋白。随着越来越多的基因研究发现,PTTG在人类多种恶性肿瘤的发生发展中发挥着重要的作用。
肿瘤是一种细胞周期,凋亡等因素发生紊乱的一种恶性程度极高的疾病,其根本原因在于细胞的正性因子表达增强或负性因子表达减弱,导致细胞过度生长、分裂,出现细胞生长失控。新近研究表明PTTG可能为一种肿瘤转化基因,它可以通过多条途径而诱导肿瘤的发生、发展,并且这种作用在没有其他基因辅助时也存在,可能单独发挥作用[5]。研究发现,PTTG具有刺激细胞有丝分裂因子和血管生长因子的分泌与表达,从而可以通过促进血管的生成而促进肿瘤细胞的增殖作用。Zhang等[4]在研究垂体腺瘤时发现PTTG mRNA表达水平显著升高,且其在分泌型肿瘤中,侵犯蝶窦者PTTG表达水平明显高于未侵犯者。更有研究报道[6-7],在112例垂体瘤标本的检测中发现PTTG与VEGF的mRNA水平和PTTG,VEGF蛋白水平以及KDF/ FIK-I mRNA及其蛋白在垂体肿瘤中的表达量明显高于其在正常垂体组织的表达。碱性成纤维细胞生长因子(bFGF)和血管内皮生长因子(VEGF)是调节血管生成的重要因子Heaney等[8]在表达小鼠的GH细胞中发现bFGF的表达水平在24h内增加了240%,并且PTTG mRNA与bFGF的最高水平同时出现,而加入bFGF抗体时,PTrG mRNA的水平又降低了。这似乎表明PTI'G和bFGF之间存在正反馈的调节机制。而本研究中发现在沉默PTTG后其A549肺癌细胞株中的VEGF表达亦降低[9]。更提示了PTTG基因可能调节血管生成生长因子的表达,从而扰乱肿瘤组织及其间质内的血管生成平衡,启动血管生成机制,促进肿瘤的生长和侵袭等。随着研究的深入,在转染PTI'G的人胚肾细胞、子宫平滑肌瘤、甲状腺癌等中发现FGF、VEGF的水平与PTTG呈剂量依赖性增高[10]。
MTT实验结果显示,在PTTG基因沉默后,A549细胞生长和存活能力受到明显的影响,细胞活力产生了巨大的交化。这可能是由于PTTG激活脯氨酸的增殖基因C-myc,而其在调控细胞的增生中发挥着关键作用。在酵母和哺乳动物细胞中,PTTG表达蛋白与异源性DNA结合区融合后,其酸性羧基末端具有反式激活作用。蛋白激酶级联的活化可增强PTTG蛋自反式作用。而MAPK又可通过51-54氨基酸间的SH3结合位点与PTTG直接作用。MAPK磷酸化及MEKI与PTTG相互作用不仅能增强PTTG反式激活功能,也能促进PTTG表达蛋自移位于核内激活原癌基因生长因子从而促进肿瘤生长[11]。
综上所述,沉默PTTG基因在A549肺癌细胞中的表达后其下游基因VEGF的表达明显下降,A549肺癌细胞株的增殖明显收到抑制,且使A549肺癌细胞停滞在G2-M期,从而达到抑制肿瘤细胞生长的作用。
[1] 李连第,鲁凤珠,张思维,等.中国恶性肿瘤死亡率20年变化趋势和近期预测分析[J].中华肿瘤杂志,1997,19(1):3.
[2] 美国胸科医师学会.肺癌诊疗指南[J].Chest,2008,123:19.
[3] Pei L,Melmed S.Isolation and characterization of a pituitary tumor transforming gene(PTTG)[J].MolEndocrinol,1997,11(4):433-441.
[4] Zhang X,Horwitz GA,Prezant TR,et a1.Structure expression and functionof human pituitary tumor-transforming gene(PTTG)[J].Mol End ocrinol,1999,13(1):156-166.
[5] Lewy GD,Ryan GA,Read ML,et al.Regulation of Pituitary Tumor Transforming Gene(PTTG) expression and phosphorylation in thyroid cells[J].Endocrinology,2013,18:234-256.
[6] Mccabe CJ,Khaira J S,Boelaert K,et a1.Expression of pituitary turnout transforming gene(PTTG) and fibroblast growth factor-2(FGF2) in human pituitary adenomas:relationships toclinicalt1.Krnour behavior[J].Clin End ocrinol (Oxf),2003,58(2):141-150.
[7] Davis JR,Mc Neilly AS.Is pituitary gene the rapy realistic[J].Clin Endocrin01,200l,55(4):427-433.
[8] Eaney AP,Horwitz GA,Wang Z,et a1.Early involvement of estrogen induced pituitary tumor transforming gene and fibroblast growth factor expression in prolactinoma pathogenesis[J].Nat Med,1999,5(11):1317-1321.
[9] Shikawa H,Heaney AP,Yu R,et a1.Human pituitary tumor-transforming gene induces angiogenesis[J].J Clin Endocrinol Metab,2001,86(2):867-874. [10] Hamid T,Malik MT,Kakar SS.Ectopic expression of PTTG/securing promotes tumorigenesis in Human embryonic kidney cells[J].Mol Cancer,2005,4(1):3. [11] Pei L.Activation of mitogen-antivated protein kinase cascade regulates pituitary rumor-transforming gene transacfivation function[J].J Biol Chem,2000,275(40):31191-31198.
Objective To explore the biological functions of shRNA - PTTG on A549 lung cancer cell. Methods The shRNA technology used to silence the expression of PTTG protein,and then using western blot and rt-pcr detection efficiency; The western blot was also used to detect the expression of VEGF protein after PTTG silenced. MTT was used to detect cell proliferation and using flow cytometry instrument testing cycle. Results Western blot and PCR showed that shRNA success silence the expression of PTTG protein and the expression of VEGF was decreased obviously. MTT and flow cytometry results showed that A549 cell growth is suppressed obviously and G2 -m period significantly down shifting after PTTG silence. Conclusion PTTG gene can promote the proliferation of A549 cell lines, and VEGF may be play a role in this procession.
PTTG; VEGF; Lung cancer; Proliferation
10.3969/j.issn.1009-4393.2014.20.001
陕西省教育厅专项科研项目(2010JK505)
陕西 712000 陕西中医学院附属医院外三科 (张泳 王建华)710054 解放军323医院护理部(李迎春)

