UV-C对西兰花抗氧化活性及相关品质的影响
张怡,关文强,张娜,刘莉莉,阎瑞香,孙德岭
(1.天津农学院农学系,生物技术实验室,天津300384;2.天津商业大学,天津300134;3.国家农产品保鲜工程技术研究中心,天津市采后生理与贮藏保鲜重点实验室,天津300384;4.天津科润蔬菜研究所,天津300382)
近年来,随着抗衰老、抗氧化研究的不断深入,对于保持人们身体健康的功能性食品的研究报道也越来越多,其中果蔬的抗氧化成分及其抗氧化活性的研究倍受瞩目。有关天然物质抗氧作用的研究较多,但因其含量较低,价格过高,提取工艺复杂,在实际应用中还比较少[1]。国内外许多相关报道提及,西兰花是一种营养丰富、热量较低、高抗氧化功效的营养功能食品。但西兰花含水量高,营养丰富,极易腐烂变质。由于运输和销售过程中贮藏条件变化造成菜花褐变、腐烂、损伤以及花球松散的情况,不但不能体现其应有的商品价值,而且会带来巨大的损失。
随着西兰花市场需求逐步加大,其采后保鲜研究开始被人重视起来。短波紫外线(波长小于280 nm的紫外线,简称UV-C)照射便是其中一种有效可行的方法。根据相关报道指出,低剂量短波紫外线照射在控制水蜜桃、番茄、草莓、鸭梨、芦柑、冬枣等[2-7]果蔬病害上表现出较好的效果。UV-C处理是一种无化学污染的物理处理方法,可减少化学保鲜剂的应用,是一条绿色环保的贮藏保鲜途径[8]。UV-C照射可诱导植物提高抗病性,减小果蔬采后腐烂率,但对其作用机制还缺乏深入的了解[3]。研究表明,利用UV-C处理后,水蜜桃能推迟果实呼吸高峰出现,降低峰值,减缓果实软化,控制PPO酶活性;1 kJ/m2UV-C在保持果实可溶性固形物含量的同时,也将MDA值控制在较低的水平,表现出更突出的常温保鲜效果[2]。由于不同种类及品种果蔬对UV-C照射反应应答表现各不相同,因此本实验以西兰花为试材,研究不同剂量UV-C照射对其抗氧化活性及品质指标变化的影响,从而筛选最佳照射剂量,为UV-C照射对采后贮藏保鲜研究提供理论依据。
1 材料与方法
1.1 材料及处理方法
实验西兰花采自天津武清区农户菜田。对西兰花分别进行CK、1、4、7 kJ/m2UV-C照射处理,照射时间分别为 0、150、600、1 050 s。每个处理两个重复,每个重复3个果实。处理后放入0.03 mm聚乙烯PE保鲜袋中,敞口入冷库预冷6 h~8 h后扎口贮藏。每7 d测一次抗氧化活性及相关品质指标。分析测验部分为西兰花茎部生长结以上部分。
1.2 药品及仪器
粉碎机:SQ2002西贝乐多功能食品加工机;冷冻离心机:德国D-37520型;紫外线强度计:ZQJ-254型,上海顾村电光仪器厂购得。
DPPH:二苯代苦味酰肼自由基(2,2-Diphenyl-1-picrylhydrazyl),美国SIGMA公司购得。
1.3 测定项目与方法
1.3.1 抗氧化活性测定
采用DPPH法[9]并进行改进。称取5 g西兰花,加50 mL 50%乙醇粉碎匀浆1 min,置于离心管中4℃冷冻离心10 min(15 000 r)后过滤,取上清液。制取浓度为2×10-4mol/L的DPPH稀释液。利用DPPH溶液的特征紫红色团的吸收,用紫外分光光度法在波长517 nm处吸收的下降表示对提取液的有机自由基消除能力。按表1加反应液。

表1 加DPPH方法Table 1 Adding method of DPPH
测定其吸光度值后,计算出DPPH的清除率,计算公式如下:
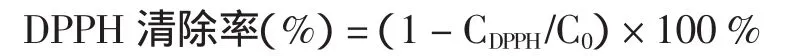
式中:CDPPH为自由基清除过程中某一时刻DPPH的摩尔浓度,C0为DPPH的原始摩尔浓度。
单位质量的果蔬样品对DPPH的实际清除量的计算公式如下:
DPPH实际清除量(mg/g)=(DPPH 清除率×反应加入的DPPH量)/样品质量
1.3.2 叶绿素和类胡萝卜素含量的测定
参考崔勤等运用的分光光度法[10]。称取剪碎混匀的西兰花1 g,加入体积分数为95%乙醇研磨并定容至25 mL,以体积分数为95%乙醇为空白,分别在波长665、649和470 nm下测定吸光度。计算公式如下
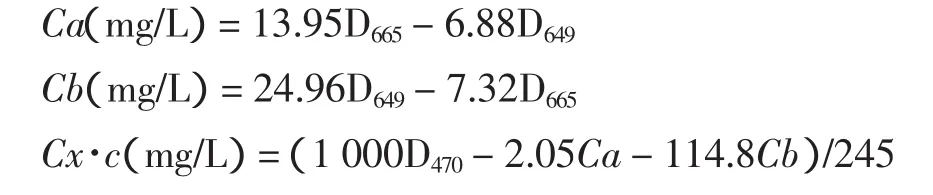
式中:Ca、Cb分别为叶绿素 a和 b的浓度;Cx·c为类胡萝卜素的浓度;叶绿素a、b在95%乙醇中最大吸收峰的波长分别为665和649 nm,类胡萝卜素为470 nm。
1.3.3 总酚含量的测定
采用Folin-Ciocalteu法[11]并略有改进。称取5g西兰花,加入50 mL 75%的甲醇溶液匀浆,在55℃下密封水浴浸提3h,放入离心管中冷冻离心10min(15000r),取上清液。新制取的Folin-Ciocalteu试剂1 mL,加入0.5 mL上清液后,再加3.5 mL去离子水,混匀,然后加入3 mL Na2CO3溶液(20%)。室温下静置2 h。用紫外可见分光光度计,在波长765 nm处测定吸光度值,以焦性没石子酸做标准曲线计算样品总酚含量。
1.3.4 维生素C含量的测定
采用碘液滴定法[12]。称取10 g西兰花,加入适量1%草酸匀浆,然后移入250 mL容量瓶中,用1%草酸定容至刻度。脱脂棉过滤后取20 mL滤液,并加入1 mL质量分数为1%淀粉和20 mL质量分数为1%草酸,用已知浓度的碘液滴定并计算VC含量。
1.3.5 类黄酮含量的测定
根据NaNO2—Al(NO3)3比色法[13]对类黄酮含量进行测定。称取西兰花5 g,加入50 mL 70%乙醇匀浆,密封放置于65℃的水浴锅中,浸泡提取1.5 h,再放入离心管中冷冻离心10 min(15 000 r),取上清液。吸取1 mL上清液于10 mL试管中,加70%乙醇1 mL,加入0.3 mL 5%的NaNO2,混合后放置6 min,然后加入0.3 mL 10%的Al(NO3)3溶液,摇匀后放置6 min,最后再加入2 mL 4%NaOH摇匀,放置10 min后在波长510 nm下测定吸光度,根据标准曲线(将芦丁标准品在120℃干燥至恒重后再制作标准曲线)并计算类黄酮含量。
1.3.6 花青素含量的测定
采用分光光度法[14],称量5 g西兰花,加人30 mL 2%盐酸甲醇溶液匀浆,置于50 mL烧杯中浸泡,杯口用封口膜扎紧以防挥发,置室温避光处浸提2 h,至肉眼观察叶组织完全变白取出过滤。用2%盐酸甲醇溶液定容至50 mL容量瓶中,用紫外可见分光光度计,在波长530 nm下测定。
1.3.7 感官分析
在整个贮藏过程中,定期从颜色、霉变、硬度等外观变化进行描述和分析。
感官总分评分标准:1—极差,不可食用;3—差,影响销售;5—一般,可看到轻微缺陷;7—好,有小缺陷,但观察起来不明显;9—极好,无任何缺陷。
颜色评分标准:1—完全变黄;3—浅黄色;5—黄绿色;7—浅绿色;9—深绿色。
腐烂评分标准:1—100%面积长毛,有霉斑;3—3/4面积长毛,有霉斑;5—1/2面积长毛,有霉斑;7—1/4面积长毛,有霉斑;9—无长毛,无霉斑。
花蕾开放度评分标准:1—100%面积花蕾开放;3—3/4花蕾开放;5—1/2花蕾开放;7—1/4花蕾开放;9—无花蕾开放。
1.4 数据分析
采用Microsoft Excel 2003对实验数据进行分析。
2 结果与分析
2.1 UV-C处理对西兰花抗氧化活性变化情况的研究UV-C处理对西兰花抗氧化活性变化情况的研究见图1。
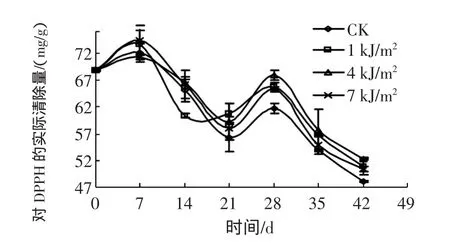
图1 UV-C处理对西兰花冷藏过程中抗氧化活性的影响Fig.1 Effect of UV-C radiation on antioxidant activity of broccoli
在图1中可以看出,西兰花由于后熟过程使其抗氧化活性先上升,后熟时间都是7 d。后熟过程中,抗氧化活性大小比较为 7 kJ/m2>1 kJ/m2>CK>4 kJ/m2。三种处理和对照组的抗氧化活性在经过7 d~14 d的降低后再一次升高。在28 d所有处理的抗氧化活性升高到最高点,其抗氧化活性大小排序为4 kJ/m2>1 kJ/m2>7 kJ/m2>CK,然后抗氧化活性又开始降低。但是在抗氧化活性降低过程中依然保持着4 kJ/m2处理是抗氧化活性最强的,其次是1 kJ/m2,次之是7 kJ/m2,最后是CK。这些说明:UV-C照射对西兰花贮藏过程中抗氧化活性有一定的促进作用。从西兰花贮藏的整个过程来看,4 kJ/m2UV-C照射增加了其抗氧化活性,可以更好地延缓西兰花的衰老。
2.2 UV-C处理对西兰花叶绿素和类胡萝卜素变化情况的研究
由于紫外辐射对叶绿素和类胡萝卜素有降解作用[15],所以大剂量的照射处理的西兰花的叶绿素及类胡萝卜素的含量是减少的。见表2所示。
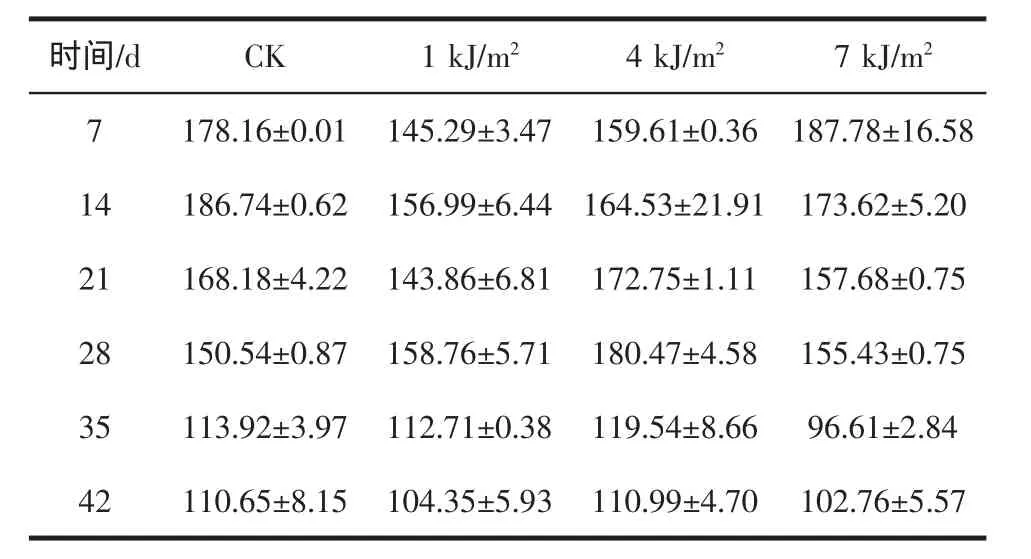
表2 a UV-C处理的西兰花叶绿素a的含量变化Table 2a Changes of chlorophyll A content of broccoli treated with UV-C
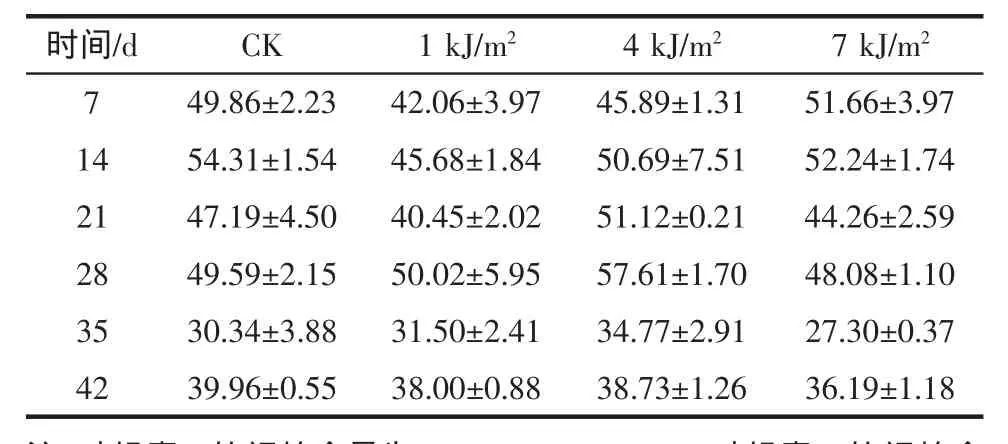
表2 b UV-C处理的西兰花叶绿素b的含量变化Table 2b Changes of chlorophyll B content of broccoli treated with UV-C
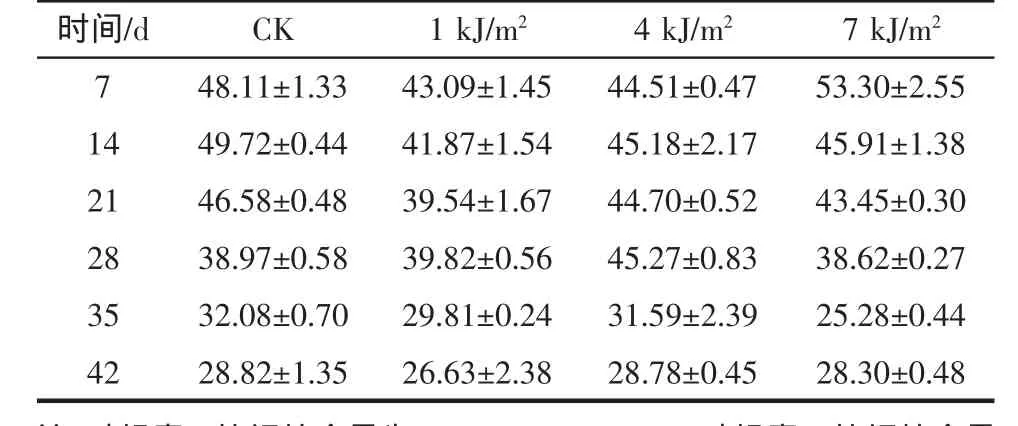
表2 cUV-C处理的西兰花类胡萝卜素的含量变化Table 2c Changes of carotenoid content of broccoli treated with UV-C
在第7 d,7 kJ/m2照射下的叶绿素和类胡萝卜素的含量高于CK,并且达到最高值。说明大剂量照射加快后熟时间。从21 d开始,4 kJ/m2照射下的叶绿素和类胡萝卜素含量高于CK。说明,在21 d以后,4 kJ/m2UV-C处理增高叶绿素和类胡萝卜素的含量,延缓其降解。
2.3 UV-C处理对西兰花总酚含量变化情况的研究
如图2所示,三种剂量的短波紫外照射都对贮藏中西兰花的总酚合成产生了一定的影响。紫外线处理使西兰花总酚含量波动性变大。在贮藏的大部分过程中,1 kJ/m2紫外线处理的西兰花的总酚含量稍高于对照组,另两种剂量处理使西兰花总酚含量大部分时间中(0 d~28 d)低于对照组,且7 kJ/m2紫外线处理的西兰花总酚含量总体上低于4 kJ/m2紫外线处理。
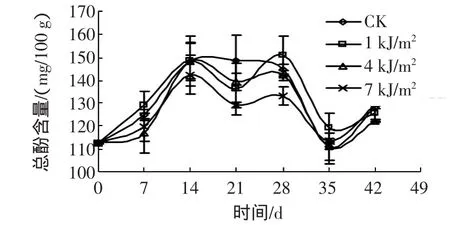
图2 UV-C处理的西兰花总酚含量变化Fig.2 Changes of total polyphenol content of broccoli treated with UV-C
2.4 UV-C处理对西兰花VC含量变化情况的研究
如图3所示,3个短波紫外照射剂量处理后的西兰花都是先增大后减小,在21 d时都达到VC含量的最大值,1 kJ/m2照射处理的西兰花VC含量略低于对照组,而稍大于4 kJ/m2和7 kJ/m2UV-C处理。在3种剂量处理中,4 kJ/m2UV-C处理效果是较好的。
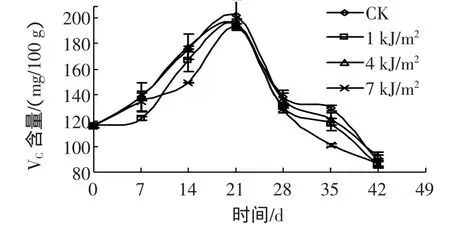
图3 UV-C处理的西兰花VC含量变化Fig.3 Changes of VCcontent of broccoli treated with UV-C
2.5 UV-C处理对西兰花类黄酮含量变化情况的研究
西兰花冷藏过程中类黄酮的变化趋势是0 d到7 d降低,到14 d升高,然后再下降至28 d后又开始上升。如图4所示。
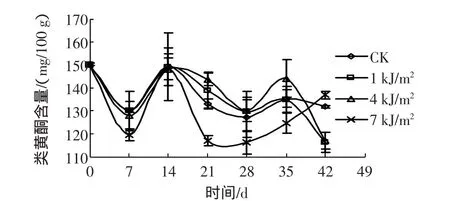
图4 UV-C处理的西兰花类黄酮含量变化Fig.4 Changes of flavonoids content of broccoli treated with UV-C
在0 d~14 d期间,随照射剂量的增大,类黄酮含量降低,其中1 kJ/m2UV-C处理与对照差异不大。第14 d时,各处理均与对照没有差异。14 d后,各剂量处理对类黄酮含量都具有一定影响,1 kJ/m2与4 kJ/m2UV-C处理的西兰花类黄酮含量略高于对照组,而7 kJ/m2UV-C处理波动性的大并且低于对照组。
2.6 UV-C处理对西兰花花青素含量变化情况的研究
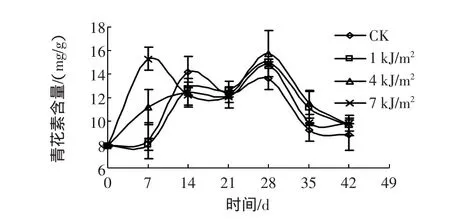
图5 UV-C处理的西兰花花青素含量变化Fig.5 Changes of anthocyanin content of broccoli treated with UV-C
从图5中可以看出,西兰花在贮藏7 d时7 kJ/m2处理的花青素含量最高。在21 d时,三种剂量和对照之间花青素含量差异不大。在21 d以后,UV-C处理的花青素含量高于对照组,其中4 kJ/m2UV-C处理的西兰花花青素含量最大。
2.7 UV-C处理的西兰花货架感官评价
由于西兰花冷藏42 d后,仍然外观良好,因此,留样贮藏至80 d时进行感官评定和货架期实验。如图3所示,贮藏80 d后,UV-C处理的西兰花感官指标明显好于对照组。说明UV-C照射能很好地保持西兰花的感官品质。在10℃5 d货架期中,4 kJ/m2UV-C照射下的西兰花各感官效果指标最高。
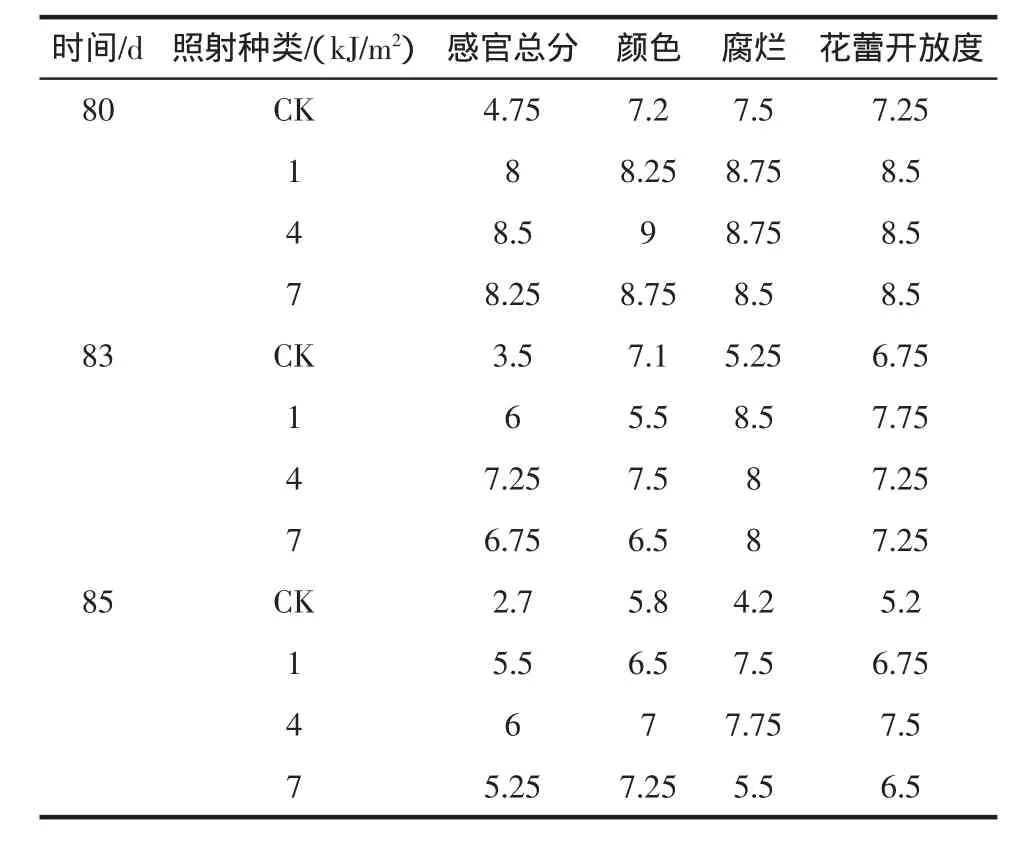
表3 UV-C处理的西兰花感官变化Table 3 Changes of sensory of broccoli treated with UV-C
3 结论
在西兰花贮藏过程中,4 kJ/m2UV-C照射增加了其抗氧化活性,可以更好地延缓西兰花的衰老。UV-C照射加大了总酚与类黄酮含量的波动性。小剂量的UV-C照射可以相对增加总酚含量。21 d时,所有处理的VC含量都达到最大值。在21天以后,4 kJ/m2UV-C处理增高西兰花的叶绿素、类胡萝卜素和花青素的含量,延缓其降解。UV-C照射能很好地保持西兰花的感官品质,减慢黄化过程,其中4 kJ/m2UV-C照射的综合感官效果最好。
[1]田迪英,杨荣华.果蔬抗氧化活性与总酚含量相关性研究[J].化学世界,2004,45(2):70-73,112
[2]陈奕兆,刚成诚,王亦佳,等.UV-C处理对水蜜桃常温保鲜效果的研究[J].天津农业科学,2012,18(4):11-14
[3]荣瑞芬,冯双庆.采后番茄果皮中抗病相关酶活性的诱导[J].北京联合大学学报:自然科学版,2003,17(3):36-39
[4]杨震峰,王吉如,王珊珊,等.短波紫外线处理对采后草莓果实腐烂和抗氧化能力的影响[J].核农学报,2012,26(5):775-780
[5]张倩,李健,曹建康,等.短波紫外线对鸭梨采后品质及抗病性的影响[J].中国农业大学学报,2009,14(2):70-74
[6]韩晓旭,刘长虹,蔡路昀,等.采后UV-C照射对芦柑抗病性和品质的影响[J].中国食品学报,2012,12(7):127-133
[7]李宁,关文强,阎瑞香.短紫外线处理对冬枣果实腐烂和品质的影响[J].北方园艺,2012(17):163-165
[8]荣瑞芬,郭堃,李京霞,等.UV-C处理采后桃防御酶活性与贮藏效果研究[J].食品科学,2007,28(8):505-509
[9]胡喜兰,韩照祥,陶莹,等.DPPH法测定17种植物的抗氧化活性[J].食品科技,2006,10(2):264-268
[10]崔勤,李新丽,翟淑芝.小麦叶片叶绿素含量测定的分光光度计法[J].安徽农业科学,2006,34(10):2063
[11]Stanislaw B,Wieslaw O,Chang Y Lee.Phenlic compound and their changes in apples during maturation and cold storage[J].J Agric Food Chem,1990,38:945-948
[12]郑京平.水果、蔬菜中维生素C含量的测定——紫外分光光度快速测定方法探讨[J].光谱实验室,2006,23(4):731-735
[13]张清明,赵卫敏,桂梅,等.贵州地方苦荞生物类黄酮含量的研究[J].种子,2008,27(7):65-66
[14]莫巍.彩叶树种叶片中花青素含量的测定及动态分析[J].新疆农业科学,2007,44(S2):138-140
[15]杨志敏,颜景义,郑有飞,等.紫外光辐射对不同条件下小麦叶片叶绿素降解作用的研究[J].西北植物学报,1995,15(4):288-293

