黑曲霉产植酸酶发酵工艺优化
李海燕,王志,2,陈雄,2,*,付刚
(1.湖北工业大学生物工程学院,湖北武汉430068;2.发酵工程教育部重点实验室,湖北武汉430068;3.潍坊盛泰药业有限公司,山东昌乐262400)
植酸酶(Phytase)是一类水解植酸的磷酸酶类,在动物、植物、微生物中均有发现,其主要来源是微生物源植酸酶。自然界有许多微生物都能产生植酸酶,如细菌、酵母和丝状真菌等,特别是曲霉菌属微生物,如黑曲霉、无花果曲霉、米曲霉等都能产生活性较高的植酸酶[1]。微生物来源的植酸酶与其他来源的相比较具有来源广、生产周期短、pH耐受范围大等优点,因而优化培养条件和工艺、进一步提高产量,成为微生物发酵产植酸酶研究的热点。
目前植酸酶在饲料中应用比较广泛,植酸酶可以降解植酸盐蛋白质络合物,提高动物对蛋白质的利用,从而减少植酸盐对微量元素的螯合,提高饲料的营养价值,另一方面可以降低粪便中的磷含量,减少环境污染[2-6]。
本文以黑曲霉为底物,利用液态发酵,探索了不同工艺条件对黑曲霉发酵产植酸酶的影响,筛选了最佳工艺条件,为大规模发酵生产廉价的植酸酶制剂奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 菌种
黑曲霉(Aspergillus niger):湖北工业大学发酵工程教育部重点实验室保藏。
1.1.2 培养基
活化培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,去离子水1 000 mL。
种子培养基:麸皮2 g,葡萄糖3 g,硫酸铵0.15 g,去离子水100 mL。
摇瓶培养基:蛋白胨1.0 g,葡萄糖60.0 g,NH4NO32.0 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·7H2O 0.01 g,MnSO40.01 g,吐温-80 2.0 mL,溶于 1 000 mL 去离子水中。
优化培养基:详见实验方法。
1.2 实验方法
1.2.1 培养方法
1.2.1.1 活化培养
将黑曲霉菌种,接种到PDA斜面培养基上,26℃下培养5 d。
1.2.1.2 种子培养
按配方配制种子培养基,在250 mL三角瓶中装100 mL,115℃灭菌30 min,从上述活化的斜面培养基上刮取几环孢子集中到种子培养液中,在30℃下,220 r/min培养36 h。
1.2.1.3 培养基优化研究
运用正交试验理论对发酵培养基进行优化,采用六因素五水平的方法,设计出如表1培养基配方。正交实验培养条件:培养基初始pH自然,接种量10%,培养温度28℃,摇床转速300 r/min。

表1 黑曲霉培养基优化正交试验方案Table 1 Medium optimization of Aspergillus niger with orthogonal experimental program
1.2.1.4 发酵条件优化研究
在上述实验中确定的最佳培养基条件下研究发酵条件。从培养基初始pH,培养温度及摇床转速3个方面做单因素实验。详细设计方案如表2所示。在发酵过程中每隔6 h取样测定植酸酶酶活力,确定最佳的发酵条件。
1.2.1.5 发酵培养
按配方配制发酵培养基,在250 mL三角瓶中装50 mL,115℃灭菌30 min,接种5 mL种子液。30℃,220 r/min摇床培养。每隔6 h取样,测总糖、酶活、pH和生物量。

表2 黑曲霉发酵条件优化单因素实验设计Table 2 Aspergillus Niger fermentation conditions optimization single factor experiment design
1.2.2 分析检测
1.2.2.1 植酸酶酶活力的测定
无机磷与钼酸铵结合,生成黄色的磷钼酸铵,再经过还原剂作用,则变为蓝色物质,在一定范围内蓝色的深浅与磷的含量成正比,可用比色法测定。利用植酸酶可以水解植酸磷释放无机磷的原理,用VC-钼蓝法测定植酸酶活[7]。
酶活力单位的定义:在上述反应条件下,每毫升酶每分钟产生1毫微摩尔无机磷的酶量为一个植酸酶活力单位(U)。
1.2.2.2 发酵液总糖含量测定
总糖测定参见文献中蒽酮比色法测定食品中总糖含量[8]。
1.2.2.3 黑曲霉生物量及发酵液酸度测定
黑曲霉生物量采用干重法计量。发酵液酸度用实验室pH计测定。
2 结果与分析
2.1 磷标曲确定
根据实验设计测定磷含量,以光密度为纵坐标,磷含量为横坐标,制作磷标准曲线如图1。

图1 磷标准曲线Fig.1 Phosphorus standard curve
根据图1的标准曲线,通过测定发酵液的OD值,可以在曲线上对应磷含量,计算出植酸酶酶活力,然后分析发酵过程中酶活力的变化趋势。
2.2 总糖标曲确定
根据实验设计测定葡萄糖含量,以光密度为纵坐标,葡萄糖含量为横坐标,制作葡萄糖标准曲线如图2。

图2 葡萄糖标准曲线Fig.2 Glucose standard curve
根据图2的标准曲线,通过测定发酵液的OD值,可以在曲线上对应葡萄糖含量。可以分析发酵过程中葡萄糖变化趋势。
2.3 发酵培养基优化
按照正交试验表进行发酵实验,在60 h时对摇瓶的植酸酶活进行测定,测定数据见表3。

表3 培养基优化实验结果与分析Table 3 Results and analysis of medium optimization experiment
由正交结果可以看出,实验12中发酵得到的植酸酶的活性最高。均值中,C源在因素3时获得最大,氮源在因素5获得最大,钾离子在因素4获得最大,亚铁离子在因素1获得最大,镁离子在因素5获得最大,锰离子在因素3获得最大。即最佳的配比为:5%可溶性淀粉,5%豆粕,0.9%KCl,0.1%FeSO4·7H2O,0.9%MgSO4·7H2O,0.5%MnSO4。根据极差可知,影响程度,MgSO4·7H2O>可溶性淀粉>豆粕>MnSO4>FeSO4·7H2O>KCl。
2.4 发酵条件优化
2.4.1 最适初始pH确定
发酵培养基的pH对植酸酶酶活力有一定的影响。一般菌体的生长pH与产酶pH不一致,因此考虑对产酶pH进行优化,其余发酵参数参见培养基优化,结果见图3。

图3 不同初始pH对酶活的影响Fig.3 Effects of different initial pH value on enzyme activity
图3 显示在5个梯度的初始pH条件下,5条产酶曲线均在发酵培养60 h时表现出最高酶活,初始pH控制在5.5时,酶活力最高,达到18.51 U。
2.4.2 最适培养温度确定
温度是保证微生物生长和产物的合成的重要因素,也是保证酶活力的重要条件。温度太低或太高都不利于菌体生长和产酶,因此发酵是必须保证稳定而合适的温度环境[9]。其余发酵条件为:初始pH为5.5,摇床转速为300 r/min。由图4可以看出,黑曲霉发酵产植酸酶的最适发酵温度为30℃,植酸酶最高酶活力为19.02 U。温度低于或者高于30℃都不利于产酶,只是因为随着温度的变化,黑曲霉的生产代谢出现加快或者滞后的状态,没有达到最佳状态而提前衰老,从而影响酶的产量。
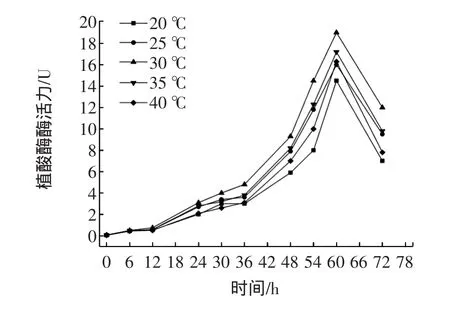
图4 不同发酵温度对酶活的影响Fig.4 Effects of different initial fermentation temperature on enzyme activity
2.4.3 最适摇床转速确定
摇床转速影响发酵过程中的溶氧,低溶氧条件对黑曲霉的生长不利,影响植酸酶的生成,转速对酶活力的影响如图5所示。
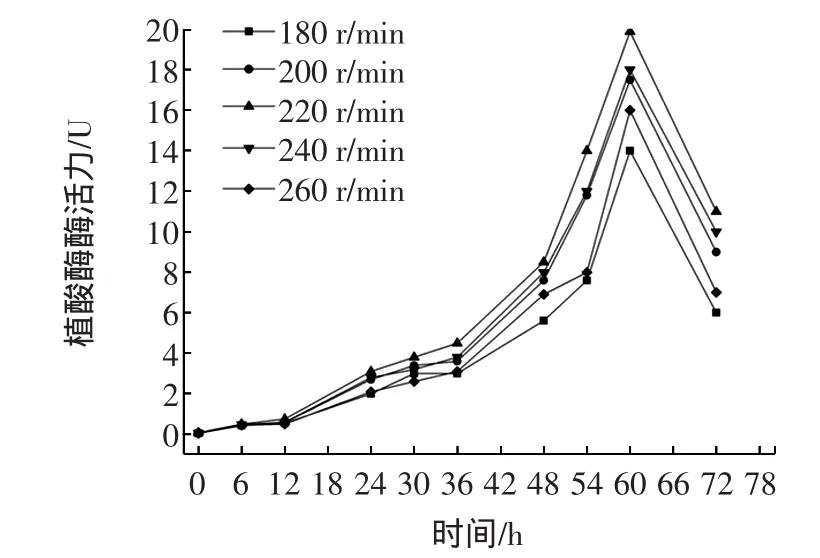
图5 不同摇床转速对酶活的影响Fig.5 Effects of different initial shaking speed on enzyme activity
随着转速的提高,黑曲霉生长比较好,植酸酶产量升高,在转速为220 r/min时达到最佳,酶活力达到了19.88 U。当超过220 r/min后,酶活力降低,表明高溶氧浓度不利于菌体的生长和酶的生成,原因可能是因为溶氧过高,发酵过程中的副产物增加,抑制了菌体的生长和酶的形成。
2.5 黑曲霉发酵产植酸酶
在优化的培养基与培养条件下,对黑曲霉的发酵过程进行监控,探索黑曲霉发酵产植酸酶过程中的总糖变化,pH变化,生物量变化以及植酸酶酶活力的变化过程。
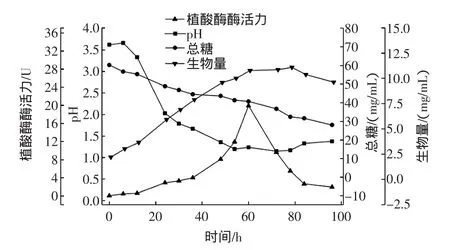
图6 黑曲霉发酵产植酸酶实验Fig.6 Aspergillus Niger fermentation production phytase experiment
由图6可知,植酸酶酶活力在60 h达到了最大值19.927 8 U,最佳发酵时间为60 h。生物量的变化展现了黑曲霉的生产过程,在60 h之前成对数生长期,菌体生长较快,60 h~78 h是稳定期,78 h后进入衰退期。黑曲霉的生长状况与植酸酶的生产以及总糖的消耗情况相吻合。黑曲霉液态发酵产生的植酸酶属于酸性植酸酶,植酸酶酶学性质另文发表。
3 小结
黑曲霉液态发酵培养基优化得出最佳配比为:5%可溶性淀粉,5% 豆粕,0.9%KCl,0.1%FeSO4·7H2O,0.9%MgSO4·7H2O,0.5%MnSO4,影响程度,MgSO4·7H2O>可溶性淀粉>豆粕>MnSO4>FeSO4·7H2O>KCl。发酵条件优化的最佳发酵时间为60 h,最适初始pH为5.5,最佳发酵温度为30℃,最佳摇床转速为220 r/min。
[1]Rudy J Wodzinskl,A H J Ullah.Phytase[J].Advances in Applled Microbiology,1996(42):263-302
[2]Lambrechts C,Boze H.Utilization of phytate by some yeast[J].Biotechnology Letters,1992,14(1):61-66
[3]Scwarz G,Hoppe P P.Phytase enzyme to curb pollution from pigs and poultry[J].Feed Magazine,1992,22-26
[4]Nagashima T,Tange T,Anazaws H.Dephosphorulation of phytate by using the Aspergillus niger phytase with a high affinity for phytate[J].Appl Environ Microbial,1999,65(10):4682-4684
[5]Mitchell D B,Vogel K,Weimann B J,et al.The phytase subfamily of histidine acid phosphatases:isolation of genes for two novel phytase from the fungi Aspergillus terreus and Myceliophthora thermophila[J].Microbiology,1997,143:245-252
[6]Haifeng Y,Xiaowen LV,Jing W,et al.Near-infrared reflectance spectroscopy based methods for phytase registration in feed industry[J].J Agri Chem,2007,55:7667-7675
[7]Heinohen J K,Lathi R J.A new and convenient colorimetric determination of inorganic orthophosphate and its application to the assay of inorganic pyrophosphatase[J].Anal Biochem 1981,113:313-317
[8]张水华.食品分析实验[M].北京:化学工业出版社,2005:43
[9]姚汝华.微生物工程工艺原理[M].广州:华南理工大学出版社,2005:194

