芒果叶不同极性部位提取物的抗氧化活性
刘刚,姜唯唯,吴京,张晓喻,*,范辉建,张宏
(1.四川师范大学生命科学学院,四川成都 610101;2.四川师范大学植物资源应用与开发研究所,四川成都610101;3.攀枝花市锐华农业开发有限责任公司,四川攀枝花 617000)
抗氧化活性与生物的抗病性、抗逆性及延缓衰老等密切相关[1],常见的癌症、动脉硬化、糖尿病、心血管病、老年痴呆、关节炎等疾病与自由基的作用相关[2-3],机体适当补充外源性抗氧剂或给予能促使机体内源性抗氧化物恢复的药物,可改善机体的正常功能[4]。
芒果(Mangifera indica L.)为漆树科植物[5],《中药大辞典》记载:芒果叶味酸、甘,性凉,行气疏滞,去痧积;治热滞腹痛、气胀;并洗烂疮;提取物有抑菌及雌性激素样作用[6]。现代临床应用表明芒果叶具有平喘止咳、免疫、抗炎、抗脂质过氧化、抗肿瘤等作用[7-8],国内外研究表明,芒果及其附属物含有黄酮类、酚类等物质,而酚类物质具有高抗氧化活性及清除自由基等生物功能[9]。Sato[10]等研究芒果苷抗氧化活性的作用机理时发现,其具有快速清除DPPH的能力。Pitchaon[11]等对芒果核仁的抗氧化性进行了研究,认为芒果核仁总酚含量高,具有最强的清除自由基的能力,产品对皮肤无刺激,可用于食品、化妆品、保健品及药物领域。Ajila[12]以芒果皮为原料进行研究,发现其提取物可抑制大豆卵磷脂氧化产物的生成,有较好的抗氧化活性。陈昱洁[13]等研究了芒果果核提取物的抗氧化活性。
目前,芒果叶提取物的抗氧化活性研究尚鲜见文献报道,且未有对DPPH自由基抗氧化的反应条件进行考察与优化的报道。本研究以攀枝花凯特芒果叶为原料,用95%乙醇冷浸提取得到浸膏,再分别用石油醚、乙酸乙酯、正丁醇依次萃取浸膏,最后剩余的部分为水提部位。本实验用DPPH法测定芒果叶各部位提取物清除自由基的能力,并对其反应条件进行考察,建立样品最优反应方法,综合评价其体外抗氧化活性。
1 材料与方法
1.1 材料与试剂
凯特芒果叶:攀枝花芒果基地,攀枝花市锐华农业开发有限责任公司;甲醇、石油醚、乙酸乙酯、正丁醇、95%乙醇、亚硝酸钠、硝酸铝、氢氧化钠均为分析纯:成都市科龙化工试剂厂;抗坏血酸(批号20120402):成都市科龙化工试剂厂;芒果苷标准品、芦丁标准品:四川省维克奇生物科技有限公司;DPPH:Sigma。
1.2 仪器与设备
UV-1700型紫外分光光度仪:SHIMADZU;Sartorius BP211D型电子天平:北京塞多利斯仪器系统有限公司;RE-52AA型旋转蒸发仪:上海亚荣生化仪器厂;KQ5200E型超声波清洗器:昆山市超声仪器有限公司;HH.W21型恒温水浴锅:北京中兴伟业仪器有限公司;BCD-518WS型冰箱:海尔集团。
1.3 方法
1.3.1 对照品溶液和DPPH溶液的制备
分别准确称取VitC标准品、芒果苷标准品5 mg和DPPH粉末7.89mg,分别用甲醇溶解后定容至25mL,得0.2 mg/mL的VitC、芒果苷溶液以及2×10-4mol/L的DPPH溶液。溶液避光,4℃保存,现配现用。
1.3.2 芒果叶不同部位提取物溶液的制备
将自然风干的芒果叶粉碎至200目的粉末,以95%乙醇为提取剂,采用冷浸法提取出浸膏;将浸膏分别用石油醚、乙酸乙酯、正丁醇进行依次萃取,每相萃取三次,每次萃取体积比为1∶1,合并萃取液,剩余部分为水部位,四组分别减压干燥浓缩,分别得到芒果叶石油醚、乙酸乙酯、正丁醇及水部位提取物。精确称取47.5 mg石油醚和35.7 mg乙酸乙酯的萃取物,用95%乙醇溶解后定容至25 mL,得浓度分别为1.90、1.43 mg/mL供试母液。再精确称取43.0 mg正丁醇和44.2 mg水部位的提取物,用甲醇溶解后定容至25 mL,得浓度分别为1.72、1.77 mg/mL供试母液,避光低温保存。
1.3.3 不同部位提取物黄酮含量的测定
1.3.3.1 标准曲线的绘制
称取10.88 mg芦丁标准品,用50%乙醇定容于50 mL 容量瓶中。分别移取标品母液 0.1、0.5、1、2、3、4、5 mL于10 mL容量瓶中,先各添加质量分数5%亚硝酸钠水溶液0.30 mL,摇匀,静置6 min;然后添加质量分数10%硝酸铝水溶液0.30 mL,摇匀,静置6 min;最后加入质量分数4%NaOH溶液4.00 mL,摇匀,用50%乙醇定容至刻度,静置12 min,于510 nm处测定其吸光度,以芦丁质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线。得回归方程:y=0.001 12x-0.004 81,R2=0.999 94。
1.3.3.2 黄酮含量的测定
精确称取11.8 mg石油醚、10.5 mg乙酸乙酯萃取物,用95%乙醇溶解定容至10mL,再精确称取12.8 mg正丁醇和13.2 mg水部位提取物,用甲醇溶解后定容至10 mL。分别精密移取不同部位提取物母液1 mL于10 mL容量瓶中,按照1.3.3.1方法在510 nm处测其吸光度值,以相应试剂为空白调零,用回归方程计算出各极性部位的黄酮含量。
1.3.4 抗氧化测定条件的考察
1.3.4.1 测定波长的选择
于190 nm~800 nm波长下,将DPPH溶液进行紫外吸收光谱扫描,结果在330、517 nm波长处有最大吸收,由于517 nm处DPPH有特殊吸收,因此选定测定波长为517 nm。
1.3.4.2 线性范围的考察
分别精密吸取 DPPH 溶液 0.5、1.0、2.0、3.0、4.0 和 5.0 mL,用甲醇稀释至10 mL,摇匀,得不同浓度DPPH溶液,以甲醇为空白,在517nm波长处测定吸光度,每个浓度三个重复。得回归方程:y=0.028 39x,R2=0.999 74。结果表明,DPPH溶液在0~41.400 mg/L的范围内有良好的线性关系。
1.3.4.3 DPPH热稳定性的考察
取2 mL DPPH溶液,加入甲醇2 mL,分别于20、30、40、50、60、70、80℃下避光水浴 30 min,测定其吸光度,每个温度设3个重复,得到热稳定性曲线图。
1.3.4.4 抗氧化温度的考察
准确量取石油醚、乙酸乙酯和正丁醇供试品母液1 mL定容至100 mL,摇匀,得稀释100倍的样品溶液;同样方法配制水部分50倍的样品溶液。取2 mL样品溶液于试管中,加入2 mL DPPH溶液分别于20、30、40、50℃避光水浴反应30 min,于517 nm波长下测定吸光度(Ai);分别精密吸取2 mL样品溶液于试管中,加入2 mL甲醇(或95%乙醇)溶液,在相同条件下测定其吸光度(Aj);Ac为不加样品溶液的空白对照组。
1.3.4.5 抗氧化时间的考察
四个部分萃取物的样品溶液配制方法同1.3.4.4,设置空白对照。每个实验组重复三次,计算各样品不同时间的清除率,分析最佳抗氧化时间。
1.3.5 清除DPPH自由基能力的测定
清除自由基的抗氧化剂能力采用清除DPPH的半数清除率,即IC50值来表示[14-15]。指将清除率(Y)对样品浓度(X)作图,求其对数函数方程,根据方程求出清除率为50%时药物的浓度,即为IC50值。IC50值越小,表明其半数清除率越高,即抗氧化剂清除自由基的能力越强[16]。
选择考察结果中抗氧化能力最佳的温度及时间,确定最佳方法,将供试品母液及对照品配制成不同浓度梯度,于517 nm下测定吸光度值。每个实验重复三次。按下列公式计算自由基的清除率:

式中:Ai为2 mL样品液+2 mL DPPH液,混合后的吸光度值;Aj为2mL样品液+2mL溶剂,混合后的吸光度值;Ac为2 mL DPPH液+2 mL溶剂,混合后的吸光度值。
1.3.6 实验设计与统计分析
按芒果叶提取部位的不同设置五个样品溶液组,同时设定“样品溶液-溶剂”和“DPPH溶液-溶剂”空白对照组两个。测得吸光度后,按公式计算各样品组的自由基清除率,依据各样品组的清除率、各样品组溶液质量浓度的梯度变化关系。用SPSS17.0中PROBIT方法进行分析,计算得到各样品组的IC50值。
2 结果与分析
2.1 芒果叶不同极性部位黄酮含量
按照1.3.3.1方法分别测定石油醚、乙酸乙酯、正丁醇和水等部位的提取物,以相应溶剂为空白,计算出各极性部位的黄酮含量,见图1。
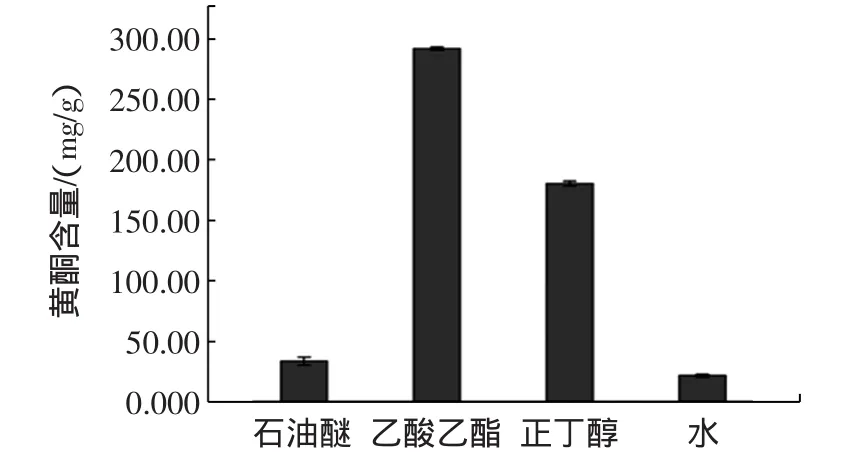
图1 芒果叶不同极性部位提取物的黄酮含量Fig.1 Flavonoid content of different polarity fractions of extracts from mango leaves
由图1可以看出,芒果叶不同极性部位提取物中黄酮含量具有较大的差异。含量最高的是乙酸乙酯部位,为(292.063±1.100)mg/g;含量最低的是水部位,为(21.717±1.157)mg/g。黄酮含量大小顺序为乙酸乙酯部位>正丁醇部位>石油醚部位>水部位。
2.2 测定方法的考察
由于DPPH自由基会受到时间和温度的影响,但其在一定条件下是相对稳定的。所以对DPPH热稳定性,以及样品抗氧化温度和时间进行考察,以得到DPPH稳定反应的温度范围,建立样品最优反应方法。
2.2.1 DPPH的热稳定性
不同温度下避光水浴30 min后,分别测定DPPH溶液的吸光度,得出其热稳定性曲线,见图2。
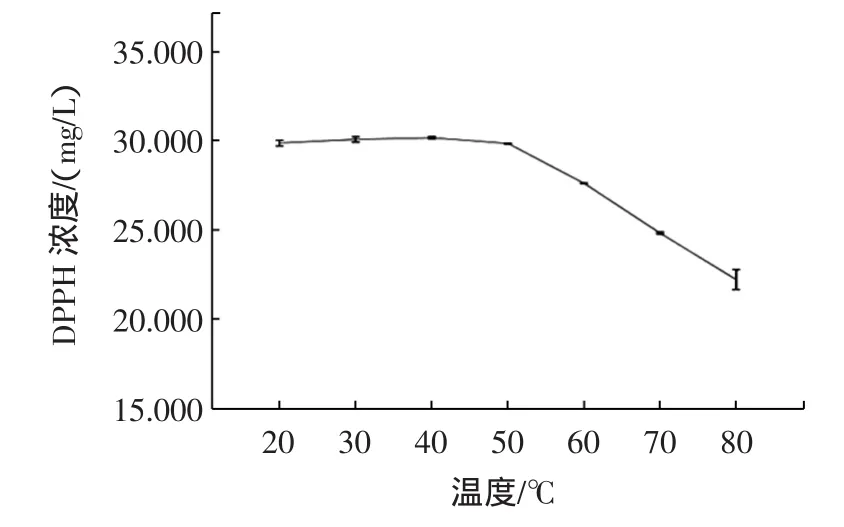
图2 不同温度下DPPH溶液的热稳定性Fig.2 The thermal stability of the DPPH in different temperatures
从图2可以看出,DPPH溶液在20℃~50℃范围内较为稳定,对应的浓度平均为:(30.007±0.169)mg/L。而60℃~80℃明显下降,浓度平均值从(27.627±0.008)mg/L降到(22.222±0.563)mg/L。表明DPPH溶液在20℃~50℃范围较稳定,故将测试的温度设定在此范围。
2.2.2 测定的温度
按照1.3.4.4项的方法,得出不同样品溶液在20℃~50℃的清除率,见图3。

图3 芒果叶不同极性部位提取物在不同温度下的清除率Fig.3 The scavenging percentage of different polarity fractions of extracts from mango leaves in different temperatures
由图3可以看出,芒果叶石油醚和乙酸乙酯萃取物在20℃~50℃范围内对DPPH自由基清除率,均在50℃时清除率最高。所以选择50℃为两部分萃取物反应最佳温度。芒果叶正丁醇萃取物此范围内清除率相差不大,其中30℃时清除率为最高,可选择30℃为此部分萃取物反应温度;芒果叶水部位在40℃时清除率为最高,所以此部分反应的温度选择40℃。
在DPPH热稳定范围内,石油醚和乙酸乙酯萃取物对DPPH的清除能力均随着温度的升高而增加,正丁醇和水部位提取物达到最高值后略微有所下降,但相差不大。
2.2.3 反应的时间
不同样品溶液于较好的反应温度条件下,不同反应时间的清除率,结果见图4。
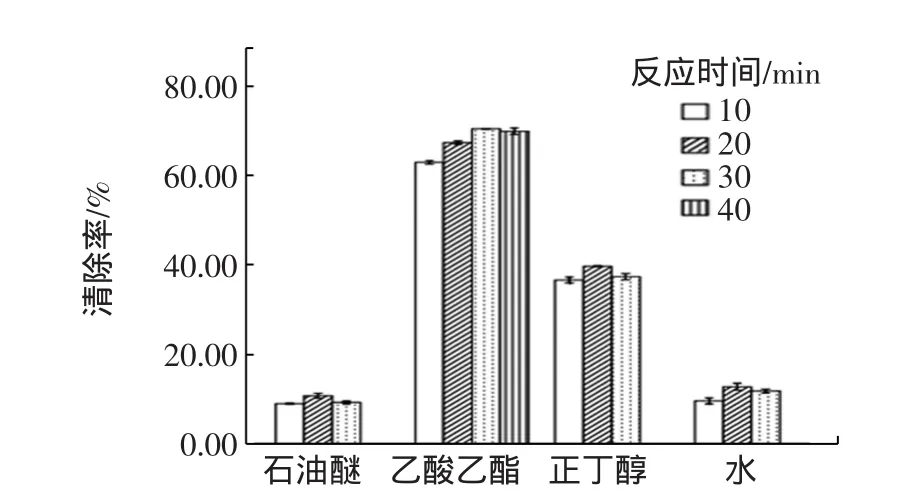
图4 芒果叶不同极性部位提取物在不同时间下的清除率Fig.4 The scavenging percentage of different polarity fractions of extracts from mango leaves in different times
从图4可以看出,芒果叶石油醚、正丁醇萃取物以及水部位提取物在各自最佳反应温度下均以20 min时的样品清除率最高,所以选择20 min为此三种提取物的最佳反应时间;而乙酸乙酯萃取物的最佳反应时间为30 min。
2.3 芒果叶提取物清除DPPH自由基的能力
根据已经确定的反应温度、时间,对芒果叶的石油醚、乙酸乙酯、正丁醇和水部位提取物进行DPPH自由基清除率的测定,并与芒果苷、抗坏血酸标准品进行比较,结果见图5。
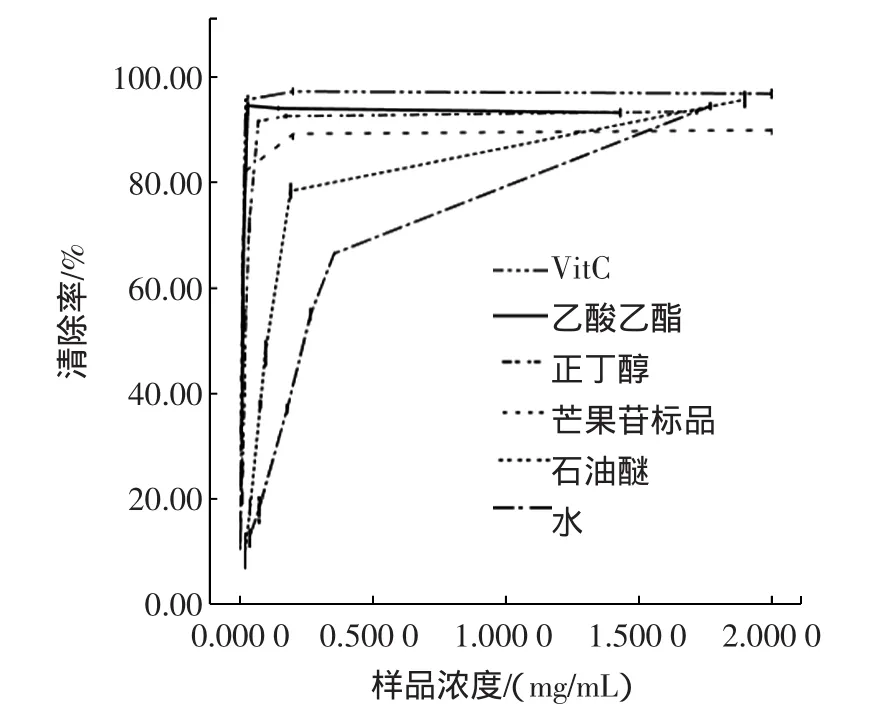
图5 芒果叶不同极性部位提取物对DPPH的清除能力Fig.5 The scavenging activities of different polarity fractions of extracts from mango leaves towards DPPH feel radical
从图5可知,芒果叶四种不同极性部位的提取物对DPPH自由基均具有一定清除能力,且随着样品溶液质量浓度的增加,清除率也随之增强,当清除率达到90%以上后,各提取物的清除率增长减缓,表明样品与DPPH反应达到饱和。其中乙酸乙酯、正丁醇萃取物与芒果苷、VitC标品的清除率相当。
由于各样品溶液及标准品溶液浓度与清除率间并不呈线性关系,所以使用SPSS17.0的PROBIT方法进行回归分析。得到方程:PROBIT(P)=Intercept+BX,模型拟合优度经过卡方检验,再从PROBIT分析的结果中查得IC50值(即Prob=0.50时的样品浓度),及其95%置信区间,结果见表1。

表1 芒果叶不同极性部位提取物及对照品的IC50值Table 1 The IC50values of different polarity fractions of extracts from mango leaves and reference substance
结果表明,芒果叶的石油醚、乙酸乙酯、正丁醇萃取物及水部位提取物的IC50值分别为:102.877、9.014、19.494、221.784 μg/mL。IC50值越小,表明清除 DPPH 自由基的能力越强,从试验结果可以看出:芒果叶不同极性部位提取物抗氧化活性的顺序,乙酸乙酯部位>正丁醇部位>石油醚部位>水部位。乙酸乙酯提取物的IC50值与对照标品芒果苷及VitC的相当。
2.4 芒果叶不同极性部位提取物黄酮含量与抗氧化活性的相关性
使用SPSS17.0软件对芒果叶各部位提取物的黄酮含量与其清除DPPH自由基的IC50值进行相关性分析,结果显示黄酮含量与IC50值的相关系数为-0.872(P=0.000),表明黄酮含量越高其IC50值越小。以“提取剂的种类”为协变量的情况下,黄酮含量与IC50值的偏相关系数为-0.945(P=0.000),说明考虑不同极性的提取剂对抗氧化活性的影响后,两者间的相关系数变大。同时,“提取剂的种类”与IC50值的Spearman相关系数为0.482,“提取剂的种类”对IC50值的影响较小,所以可以认为黄酮含量是影响IC50值的主要因素,即芒果叶不同极性提取物的抗氧化活性的变化,主要受到其黄酮类物质含量高低的影响。
3 结论
本研究以攀枝花凯特芒果叶为原料,用95%乙醇冷浸提取后再依次用石油醚、乙酸乙酯、正丁醇进行萃取,分别得到三个组分,最后的剩余部分为水部位。用DPPH法综合评价芒果叶不同部位提取物的抗氧化活性,以IC50值作为评价清除DPPH自由基能力的指标,用芒果苷和抗坏血酸作为对照品进行自由基清除率的比较。试验结果表明芒果叶不同极性部位提取物均具有一定的抗氧化活性,其中乙酸乙酯萃取物抗氧化活性最强,其次依次为正丁醇、石油醚、水部位提取物。分析结果表明,芒果叶各极性部位提取物的黄酮含量与清除DPPH自由基的能力呈负相关,芒果叶各部位提取物的黄酮含量是影响其抗氧化活性的主要因素。
本试验初次对芒果叶的抗氧化活性进行测定分析,且首次对抗氧化的反应条件进行考察与优化,结果发现其乙酸乙酯萃取物具有很高的抗氧化活性,与芒果苷及抗坏血酸标品相当。由于芒果树每年会有枝叶修剪以及大量落叶,收集方便且目前没有对其进行利用,所以充分利用芒果叶,将芒果叶提取物用于抗氧化活性用途的开发,可以避免资源的浪费、提高芒果的综合开发价值。但其各部位提取物的化学成分及其具体抗氧化机制尚未明确,有待进一步深入研究。
[1]彭长连,陈少薇,林植芳,等.用清除有机自由基DPPH法评价植物抗氧化能力[J].生物化学与生物物理进展,2000,27(6):658-661
[2]杨建雄.连翘叶黄酮的体外抗氧化作用[J].天然产物研究与开发,2007,19:97-99
[3]华辉,郭勇.黄酮类化合物药理研究进展[J].广东药学,1999,9(4):9-12
[4]张尊听,贺云,刘谦光,等.分光光度法测定太白山20种中草药的抗氧化活性[J].分析试验室,2002,21(2):50-52
[5]姜唯唯,刘刚,张晓喻,等.微波真空冷冻干燥对芒果干制品品质特性的影响[J].食品科学,2012,33(18):49-52
[6]江苏新医学院.中药大辞典[M].上海:上海科学技术出版社,1986:1040
[7]广西壮族自治区卫生厅.广西中药材标准[M].南宁:广西科学技术出版社,1992:54
[8]邓家刚,曾春晖.芒果叶及芒果苷30年研究概况[J].广西中医学院学报,2003,6(2):44-49
[9]周丽明,李春美.芒果多酚提取条件的研究[J].食品科技,2007(3):107-109
[10]Sato T,Kawamoto A,Tamura A,et al.Mechanism of antioxidant action of pueraria glycoside(PG)-1(an isoflavonoid)and mangiferin(a xanthonoid)[J].Chemical and Pharmaceutical Bulletin,1992,40(3):721-724
[11]Pitchaon Maisuthisakul,Michael H.Gordon.Antioxidant and tyrosinase inhibitory activity of mango seed kernel by product[J].Food chemistry,2009,117(2):332-341
[12]C M Ajila,K A Naidu,S G Bhat,et al.Bioactive compounds and antioxidant potential of mango peel extract[J].Food Chemistry,2007,105(3):982-988
[13]陈昱洁,盛占武,施瑞城,等.3个品种芒果果核乙醇提取物抗氧化活性[J].食品科学,2011,32(9):8-13
[14]兰莎.藏药樱草杜鹃抗氧化活性成分的筛选研究[D].成都中医药大学,2012
[15]Mirella N,Gaulejac N.Comparative study of polyphenol scavenging activities assessed by different methods[J].J Agric Food Chem,1999,47(2):425-431
[16]Irene Parejo,Carles Codina.Evaluation of scavenging activity assessed by Co(II)/EDTA-induced luminol chemiluminescence and DPPH·(2,2-diphenyl-1-picrylhydrazyl)free radical assay[J].Journal of Pharmacological and Toxicological Methods,2000,44(3):507-512

