美拉德反应对豌豆蛋白水解物乳化性和抗氧化性的影响
张 欣,熊幼翎,陈 洁
(江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡 214122)
酶法水解蛋白,不仅能够提高蛋白的膳食营养吸收率,改善蛋白的溶解度,还能获得完整蛋白所不具备的一些生理活性,如抗氧化性等[1-3]。然而,由于分子量降低,表面电荷增加,酶法水解又会破坏蛋白的一些功能性质,尤其是乳化性,进而影响了水解蛋白在食品加工中的应用。美拉德反应是蛋白自由氨基与还原糖羰基之间发生的非酶褐变反应,广泛存在于食品加工和贮藏过程中。此反应中蛋白与糖发生共价结合,能够有效地改善蛋白的功能性质,如溶解性、乳化性和热稳定性等[4-6]。由于美拉德反应普遍存在且不需添加化学催化剂,因此是蛋白改性的一种行之有效的方法。
豌豆蛋白是近年来新兴的一种优质蛋白,不仅价格低廉,营养价值高,还具有低致敏等特点[7-8]。本文拟采用不同商业蛋白酶制备的豌豆蛋白水解物为原料,考察不同分子大小的糖(葡萄糖、麦芽糊精和葡聚糖)对其乳化活性及抗氧化活性的影响,从而探索提高豌豆蛋白水解物功能性质的有效途径,为制备兼具良好乳化性的抗氧化豌豆蛋白水解物提供实验依据和理论参考。
1 材料与方法
1.1 材料与仪器
豌豆分离蛋白(pea protein isolate,PPI)(等电点沉淀法提取[9],蛋白含量≥90%);碱性蛋白酶(Alcalase)、风味蛋白酶(Flavorzyme)、复合蛋白酶(Protamex) 购自诺维信公司;葡萄糖、麦芽糊精(葡萄糖当量 13.0~17.0)、2,4,6-三硝基苯磺酸、抗坏血酸、大豆卵磷脂 购自Sigma公司;葡聚糖(分子量40000) 购自美国Spectrum公司;亚硫酸钠、三氯化铁、三氯乙酸、硫代巴比妥酸等 购自美国Fisher公司。
UV-2401PC紫外扫描分光光度计 日本Shimadzu公司;Precision 280-Series恒温水浴锅 美国Thomas公司;Polytron PT10/35均质器 美国Capitol公司;Sorvall RC-5B离心机 美国Sorvall公司;Fluoro Max-3荧光分光光度计 美国Horiba公司。
1.2 实验方法
1.2.1 豌豆蛋白水解物(PPH)的制备 参照 Zhang等[10]的方法将加热(90℃,5min)处理的 2g/100mL豌豆蛋白溶液分别与碱性蛋白酶、风味蛋白酶和复合蛋白酶作用0.5h。灭酶结束后将各水解物pH调节至7.0,并在9000g离心10min除去不溶颗粒。样品冻干并在4℃保存。
1.2.2 美拉德反应产物的制备 参照Zhu[11]等的方法,采用相对温和的条件将反应尽量控制在初期即生成大量希夫碱的阶段。因此,将豌豆蛋白水解物分别与葡萄糖、麦芽糊精和葡聚糖混合于50mmol/L,pH7.0的磷酸盐缓冲液中,得到蛋白水解物和糖终浓度分别为2%和10%的混合物。将混合物转移至具塞试管中,60℃反应48h。豌豆蛋白水解物在相同条件下加热,做为对照组。反应完成后立即放入冰水中冷却,并在4℃存放。
1.2.3 游离氨基含量测定 参照 Benjakul和Morrissey[12]的方法,以2mmol/L亮氨酸做标准曲线,采用2,4,6-三硝基苯磺酸法进行测定(样品稀释20倍)。
1.2.4 希夫碱生成量测定 样品(稀释20倍)以3300×g离心10min。上清液在280~400nm进行紫外扫描。以加热但未加糖的豌豆蛋白水解物做空白。希夫碱的生成量以304nm处峰值的大小表示[11]。
1.2.5 内源色氨酸荧光测定 样品(稀释20倍)以3300×g离心10min。上清液在激发波长295nm,发射波长300~400nm下扫描,狭缝宽度均为5nm。以10mmol/L,pH7.0磷酸盐缓冲液做空白。
1.2.6 SDS-PAGE 浓缩胶和分离胶丙烯酰胺浓度分别为5%和12%。样品稀释至蛋白浓度4mg/mL,再与样品缓冲液等体积混合,加热 3min,上样 15μL[13]。
1.2.7 乳化性测定
1.2.7.1 乳状液的制备 用磷酸盐缓冲液(10mmol/L,pH7.0)稀释各反应物到蛋白浓度为5mg/mL,再与大豆油以3∶1体积混合,用分散器以13600r/min的速度分散2min。将制备好的乳状液迅速倒入平底小烧杯中。
1.2.7.2 乳化活性和乳化稳定性的测定 在离烧杯底部0.5cm处取刚制备好的乳状液15μL于5mL 0.1%SDS溶液中,混匀后在500nm处测定吸光值。乳化活性指标(EAI)用0时刻吸光值A0表示。乳化稳定性指标ESI(%)=(At/A0)×100,其中A0和At分别表示放置0和t(t=30min)时间的乳状液的吸光度值[14]。
1.2.8 抗氧化性测定 (抑制脂质体氧化能力)参考Sinnhuber等[15]的方法,将样品与脂质体溶液(0.2mg/mL大豆卵磷脂)混合,加入100μmol/L三氯化铁 和2mmol/L抗坏血酸引发脂肪氧化,并在37℃保温1h。加入1g/100mL硫代巴比妥酸溶液和2.8g/100mL三氯乙酸溶液,沸水浴反应15min,冷却到室温。加入5mL氯仿去除脂类的影响,上层溶液在532nm波长处测吸光度。硫代巴比妥酸反应物(TBARS)生成量表示为每升脂质体溶液所含丙二醛的毫克数(mg/L)。
1.2.9 统计分析 每个实验重复3次,结果表示为平均值±标准差;数据统计分析采用Statistix 9.0软件中线性模式,显著性分析采用最小显著性法(LSD)检验,p<0.05 认为差异显著。
2 结果与讨论
2.1 游离氨基含量
由于酶的分解活力、作用位点等的差异,不同蛋白酶水解物的水解度差异显著[16],因而也导致了相同蛋白浓度下各水解物的游离氨基含量有所不同。由图1可知,豌豆蛋白水解物与糖反应48h后,游离氨基含量明显下降,表明α-或ε-氨基结合到糖分子的羰基上,生成了糖基化产物。通常,游离氨基含量下降的程度可用来衡量美拉德反应的强度和糖类的反应活性[17]。由此可见,葡萄糖的反应活性最大,美拉德反应最强烈,其次为麦芽糊精和葡聚糖。对照组(加热豌豆蛋白水解物)的游离氨基含量亦略有下降,可能由于赖氨酸残基或精氨酸的胍基发生交联导致[18]。不同蛋白酶水解物反应体系显示了相似的游离氨基变化趋势。

图1 豌豆蛋白酶水解物与糖美拉德反应体系的游离氨基含量变化Fig.1 Free amine content of Maillard-type PPH-saccharide complexes.
2.2 希夫碱生成量
希夫碱是美拉德反应初级阶段的产物,没有明显的颜色变化,且具有良好的功能性质。有文献报道,304nm可作为衡量希夫碱生成量的吸收波长,也可作为衡量蛋白和糖聚合程度的指标[11]。从图2可以看出,体系反应48h后,各产物在304nm处的吸光值均有所增加,表明希夫碱物质的生成。葡萄糖参与的反应体系的希夫碱生成量远高于麦芽糊精和葡聚糖,表明该糖反应最剧烈,葡聚糖参与的反应体系的希夫碱生成量最低,表明该糖反应最温和,这一结果与游离氨基含量变化一致。此外,各反应物在可见波长区的吸收也有所增加,可能是生成了一些美拉德分解产物的发色团[19]。

图2 豌豆蛋白酶水解物与糖的美拉德反应产物中希夫碱的生成量Fig.2 Schiff base production in the Maillard conjugation of PPHs and saccharides
2.3 内源色氨酸荧光
色氨酸残基所处微环境的极性会影响其荧光最大发射波长,故色氨酸的内源荧光性可反映蛋白质内部结构的变化[20]。图3表明,美拉德反应产物的荧光最大发射波长较对照组(加热豌豆蛋白水解物)发生红移,最大波长由356nm移动至361nm。说明豌豆蛋白水解物因与糖发生共价交联而使色氨酸残基暴露于更加亲水的环境中。葡聚糖衍生的反应物的最大发射波长几乎没有移动,表明其与豌豆蛋白水解物反应程度最低,故而对水解物的内部疏水结构影响最小。所有美拉德反应产物的荧光强度都较对照组有所降低,说明糖分子共价接合于水解物的表面,从而屏蔽了其内部的荧光强度。所有糖中,葡萄糖衍生的反应物的荧光强度最低,发射波长最长,进一步证明了葡萄糖的反应活性最大,美拉德反应最强烈。
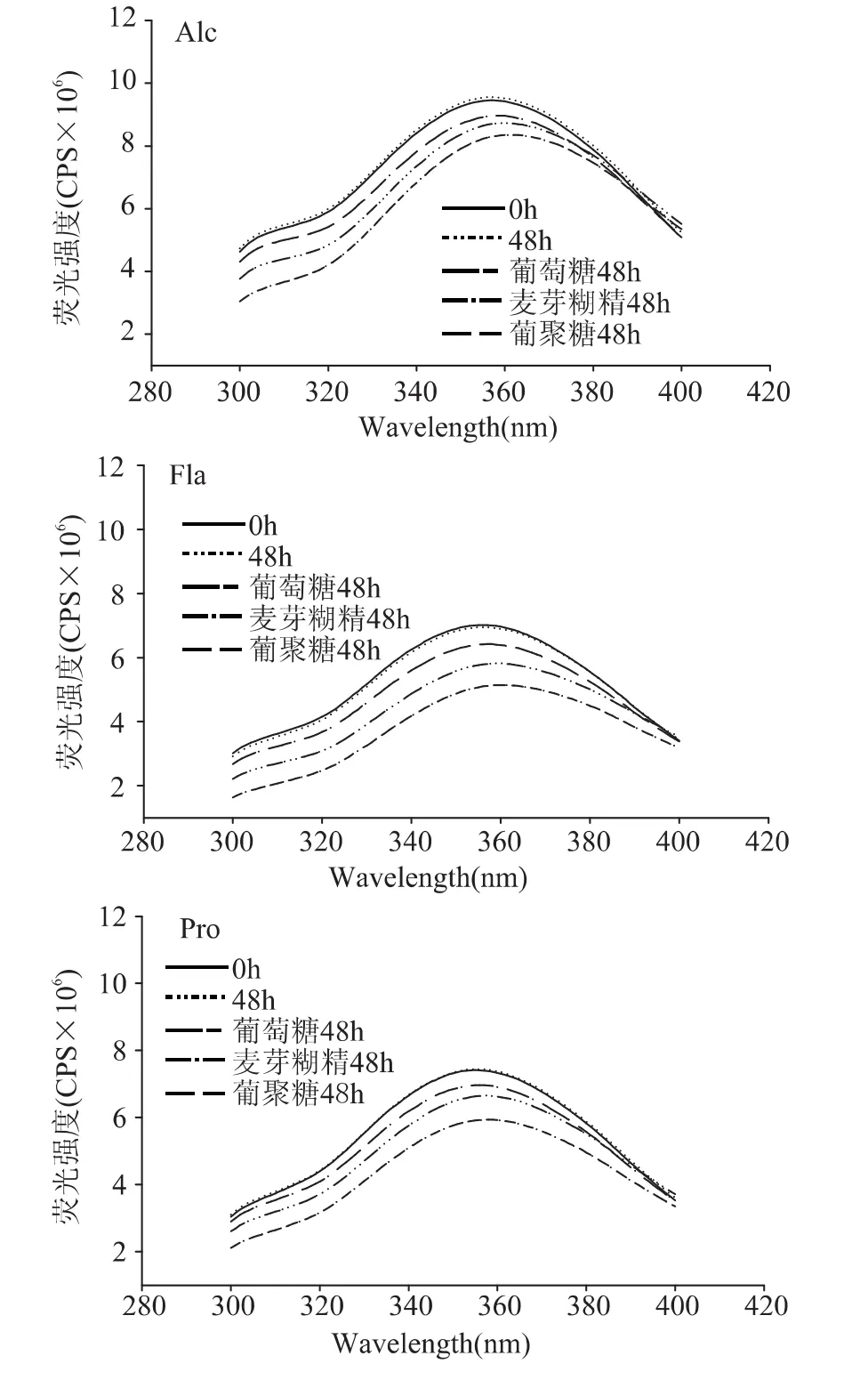
图3 豌豆蛋白酶水解物与糖的美拉德反应产物的荧光强度变化Fig.3 Intrinsic fluorescence intensity of Maillard-type PPH-saccharide complexes
2.4 SDS-PAGE
由图4可见,豌豆蛋白水解物与糖发生共价结合后,产物的电泳条带不同程度地向着更高分子量移动,说明美拉德反应生成了高分子量的共聚物。所有糖中,葡聚糖衍生的反应物的分子量增加最多(碱性蛋白酶处理的反应物除外),可在分离胶的上部看见深色的大分子物质条带。葡萄糖和麦芽糊精因分子量相对较小,故反应物分子量增加亦较小,反应前后电泳条带变化不显著。三种酶水解物中,碱性蛋白酶水解物由于自身分子量低,故美拉德反应产物分子量提高不明显,即使与葡聚糖生成的反应物,在电泳图中仍无法识别。复合蛋白酶水解物与葡聚糖的反应物分子量提高最为明显(如箭头所指),表明该酶水解物的美拉德反应活性最高。
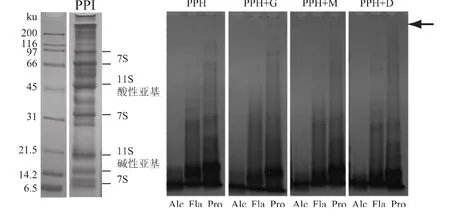
图4 豌豆蛋白酶水解物与糖的美拉德反应产物的聚丙烯酰胺凝胶电泳图(非还原性)。Fig.4 SDS-PAGE of Maillard-typePPH-saccharide complexes under non-reducing condition
2.5 乳化性
如图5所示,风味蛋白酶和复合蛋白酶水解物发生美拉德反应后,乳化活力(EAI)明显高于反应前(p<0.05)。可见,豌豆蛋白水解物发生糖基化反应后,空间结构和亲水-疏水平衡得到改善,使其更利于吸附到油水界面。通常认为,反应物中的蛋白部分能够降低油水界面的张力并在油滴表面形成界面膜,而接合的糖分子则能够在界面膜周围形成立体网状结构,增加界面膜的厚度和机械强度[21]。ESI值计算与EAI值有关,故结合EAI数据可知各美拉德反应产物具有较高的乳化稳定性,即能够在脂肪球表面形成一层坚实的保护膜,防止液滴聚集、合并。虽然葡聚糖的美拉德反应程度最低,但其分子结构最大,能够明显地修饰多肽分子的空间结构,因此,显著地改善了豌豆蛋白水解物的乳化性。此外,大分子葡聚糖亦可在水相中通过增稠作用提高乳化稳定性。对复合蛋白酶水解物的各美拉德反应产物制备的乳状液进行显微镜观察(如图6),得到了与EAI和ESI测定一致的结论,即随着糖分子结构增大,美拉德反应产物的乳化性逐渐提高,乳化颗粒逐渐增多,且颗粒粒径逐渐减小。
2.6 抗氧化性(抑制脂质体氧化能力)
由表1可知,三种豌豆蛋白水解物均具有显著抑制脂质体氧化的能力(p<0.05),尤其是风味蛋白酶和复合蛋白酶水解物。这与三种水解物具有极强的自由基清除能力和金属离子螯合能力有关[16]。此外,豌豆蛋白水解物亦能够在脂质体颗粒表面形成一层保护壁垒,从而阻断氧化胁迫对脂肪颗粒的损伤[10]。各水解物与糖发生共价结合后,因糖种类不同对其抑制脂质体氧化能力产生了不同的影响。其中,葡萄糖衍生的反应物的抗氧化活性最差。与对照组相比,甚至表现出促氧化作用。原因可能是葡萄糖的反应活性最高,因此消耗的多肽氨基侧链也最多,故而导致一些具有抗氧化活性的氨基酸缺失或失活。葡聚糖衍生的反应物的抑制脂质体氧化能力最强,这与其反应温和,对多肽结构影响小有关。葡聚糖与复合蛋白酶水解物的反应物显示了最高的抗氧化活性。可见,在利用初期美拉德反应制备功能性豌豆蛋白水解物的同时,亦能够很好地保留多肽的抗氧化活性。

图5 豌豆蛋白酶水解物与糖的美拉德反应产物的乳化活性和乳化稳定性。Fig.5 EAI and ESI of Maillard-type PPH-saccharide complexes
3 结论
通过美拉德反应使豌豆蛋白水解物与糖分子发生共价结合,能够有效地改善豌豆蛋白水解物的乳化活性,并能够保留水解物自身的抗氧化活性。葡聚糖,虽然反应活性低于小分子糖,但能够显著地修饰多肽分子的空间结构(形成高分子共聚物),从而明显改善豌豆蛋白水解物的乳化活性。此外,葡聚糖亦能在水相中起增稠、稳定的作用。所以,利用葡聚糖参与的美拉德反应,可以获得兼具良好乳化性和高抗氧化活性的豌豆蛋白水解物。
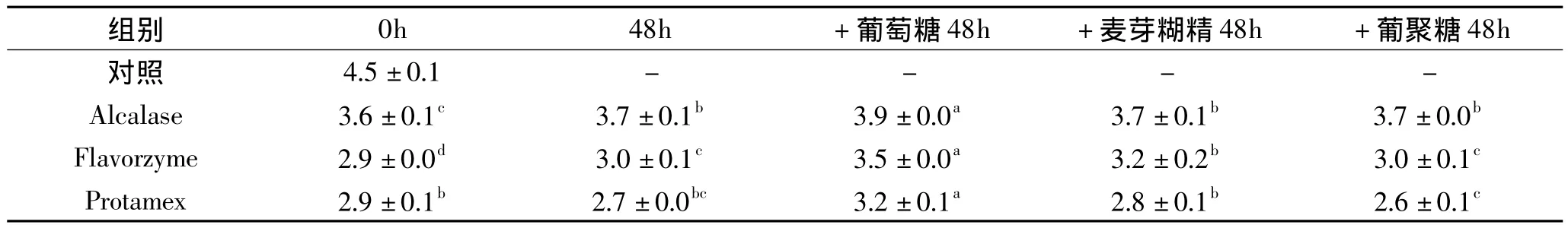
表1 豌豆蛋白酶水解物与糖的美拉德反应产物对脂质体氧化(TBARS生成量)的抑制作用Table 1 Inhibition of lipid oxidation(TBARS formation)by Maillard-type PPH-saccharide complexes
[1]Peña- Ramos E A,Xiong Y L.Whey and soy protein hydrolysates inhibit lipid oxidation in cooked pork patties[J].Meat Science,2003,64:259-263.
[2]Elias R J,Bridgewater J D,Vachet R W,et al.Antioxidant mechanisms of enzymatic hydrolysates of β-lactoglobulin in food lipid dispersions[J].Journal of Agricultural and Food Chemistry,2006,54:9565-9572.
[3]Rao S,Sun J,Liu Y,et al.ACE inhibitory peptides and antioxidant peptides derived fromin vitrodigestion hydrolysate of hen egg white lysozyme[J].Food Chemistry,2012,135:1245-1252.
[4]Hiller B,Lorenzen P C.Functional properties of milk proteins as affected by Maillard reaction induced oligomerisation[J].Food Research International,2010,43:1155-1166.
[5]Liu Y,Zhao G,Zhao M,et al.Improvement of functional properties of peanut protein isolate by conjugation with dextran through Maillard reaction[J].Food Chemistry,2012,131:901-906.
[6]Guo X,Xiong Y L.Characteristics and functional properties of buckwheat protein- sugar Schiff base complexes[J].LWT-Food Science and Technology,2013,51:397-404.
[7]Dietary protein quality evaluation in human nutrition.Report of an FAO Expert Consultation.FAO Food and Nutrition Paper,2011,92.
[8]Davidsson L,Dimitriou T,Walczyk T,et al.Iron absorption from experimental infant formulas based on pea(Pisum sativum)protein isolate:the effect of phytic acid and ascorbic acid[J].British Journal of Nutrition,2001,85:59-63.
[9]Jiang J,Chen J,Xiong Y L.Structural and emulsifying properties of soy protein isolate subjected to acid and alkaline pH- shifting processes[J].Journal of Agricultural and Food Chemistry,2009,57:7576-7583.
[10]Zhang X,Xiong Y L,Chen J,et al.Synergistic inhibition of lipid oxidation by pea protein hydrolysate coupled with licorice extract in a liposomal model system[J].Journal of Agricultural and Food Chemistry,2013,61:8452-8461.
[11]Zhu D,Damodaran S,Lucey J A.Formation of whey protein isolate(WPI) - dextran conjugates in aqueous solutions[J].Journal of Agricultural and Food Chemistry,2008,56:7113-7118.
[12]Benjakul S,Morrissey M T.Protein hydrolysates from Pacific whiting solid waste[J].Journal of Agricultural and Food Chemistry,1997,45:3423-3430.
[13] Liu G,Xiong Y L.Electrophoretic pattern,thermal denaturation,andin vitrodigestibility of oxidized myosin[J].Journal of Agricultural and Food Chemistry,2000,48:624-630.
[14]Pearce K N,Kinsella J E.Emulsifying properties of proteins:evaluation of a turbidometric technique[J].Journal of Agricultural and Food Chemistry,1978,26:716-723.
[15]Sinnhuber R O,Yu T C.The 2-thiobarbituric acid reaction,an objective measure of the oxidative determination occurring in fats and oils[J].Journal of Japan Oil Chemists′Society,1977,26:259-267.
[16]张欣,熊幼翎,陈洁.加热和碱性处理豌豆蛋白对其不同酶水解物抗氧化性的影响[J].食品科学,2013,34(15):5-10.
[17]Laroque D,Inisan C,Berger C,et al.Kinetic study on the Maillard reaction.Consideration of sugar reactivity[J].Food Chemistry,2008,111(4):1032-1042.
[18]Ajandouz E H,Desseaux V,Tazi S,et al.Effects of temperature and pH on the kinetics of caramelisation,protein cross-linking and Maillard reactions in aqueous model systems[J].Food Chemistry,2008,107:1244-1252.
[19]Kim J,Lee Y.Antioxidant activity of Maillard reaction products derived from aqueous glucose/glycine,diglycine,and triglycine model systems as a function of heating time[J].Food Chemistry,2009,116:227-232.
[20]Jiménez-Castaňo L,López-Fandiňo R,Olano A,et al.Study on β-lactoglobulin glycosylation with dextran:effect on solubility and heat stability[J].Food Chemistry,2005,93:689-695.
[21]钟芳,麻建国,王璋,等.蛋白质-多糖共价复合物[J].食品科技,2000(5):12-15.

